Fc受体
FcR是一类能够和免疫球蛋白(Ig)重链羧基末端的功能区Fc段特异结合的细胞表面蛋白,在抗体依赖性免疫应答过程中至关重要。
1、FcR分类
不同类型的细胞可以表达不同类型的FcR,不同结构类型的Ig也和不同类型的FcR结合,从而诱导后续的不同类型的免疫反应。按FcR所结合的Ig种类不同可将其分为五类,即IgG(FcγR)、IgE(FcεR)、IgA(FcαR)、IgM(FcμR)和IgD(FcδR)。
● IgG的FcR
如前所述,IgG类型抗体的Fc受体是FcγR,依据和Fc片段亲和力的强弱FcγR又可以被分为三个亚家族:FcγRI、FcγRII和FcγRIII(与IgG亲和力FcγRI>FcγRIII>FcγRII)。F每种类型都由1号染色体长臂同一区域的特定基因编码。每个 FcgR 还有几个密切相关的基因,由于分子结构不同,它们具有不同的抗体亲和力。基于此,FcγRII可进一步分为FcγRIIa(CD32a)、FcγRIIb(CD32b)和FcγRIIc(CD32c)三个亚类,FcγRIII可以进一步分为FcγRIIIa(CD16a)和 FcγRIIIb(CD16b)两个亚类。
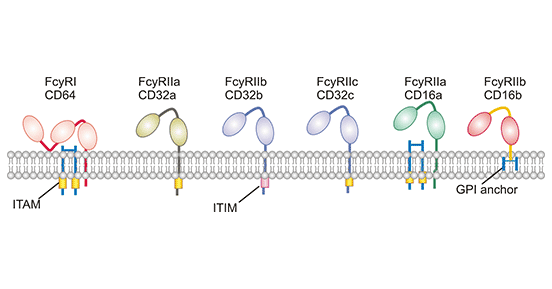
图1. The structure of Fc gamma receptors
如图1所示,FcγR的基本结构相似,分为胞外区、跨膜区及一个胞内尾巴。在胞外部分,FcγRII和FcγRIII含有两个Ig样功能区,而FcyRI含有三个Ig样功能区,该特性允许 FcγRI 结合信号IgG分子(或单体)。但请注意,所有FcγR必须结合免疫复合物中的多个IgG分子才能被激活。在FcγR中,FcγRI、FcγRIIa、FcγRIIc和FcγRIIIa具有经典的细胞质ITAM信号结构域,可以激活效应免疫细胞。相反,FcγRIIb是唯一的抑制性FcγR,它具有介导信号抑制的细胞质ITIM。
此外,IgG还有另一个非常重要的细胞表面受体:FcRn(neonatal Fc receptor)。FcRn的结构和MHC-I分子类似,可以介导IgG从母体通过胎盘传递给婴儿,也可以帮助母乳中的IgG通过哺乳婴儿小肠细胞。
● IgE的FcR
与IgE Fc段特异性结合的受体是FcεR。根据亲和力的不一样,FcεR可进一步分为FcεRI和FcεRII。FcεRI在嗜酸性粒细胞和肥大细胞表面表达,与IgE单体高亲和力结合。抗原与结合于FcεRI上的IgE相互作用可触发炎性介质及细胞因子的释放。FcεRI是由一个IgE结合糖蛋白(α链),一条跨膜β链及一条短的(9KDa)的二聚体γ链(与FcγRIII相连的γ链相同)的四聚体组成。它在细胞膜上的表达需要γ链的存在。FcεRII以低亲和力结合IgE。分布于B细胞、单核细胞、嗜酸性粒细胞等细胞上。具有调节作用和效应器的功能。FcεRII不属于Ig超家族,与动物的C型血凝素相似。
● 其他FcR
IgA、IgM和IgD对应的FcR分别是FcαR、FcμR和FcδR。FcαR(CD89)为分子量60kDa跨膜糖蛋白,属Ig超家族成员。胞膜外有2个C2结构域,为中亲和力受体,主要表达于单核细胞、巨噬细胞、中性粒细胞等细胞表面,介导吞噬、ADCC以及炎症介质的释放。中性粒细胞表面FcαR可结合血清型和分泌型IgA1和IgA2,热或化学物质凝集的IgA可刺激中性粒细胞脱颗粒。FcμR可持续表达与B系细胞(从前B细胞到成熟N淋巴细胞阶段),也存在于许多活化的T淋巴细胞上。FcδR是一种40kDa的表面膜蛋白。
此外, 2000年,Shibuya等人在人类和小鼠中发现了Fcα/μR,这是一种新的IgM和IgA FcR。Fcα/μR 在脾脏和次级淋巴滤泡中心的大多数 B 淋巴细胞和巨噬细胞上组成型表达。Fcα/μR参与微生物免疫防御的初级阶段。






