TROP2--肿瘤治疗的重要靶点
日期:2019-08-29 11:50:27
TROP2属于TACSTD家族,是由TACSTD2基因编码表达的细胞表面糖蛋白,又名肿瘤相关钙离子信号转导子2(TACSTD2)、表皮糖蛋白1(EGP-1)、胃肠肿瘤相关抗原(GA733-1)、表面标志物1(M1S1)[1]。TROP-2在多种恶性肿瘤中过表达,是一种与恶性肿瘤发生、侵袭和转移有关的癌基因。
1. TROP2的发现
TROP2最先是被单克隆抗体GA733-1所鉴别而分离到的一种膜抗原,因此被称为GA733-1[2]。
2. TROP2的结构特征
TROP2基因位于第1号染色体的短臂上,具体定位为1p32.1[3]。基因全长为9072bp,无内含子,只有1个外显子。TROP2在肿瘤发生中的作用似乎在进化上是保守的。小鼠Trop-2与人类同源基因序列相似度为87.4%。
TROP2蛋白初级结构是由323个氨基酸组成的36kD的多肽,是一种单次跨膜的表面糖蛋白。
TROP2由疏水性前导肽(AA 1-26),细胞外结构域(AA 27-274),一个跨膜结构域(AA 275-297)和一个胞质尾部(AA 298-323)组成。TROP2蛋白N-端为胞外域(TROP2EC),该胞外域通过一个单向跨膜螺旋(TM)与胞内短尾(TROP2IC)连接,从而固定于胞膜[4]。其细胞质尾部有高度保守的磷脂酰肌醇4,5-二磷酸(PIP2)结合序列,表明PIP2在TROP2的信号转导中起重要作用。除了PIP2结合基序外,它还含有保守的酪氨酸和丝氨酸磷酸化位点。303位丝氨酸残基的突变消除了TROP2刺激肿瘤生长的能力。该残基的磷酸化由蛋白激酶C(PKC)负责。
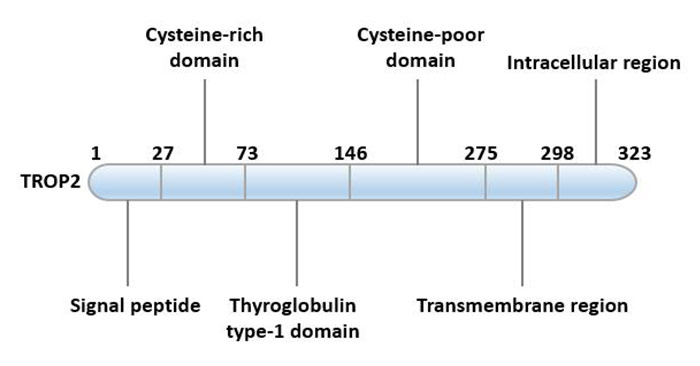
图1 TROP2的结构特征
3. TROP2的表达
TROP2 mRNA可在正常组织中检测到,包括正常角质形成细胞、肾脏、肺、卵巢和睾丸。正常情况下,TROP2主要表达于上皮细胞并在胚胎器官发育过程中起重要作用[5]。TROP2在正常组织中的表达量很低,在多种恶性肿瘤中过表达[6][7]。
TROP2的表达依赖于多种转录因子。转录因子HNF4A是影响TACSTD2 (TROP2)转录的重要因素。与癌症发展相关的其他转录因子如TP63/TP53L和Wilms tumor 1(WT1),也参与了TACSTD2 (TROP2)的转录。此外,其他参与TACSTD2转录的转录因子包括ERG、HNF1A/TCF-1、自身免疫调节因子、FOXP3等。
4. TROP2的功能
TROP-2是人类细胞中的单拷贝基因,编码I型跨膜糖蛋白,在多种恶性肿瘤中过表达。它是近年发现的与肿瘤密切相关的基因,是一种可以调节肿瘤细胞生长的信号传导分子。
TROP-2与血清IGF-II结合蛋白同源,并具有信号转导功能。此外,TROP2作为上皮细胞膜表面糖蛋白受体,可作为细胞内钙信号的跨膜转导子。
TROP-2可能代表新的细胞表面受体,在肿瘤细胞生长调节中起作用。TROP2在细胞自我更新、增殖和转化中扮演调节者角色[8]。实验证明TROP2能促进肿瘤生长,当TROP2基因被敲除后肿瘤细胞增殖受到干扰[9]。
TROP2在胚胎发育的过程中具有重要意义,它有助于胚胎着床及胎盘组织形成,并且在胚胎干细胞增殖特性维持以及器官形成发展过程中发挥重要作用。
5. TROP2信号转导
TROP2是与肿瘤密切相关的基因。它主要通过调节钙离子信号通路、细胞周期蛋白表达及降低纤黏蛋白黏附作用促进肿瘤细胞生长、增殖和转移。TROP2也可以与Wnt信号级联中的β-连环蛋白相互作用,因而对细胞核癌基因的转录、细胞的增殖起作用[8]。
TROP2的信号转导包括以下几种类型:
在蛋白激酶C(PKC)作用下,TROP2蛋白的胞内尾部丝氨酸残基(S303)被磷酸化,从而促进4,5-二磷酸磷脂酰肌醇(PIP2)水解为三磷酸肌醇(IP3)和二酰基甘油(DAG)。
IP3与内质网表面IP3受体相互作用并促进内质网中储存钙离子的释放,激活丝裂原活化蛋白激酶途径(MAPK),促进细胞周期进程。此外,胞内钙离子增加还可通过激活cyclin D1和ERK/MEK通路从而增强CREB1、c-Jun、NF-κB、Rb、STAT1和STAT3的表达[10],从而抑制肿瘤细胞凋亡。
DAG通过激活PKC,从而反馈调节TROP2磷酸化[11]。
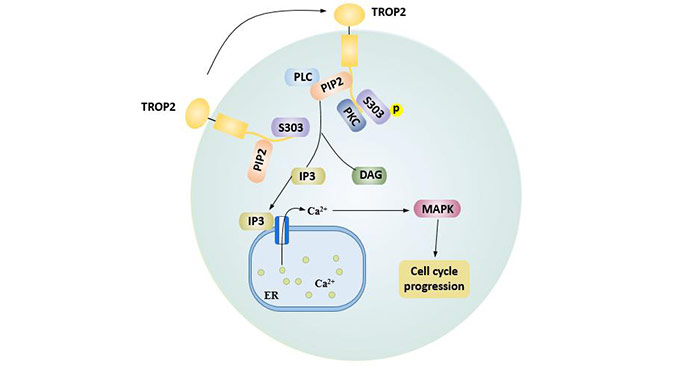
图2 由TROP2的PIP2结构域介导的细胞周期进展
TROP2在肿瘤坏死因子-α转换酶(TACE)、y-分泌酶(y-secretase)、早老素1/2(PS-1、PS-2)共同作用下水解成胞内区域(ICD),并与β-连环蛋白共定位于核内,上调下游cyclin D1和原癌基因c-myc表达,从而促进肿瘤细胞增殖。
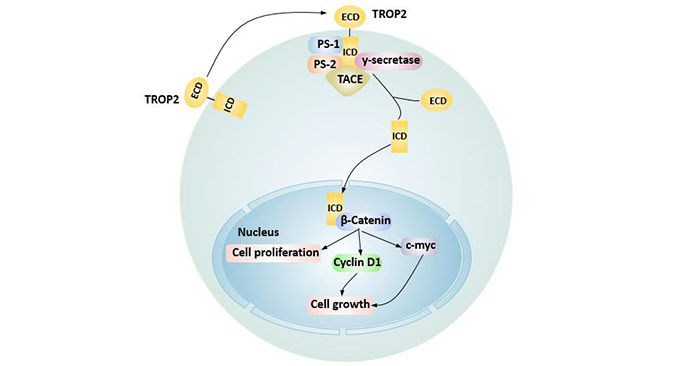
图3 TROP2通过细胞内水解调节细胞周期
TROP2的表达也增加了ERK1/2的磷酸化激活[12],从而进一步增强下游靶点AP-1转录因子活性,下调Bcl-2表达,抑制凋亡。AP-1可增加cyclin D1和cyclin E的表达,降低p27的表达而导致细胞周期加速。同时,TROP2可上调增殖标志物Ki-67表达,从而促进肿瘤细胞增殖[11]。
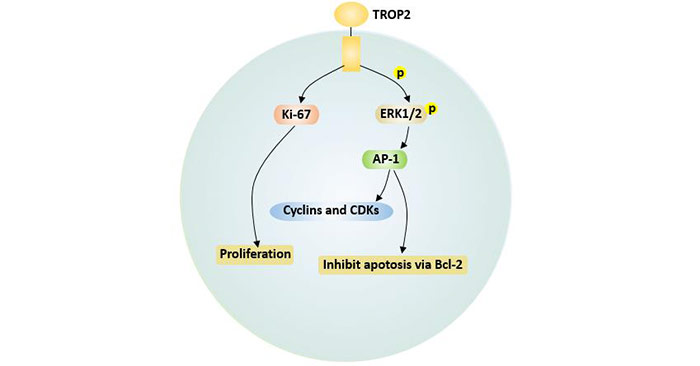
图4 TROP2介导的细胞凋亡和增殖信号
TROP2可促进胞质内蛋白激酶C受体1(RACK1)富集于细胞膜,使其接近整合素β-1(integrin β-1),减少纤黏蛋白与integrin β-1结合。TROP2与integrin β-1、talin蛋白形成复合物,导致RACK1下游的Src和FAK激活。通过整合素β-1-RACK1-Src和FAK信号传递轴而对细胞黏附进行调节[13],从而达到降低肿瘤细胞黏附作用,促进其转移扩散的作用。
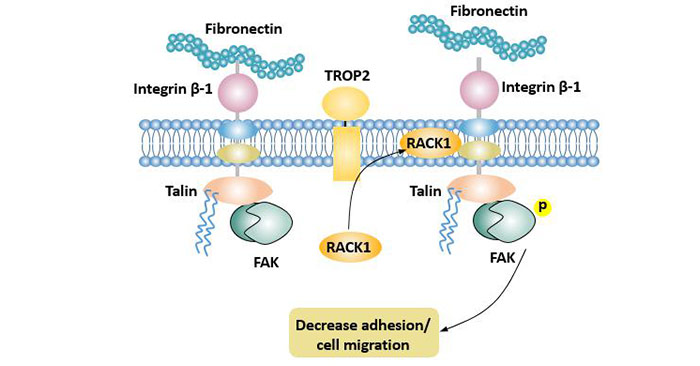
图5 TROP2促进肿瘤侵袭和转移
6. TROP2与肿瘤的关系
TROP2在多种肿瘤中都有高表达。
6.1 生殖系统肿瘤
目前女性生殖系统,尤其是子宫内膜癌与TROP2之间的关系是研究较多的。 在子宫内膜癌组织中[14],TROP2的表达与病理分级存在正相关关系,即TROP2的表达程度与疾病的恶性程度相关。TROP2蛋白高表达者生存率明显降低,因此TROP2表达可作为对那些生存期缩短患者的一项独立的预后判断指标。TROP2蛋白的高表达与卵巢癌的高侵袭性相关。总之,TROP2的表达升高与女性生殖系统恶性肿瘤之间存在密切联系,并与疾病的恶性程度相关。
TROP2与男性生殖系统肿瘤同样有密切的关系。对从前列腺癌动物实体瘤组织分离得到的细胞进行基因谱分析[15],发现TROP2基因的异常表达,提示TROP2与前列腺癌的发生和发展有关,且异常的TROP2表达对癌细胞的生物学行为起着重要作用。
6.2 消化系统肿瘤
在胰腺腺癌中存在TROP2的过表达,并与淋巴结转移、肿瘤级别和患者差的存活率明显相关,提示TROP2可作为一个独特的胰腺癌预后判断生物标志物。
在结肠癌中,TROP2蛋白在癌组织中的表达明显高于正常组织。TROP2高表达增加患者发生肝转移的几率和患者病死率,且转移的深度也更深,伴有更多淋巴结转移,预后差[16]。TROP2的表达对结肠癌细胞肿瘤形成和侵袭能力的获得是必需的,使用RNA干扰手段抑制TROP2后,癌细胞肿瘤形成和侵袭能力均被抑制,而获得外源表达TROP2的结肠癌细胞增殖能力增强。
在胃癌中,TROP2同样出现高表达。用针对TROP2抗原的凋亡激活剂2治疗胃腺癌细胞系能明显促进细胞凋亡 [17]。
此外,TROP2在食管癌组织和胆管癌中也存在高表达。
6.3 头颈部肿瘤
在口腔癌患者肿瘤组织中TROP2过度表达。TROP2在咽喉鳞状上皮细胞癌组织中的表达也升高,并与组织分化程度和淋巴结转移有关系。TROP2的表达可作为淋巴结转移、分化程度、肿瘤大小和T分级的独立预后因素[18]。
6.4 神经系统肿瘤
TROP2与脑胶质瘤的恶性程度、增殖和血管发生有密切联系,可能对脑胶质瘤的靶向治疗提供帮助。
7. 抗肿瘤药物靶点TROP2
TROP2是一种跨膜蛋白,其细胞外结构域在多种肿瘤上过度表达,因此它是靶向治疗发展的天然候选。TROP2的组织表达局限性使得治疗的毒性降低,这也是靶向TROP2治疗的优势所在。目前已经针对TROP2的免疫治疗进行了尝试[19][20]。
此外,以TROP2为靶点的抗体、抗体偶联物以及联合用药等多种形式的药物正处于研发中。抗TROP2抗体与其他化疗药物偶联的效用已在各种临床前研究中得到证实。
用于治疗TROP2过表达的上皮恶性肿瘤的抗体偶联药物(ADC)IMMU-132已处于II/III期临床试验阶段。
抗体偶联药物Sacituzumab govitecan(IMMU-132):新型抗体偶联药物Sacituzumab govitecan(IMMU-132)以TROP2为靶点,它是利用人源化抗体hRS7作为靶向载体与伊立替康活性代谢产物SN38偶联而成,可用于治疗多种上皮恶性肿瘤如乳腺癌(三阴乳腺癌)、卵巢癌、小细胞肺癌等[21]。此外,其他人源化的抗TROP2 IgG-SN-38偶联物,如抗TROP2 hRS7-CL2A-SN-38抗体偶联药物,已被证明在多种肿瘤细胞系(Calu-3、Capan-1、BxPC-3和COLO-205)的异种移植模型中具有显著的特异性抗癌作用。
类病毒颗粒(VLPs)是一种高度免疫原性和多用途的免疫刺激剂,通过修饰将外源性蛋白结合到它们的细胞膜上,可用作癌症疫苗。比如,嵌合TROP2病毒样颗粒可作为一种针对胰腺癌的潜在免疫治疗方法[22]。
8. 最新研究进展
Jinrong Liu[23]等人在杂志Biochemical and Biophysical Research Communications上发表的一篇TROP2相关文章。他们基于先前构建的TROP2-Fab抗体,通过真核表达系统构建TROP2-IgG抗体。并通过体外和体内实验证明这种新的人单克隆TROP2-IgG抗体对肿瘤具有抑制作用。
Lianhua Z等人[24]于2018年在International Journal of Oncology杂志上发表的文章,作者通过一系列体外实验证明,姜黄素通过抑制膀胱癌细胞中的TROP2抑制细胞增殖和运动。
HOU等人[25]在2019年在Oncology Reports上发表的文章表明,通过激活JAK2/STAT3通路,可促进胶质母细胞瘤细胞的生长和转移。这为进一步了解TROP2在胶质母细胞瘤中的作用提供了依据,表明TROP2是胶质母细胞瘤患者有希望的生物标志物和治疗靶点。
为鼎力协助科研和药企人员针对TROP2在肿瘤等疾病中的临床应用研究,CUSABIO推出TROP2活性蛋白(Code: CSB-MP023072HU1)产品,助力您在TROP2机制方面的研究或其潜在临床价值的探索。(点击查看TROP2系列产品:TROP2蛋白; TROP2抗体)
TROP2蛋白
The purity was greater than 90% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.

Measured in cell activity assay using U937 cells. The EC50 for this effect is 190.2-298.6 ng/ml.
参考文献:
[1] Li X, Teng S, Zhang Y, et al. TROP2 promotes proliferation, migration and metastasis of gallbladder cancer cells by regulating PI3K/AKT pathway and inducing EMT [J]. Oncotarget, 2017, 8(29).
[2] Fornaro M, Arciprete R D, Stella M, et al. Cloning of the gene encoding TROP-2, a cell-surface glycoprotein expressed by human carcinomas[J]. International Journal of Cancer, 1995, 62(5): 610-618.
[3] Calabrese G, Crescenzi C, Morizio E, et al. Assignment of TACSTD1 (alias TROP1, M4S1) to human chromosome 2p21 and refinement of mapping of TACSTD2 (alias TROP2, M1S1) to human chromosome 1p32 by in situ hybridization [J]. Cytogenet Cell Genet, 2001, 92: 164-5.
[4] Cubas R, Li M, Chen C, et al. Trop2: A possible therapeutic target for late stage epithelial carcinomas [J]. Biochim Biophys Acta, 2009, 1796(2): 309-314.
[5] Tsukahara Y, Tanaka M, Miyajima A. TROP2 Expressed in the Trunk of the Ureteric Duct Regulates Branching Morphogenesis during Kidney Development [J]. PLOS ONE, 2011, 6.
[6] Stepan L P, Trueblood E S, Hale K, et al. Expression of Trop2 Cell Surface Glycoprotein in Normal and Tumor Tissues: Potential Implications as a Cancer Therapeutic Target [J]. Journal of Histochemistry & Cytochemistry, 2011, 59(7): 701-710.
[7] Wang J, Day R, Dong Y, et al. Identification of Trop-2 as an oncogene and an attractive therapeutic target in colon cancers [J]. Molecular Cancer Therapeutics, 2008, 7(2): 280-285.
[8] Stoyanova T, Goldstein A S, Cai H, et al. Regulated proteolysis of Trop2 drives epithelial hyperplasia and stem cell self-renewal via β-catenin signaling [J]. Genes & Development, 2012, 26(20): 2271-2285.
[9] Trerotola M, Cantanelli P, Guerra E, et al. Upregulation of Trop-2 quantitatively stimulates human cancer growth [J]. Oncogene, 2012, 32(2).
[10] Guerra E, Trerotola M, Aloisi A L, et al. The Trop-2 signalling network in cancer growth [J]. Oncogene, 2012: 11014.
[11] Liu T, Liu Y, Bao X, et al. Overexpression of TROP2 Predicts Poor Prognosis of Patients with Cervical Cancer and Promotes the Proliferation and Invasion of Cervical Cancer Cells by Regulating ERK Signaling Pathway [J]. PLOS ONE, 2013, 8.
[12] Cubas R, Zhang S, Li M, et al. Trop2 expression contributes to tumor pathogenesis by activating the ERK MAPK pathway [J]. Molecular Cancer, 2010, 9(1): 253.
[13] Trerotola M, Li J, Alberti S, et al. Trop-2 inhibits prostate cancer cell adhesion to fibronectin through the β1 integrin-RACK1 axis [J]. Journal of Cellular Physiology, 2012, 227(11): 0-0.
[14] Bignotti E, Zanotti L, Calza S, et al. Trop-2 protein overexpression is an independent marker for predicting disease recurrence in endometrioid endometrial carcinoma [J]. BMC Clinical Pathology, 2012, 12(1): 22.
[15] Calvo A, Xiao N, Kang J, et al. Alterations in gene expression profiles during prostate cancer progression: functional correlations to tumorigenicity and down-regulation of selenoprotein-P in mouse and human tumors [J]. Cancer Research, 2002, 62(18): 5325-5335.
[16] Ohmachi T. Clinical Significance of TROP2 Expression in Colorectal Cancer [J]. Clinical Cancer Research, 2006, 12(10): 3057-3063.
[17] Farivar T N, Najafipour R, Johari P. Nano - drug delivery of apoptosis activator 2 to AGS cells by liposomes conjugated with anti-TROP2 antibody [J]. North American Journal of Medical Sciences, 2012, 4(11): 582.
[18] Wu H, Xu H, Zhang S, et al. Potential therapeutic target and independent prognostic marker of TROP2 in laryngeal squamous cell carcinoma [J]. Head & Neck, 2012, 35(10): 1373-1378.
[19] Bignotti E, Ravaggi A, Romani C, et al. Trop-2 Overexpression in Poorly Differentiated Endometrial Endometrioid Carcinoma Implications for Immunotherapy With hRS7, a Humanized Anti-Trop-2 Monoclonal Antibody [J]. International Journal of Gynecological Cancer, 2011, 21(9): 1613-21.
[20] Santin A, Bellone S, Varughese J, et al. Uterine serous papillary carcinomas overexpress human trophoblast cell surface marker (Trop-2) and are highly sensitive to immunotherapy with hRS7, a humanized anti-Trop-2 monoclonal antibody [J]. Cancer, 2011, 120(supp-S1): 0-0.
[21] Cardillo T M, Govindan S V, Sharkey R M, et al. Sacituzumab Govitecan (IMMU-132), an Anti-Trop-2/SN-38 Antibody–Drug Conjugate: Characterization and Efficacy in Pancreatic, Gastric, and Other Cancers [J]. Bioconjugate Chemistry, 2015, 26(5): 919-931.
[22] Cubas R, Zhang S, Li M, et al. Chimeric Trop2 virus-like particles: a potential immunotherapeutic approach against pancreatic cancer [J]. Journal of Immunotherapy, 2011, 34(3): 251-263.
[23] Liu Jinrong, Yang Dazhen, Yin Zhengna, et al. A novel human monoclonal Trop2-IgG antibody inhibits ovarian cancer growth in vitro and in vivo [J]. Biochemical and Biophysical Research Communications, 2019, 512: 276-282.
[24] Lianhua Z, Guoliang Y, Ruiyun Z, et al. Curcumin inhibits cell proliferation and motility via suppression of TROP2 in bladder cancer cells [J]. International Journal of Oncology, 2018.
[25] Hou Jianbing, Lv Ailing, Deng Qing, et al. TROP2 promotes the proliferation and metastasis of glioblastoma cells by activating the JAK2/STAT3 signaling pathway [J]. Oncology Reports, 2019, 41: 753-764.
下一篇: 资源|基础研究常用数据库汇总











