组蛋白修饰抗体
表观遗传学是研究基因表达中可遗传的表型变化,包括修饰DNA,RNA和蛋白质,但不涉及核苷酸序列的改变。翻译后修饰(PTM)是研究蛋白质表观遗传学的最重要方法。PTM是标记,为细胞提供广泛的调节机制,以指示哪些基因可以关闭和打开。许多类型和家族的蛋白质都受到PTM的影响,但得到最多修饰的蛋白质之一是组蛋白家族。
组蛋白将基因组DNA包装到核小体中,这使得可将大约2米的DNA放入细胞的细胞核。核小体含有两个亚基,每个亚基由组蛋白H2A,H2B,H3和H4组成。此外,还有组蛋白H1,通常被称为连接组蛋白。在组蛋白上发现的最普遍的PTM包括甲基化,乙酰化,磷酸化和泛素化,这些修饰在基因表达中至关重要,可用作打开和压缩染色质的信号,以及促进和拮抗转录的募集因子。
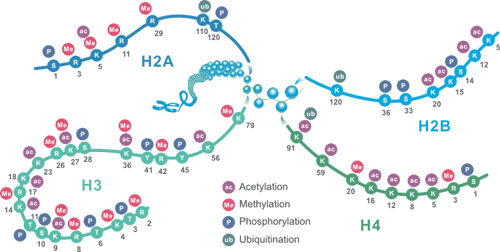
这些组蛋白修饰可通过调节基因表达影响染色体功能。j9九游会登录入口首页生物可提供高特异性组蛋白修饰抗体。可用于ChIP、WB、IHC、IP等多种实验类型。
产品优势
- 高特异性
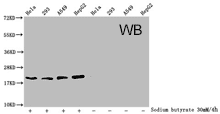
Western Blot analysis of Acetyl-HIST1H1C (K84) antibody (CSB-PA010378OA84acHU)

Western Blot analysis of 2-hydroxyisobutyryl-HIST1H1C (K109) Antibody (CSB-PA010378OA109hibHU)

Western Blot analysis of β-hydroxybutyryl-HIST1H3A (K18) Antibody (CSB-PA010418OA18bhbHU)
- 可用于ChIP实验
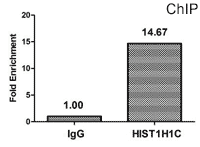
Chromatin Immunoprecipitation (ChIP) analysis of Acetyl-HIST1H1C (K84) antibody (CSB-PA010378OA84acHU)
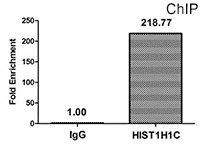
Chromatin Immunoprecipitation (ChIP) analysis of 2-hydroxyisobutyryl-HIST1H1C (K109) Antibody (CSB-PA010378OA109hibHU)
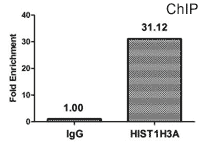
Chromatin Immunoprecipitation (ChIP) analysis of β-hydroxybutyryl-HIST1H3A (K18) Antibody (CSB-PA010418OA18bhbHU)
产品列表
部分热销组蛋白修饰抗体列表(见附表一)
关于组蛋白修饰
组蛋白甲基化是通过添加甲基来修饰组蛋白中的某些氨基酸,继而抑制或激活转录。组蛋白甲基转移酶(HMT)通过染色质依赖性转录抑制或激活来控制或调节DNA甲基化。组蛋白的甲基化和去甲基化在DNA中打开和关闭基因。
组蛋白磷酸化是指激酶使组蛋白上的特异性丝氨酸、苏氨酸或酪氨酸磷酸化,并且可通过磷酸酶进行去磷酸化。磷酸化通常发生在DNA修复和有丝分裂期间,另外在细胞分裂和细胞凋亡过程的DNA修复、转录和染色质整合中起重要的作用。
组蛋白乙酰化主要发生在H3、H4的N端相对保守的赖氨酸位置上,是由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行。该过程与许多细胞过程的调控密切相关,包括染色质动力学和转录,基因沉默,细胞周期进程,细胞凋亡、分化、DNA复制、DNA修复、核输入和神经元抑制。
组蛋白琥珀酰化是一种翻译后修饰,将琥珀酰基(-CO-CH2 -CH2 -COOH)加到组蛋白的赖氨酸残基上。琥珀酰化的潜在作用正在研究中,但随着琥珀酰基的加入,赖氨酸的电荷从+1变为-1(在生理pH下)并引入一个100Da结构,明显大于乙酰化(42Da)或甲基化(14 Da),研究人员推测这将会使蛋白质结构和功能发生更显着的变化。
组蛋白2-羟基异丁酰化是一种新型的组蛋白标记,并已在63个人和小鼠组蛋白的Khib位点得到鉴定,包括27个独特的赖氨酸位点。该组蛋白标记最初由MS鉴定,然后通过化学和生物化学方法验证。
组蛋白生物素化是一个相对较新的研究领域,组蛋白生物素化的生物学作用证据很少。最新研究表明,组蛋白生物素化可以增强人淋巴细胞中细胞增殖的反应。此外,组蛋白生物素化也可能在细胞对DNA损伤的反应中起重要作用。
组蛋白甲酰化也是翻译后修饰之一,可以调节染色质构象和基因激活。目前已经在组蛋白中赖氨酸残基的Nε上得到鉴定。另外也在接头组蛋白和高迁移率族蛋白中观察到这种修饰。
组蛋白巴豆酰化是一种新确定的组蛋白修饰,与哺乳动物细胞中的活跃转录有关。赵英明教授实验室于2011年发现一种新的赖氨酸残基组蛋白修饰物,该修饰与基因表达相关,并且标记了启动子和增强子,类似于乙酰化,后命名为巴豆酰化。
组蛋白羟基化是将CH基团转化为COH基团的许多翻译后修饰之一。羟基化是一种氧化过程。一些研究表明,组蛋白5-羟基化可能在基因转录或染色体重排的表观遗传调控中起重要作用。
组蛋白丙二酰化是一种新型的组蛋白PTM。相关研究表明,与赖氨酸乙酰化相比,赖氨酸丙二酰化将带正电的残基变为负电荷,这将会引起更显着的结构变化。
组蛋白戊二酸化通常发生在赖氨酸上。Kristin A. Anderson等人已经鉴定并全面验证赖氨酸戊二酸化在进化过程中属于保守的PTM,主要影响代谢过程和其他线粒体功能。
组蛋白β-羟基丁基化是一种新型的组蛋白修饰,通常也发生在赖氨酸上。谢中宇团队的研究表明,小鼠肝脏长时间禁食会显着诱导β-羟基丁基化,与饥饿反应代谢途径中表达上调的基因相关。











