EphA3--细胞粘附和迁移的调节器
日期:2019-09-16 16:18:52
受体酪氨酸激酶(RTKs)是一类I型跨膜糖蛋白,它具有调节细胞生长、分化和迁移的功能。Eph受体家族(erythropoietin- producing human hepatocellular carcinoma)是目前为止最大的RTKs家族,该蛋白在结构上高度保守,成员众多[1]。EphA3(以前称为HEK)是Eph受体家族的一员,它的异常改变与多种肿瘤的发生、发展密切相关[2][3],可能会造成细胞形态特征和生物学特性的变化,如细胞的生长和存活率、细胞黏附、细胞迁移及抗凋亡能力的改变。
1. Eph受体的发现
1987年,Hirai等克隆得到了Eph基因家族的第一个成员EphA1[4],目前为止,在人类中,Eph基因家族已发现有14个成员[5],在正常组织及肿瘤细胞中均有广泛地分布。EphA3受体最初是从前B淋巴白血病细胞表面(ALL)细胞系(LK63)中分离得到的表面抗原[6]。
2. Eph受体
根据Eph受体家族的同源性、表达、分布及与配体的结合特性的不同而将其分成A和B两个亚类:即EphA (EphA1、EphA2、EphA3、EphA4、EphA5、EphA6、EphA7、EphA8、EphA10)、EphB (EphB1、EphB2、EphB3、EphB4、EphB6)受体。
2.1 Eph受体结构
EphA3基因位于3号染色体3p11.2区域,该区域在多种不同的肿瘤组织中都存在着突变。
Eph受体包括三个结构域:胞外配体结合区、细胞内具酪氨酸激酶活性的功能区和连接这两个区域的由疏水氨基酸组成的跨膜区。
细胞外结构域包括1个N端球状结构域(Glb),一个由Sushi结构域和EGF样结构域一起构成富含半胱氨酸的连接区和两个纤粘连蛋白Ⅲ型重复区。其中,球状结构域是与配体结合的关键结构域,决定了受体与配体的结合特性,该结构域的突变可破坏抗EphA3单克隆抗体结合受体的能力。
胞内区包括具酪氨酸激酶活性的结构域、SAM结构域(Sterile α-motif domain)和PDZ结构域[7]。其中具有酪氨酸激酶活性的结构域包含近膜区域(两个参与Eph激酶活化的酪氨酸残基位于该区域上)和与之紧邻的激酶区域。激酶结构域的激活环内有激酶活化所需的第三个酪氨酸残基。
SAM结构域在Eph蛋白家族中高度保守,SAM结构中的酪氨酸残基是使受体信号分子聚集的必需位点[8]。SAM结构域去除降低了EphA3突变体形成二聚体的能力,其磷酸化水平和激酶活性均受到影响[9]。
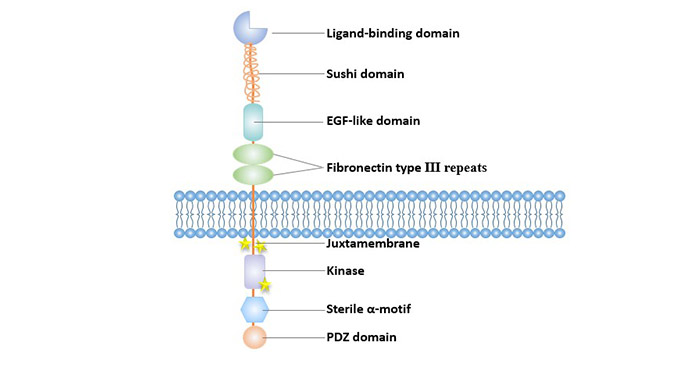
图1. Eph受体的结构
3. EphA3配体
EphA3的配体是:Ephrin-B2和Ephrin-A5。Ephrin配体依据与细胞膜附着方式的不同分为Ephrin-A和Ephrin-B两个亚型。通过糖基磷脂酰肌醇链锚定在细胞膜上的称为Ephrin-A亚型,共5种,Ephrin-B类配体共3种,属于单次跨膜蛋白,由细胞内结构、跨膜部分和细胞外结构组成。
Eph家族配体只有膜附着形式具有活性,可溶形式不仅无活性实际还起拮抗剂作用。
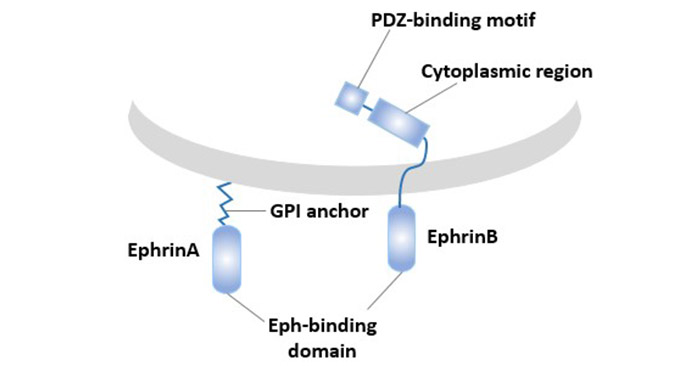
图2. Eph家族配体的类型和结构
4. EphA3表达
EphA3在大脑和脊髓,肺,肾,心脏和肌肉组织的胚胎发育的各个阶段高度表达[10]。在正常成人组织中EphA3几乎不存在,并且在中枢神经系统(CNS)中稀疏表达[11],在视网膜中表达相对较高,在膀胱,前列腺,子宫和心脏中的表达较少[12]。
EphA3在胃癌、肺癌、肾癌、结肠癌、黑色素瘤、肉瘤、胆管癌[13]、前列腺癌[14]等实体肿瘤中异常表达,并且与肿瘤的侵袭转移相关[15]。此外,EphA3在一些造血系统肿瘤和淋巴细胞肿瘤中存在着过度表达[16]。
5. EphA3功能
Eph-ephrin介导的细胞通讯控制着细胞的生物学功能,如细胞的附着和脱离、细胞的形状和运动。
EphA3受体活性控制细胞-细胞粘附和收缩反应。细胞-细胞黏附/脱黏附的调节主要通过蛋白水解酶进行调控。蛋白水解破坏EphA3依赖的细胞-细胞相互作用。其中,跨膜金属蛋白酶ADAM10是细胞与细胞接触时调控信号传递的主要蛋白酶之一,它对EphA/ephrin-A细胞间相互作用的破坏至关重要。ADAM10富含半胱氨酸的结构域中有一个底物结合口袋,该口袋专门识别EphA3/ephrin-A5复合物,定位蛋白酶结构域,将ephrin从相邻细胞膜上分离。
酪氨酸激酶Eph受体及配体在正常细胞黏附、迁移、血管生成中发挥重要的作用,研究表明Eph受体或ephrin蛋白在维持血管、肾脏及肠道等组织的结构上发挥着一定的作用[17]。此外,它们还和许多肿瘤血管的形成密切相关,并被认为参与肿瘤的侵袭和转移。
5.1 EphA3在发育中的作用
Eph-ephrin通过调节细胞-细胞粘附和去粘附来控制正常和致癌发育过程中的细胞定位,从而影响细胞发育。Eph/ephrin信号在多个发育过程中被使用,从原肠胚形成和体细胞生成,到血管和神经系统的模式。
Ephs对胚胎学过程至关重要,尤其是神经系统的发育。例如EphA3在视网膜顶盖发育(retinotectal development)[18]中发挥着重要的作用,这与EphA3在人类视网膜中的高表达保持一致。
5.2 EphA3与癌症
EphA3在多种肿瘤中表达,它与肿瘤干细胞和血管生成有关。
5.2.1 EphA3与实体瘤
EphA3在癌症中广泛突变,在实体肿瘤[19]中发现多达40个突变。许多突变影响Ephrin结合域、sushi-like和EGF-like结构域(都参与配体结合)或激酶结构域,这些结构域的突变可能会导致正向信号转导的异常。
在黑素瘤发现高EphA3水平。黑色素瘤细胞上的EphA3激活诱导Rho依赖性细胞骨架再组织和细胞回缩,这可能促进肿瘤转移。
Eph过表达还广泛存在于间质肿瘤中,包括肉瘤。
骨肉瘤和胃肠道间质瘤以及GBM和其他神经肿瘤中EphA3的表达升高。在一种胶质母细胞瘤(GBM)的间叶细胞亚型中也发现了EphA3的高表达,在这种间叶细胞亚型中,EphA3的表达与干细胞的维持密切相关。
EphA3在上皮性肿瘤也存在过表达,包括肺和肾的肿瘤。EphA3在乳腺癌、肺癌、结直肠癌和胃癌的亚群中均有高表达。研究发现,EphA3在肺癌中的突变率达到了5%-10%,在多组肺癌组织中该基因缺失[20]。过量表达EphA3可以增加小细胞肺癌中肿瘤细胞凋亡率和G0/G1期细胞周期阻滞,从而降低对化疗药物的抵抗[21]。EphA3在肝癌中的表达分布及其作用方面的研究更是只有少数几例[22]。研究表明,EphA3在肝癌中的表达高低与肝癌的肿瘤大小、肿瘤转移、分级及存活率密切相关。EphA3在胃癌组织内高表达也已被证实,高水平的EphA3表达与胃癌的血管生成和预后不良有关。
然而,与其他Ephs一样,关于EphA3在癌症进展中的作用和表达并不总是一致的。
5.2.2 EphA3与血液恶性肿瘤
EphA3在血液恶性肿瘤中也存在异常表达。与表达EphA3的实体肿瘤相比,EphA3在血液病恶性肿瘤中的结构正常。
研究表明EphA3在骨髓增生性肿瘤中的表达升高,而健康对照组的骨髓和外周血细胞中没有EphA3。在不同时期,其表达水平存在差异,慢性髓系白血病(CML)患者在慢性期EphA3表达较低,在加速期或变胚期表达明显升高。
此外,Eph RTKs还参与了许多与恶性肿瘤相关的其他过程,包括肿瘤微环境的改变,这可能促进恶性肿瘤的发生和血管生成。
6. Eph/Ephrin信号传导
Eph/Ephrin信号传导通道的概述如下:配体与Eph受体的胞外区域结合后使受体构象发生变化,引起受体在胞膜上迁移、聚集,并形成寡聚化的受体配体复合物,激活胞浆的酪氨酸激酶而活化,导致自身磷酸化及下游大量胞内底物蛋白质分子的酪氨酸磷酸化,启动不同信号途径将信号逐级传递。
Eph-ephrin相互作用的一个显著特征是双向信号传导的现象,即Eph/Ephrin信号传导通道的特点是不仅作用于表达Eph细胞(正向信号),而且作用于表达Ephrin细胞(逆向信号),且正反向信号均可通过酪氨酸磷酸化依赖或非依赖传导途径进行传导。
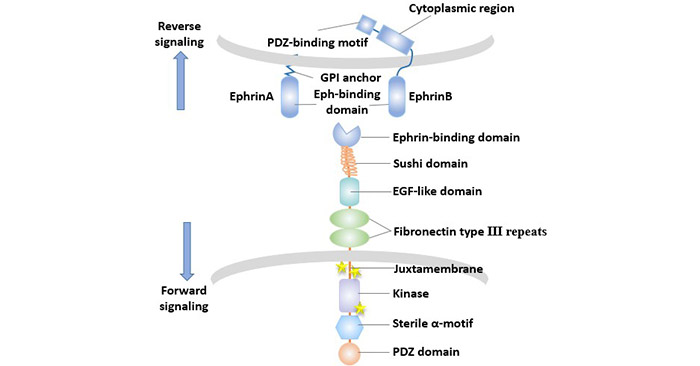
图3. Eph/Ephrin信号的双向传导
形成信号簇(最小四聚体)而不是受体二聚,是Eph-ephrin信号传导的关键要求。ephrin配体的聚类(Clustering)对于Eph信号传递是必要的,膜结合或成簇的ephrin刺激Eph活性,而可溶性的ephrins抑制Eph活性。例如,单体ephrin-A5可拮抗EphA3的活化[23]。
Ephrin结合导致三个主要酪氨酸的磷酸化-近膜区域中的Y596和Y602以及激酶活化环中的Y779,随后激酶结构域激活。CrkII适配蛋白被招募到活化的激酶域,对随后的信号级联至关重要,从而导致RhoA GTPases的活化。
Eph RTKs通过调节Rho或Ras家族GTP酶的活化状态来靶向细胞骨架以改变细胞粘附/排斥和细胞运动性质[24]。
Rho家族GTPases作为Eph受体的下游信号分子,它的激活使Rho家族内的平衡转移到优先激活RhoA,抑制Rac1和Cdc42。Rac1/cdc42促进细胞运动,促进迁移细胞中板足和丝状足的形成,而RhoA抑制细胞运动。这使得细胞的运动特性改变。
Eph除了可介导细胞骨架结构的变化,还可以基于Eph RTK磷酸化状态促进或抑制存活途径。
7. EphA3靶向治疗
Eph受体酪氨酸激酶在正常和致癌发育过程中控制细胞-细胞相互作用,并涉及一系列过程,包括血管生成,干细胞维持和转移。Eph基因在肿瘤进展的各种机制中发挥作用,因此,它们可作为癌症治疗的靶点。
鉴于EphA3和其他Ephs在肿瘤中所起的作用,包括激酶抑制剂的使用在内的Eph抑制剂的开发已经投入了大量的努力。
针对EphA3,Vearing等[25]尝试利用可溶性EphA3的高黏附性配体EphrinA5来封闭EphA3,从而达到抑制其促进肿瘤生长的功能。
对于EphA3,最主要的治疗候选药物是单克隆抗体IIIA4。IIIA4,是靶向EphA3的IgG1κ单克隆抗体[6]。IIIA4的靶点位于与配体结合位点相邻的EphA3胞外结构域N端,对EphA3具有较高的亲和力。与配体相似,预聚类的IIIA4能有效地触发EphA3活化,细胞骨架收缩和细胞变圆,而非聚集的IIIA4也在体外加强配体激活。
利用抗体人工工程技术对IIIA4进行了改造,制备出KB004,目前已进入临床开发阶段。KB004可能会改变微环境,使其不利于肿瘤生长和增殖。KB004对EphA3保持高亲和力,具有强大的抗体依赖性细胞毒性(ADCC)。KB004目前正在血液病恶性肿瘤患者的I/II期临床试验中进行评估(ClinicalTrials.gov标识符:NCT01211691)。
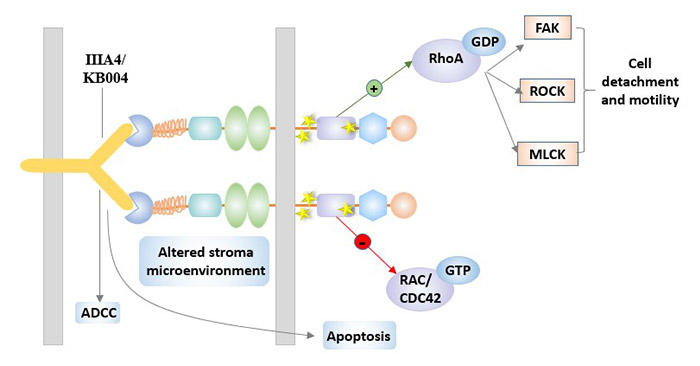
图4. IIIA4 / KB004在EphA3靶向治疗中的作用
为鼎力协助科研和药企人员针对EphA3的在肿瘤中的临床应用研究,CUSABIO推出EphA3活性蛋白(Code:CSB-MP007723HU),助力您在EphA3机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页 CUSABIO EphA3 蛋白
Recombinant Human Ephrin type-A receptor 3 (EPHA3), partial (Active) Code: CSB-MP007723HU
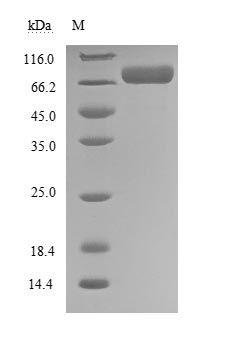
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
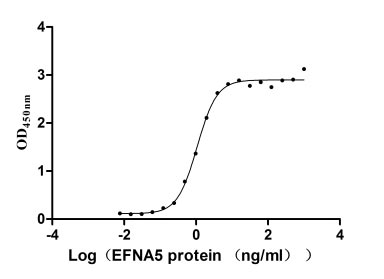
Immobilized EPHA3 at 2 μg/ml can bind human EFNA5(CSB-MP007464HU). The EC50 of the protein is 0.9734-1.179 ng/ml.

Human EPHA3 protein his tag (CSB-MP007723HU) captured on COOH chip can bind Human EFNA5 protein Fc tag (CSB-MP007464HU) with an affinity constant of 13.8 nM
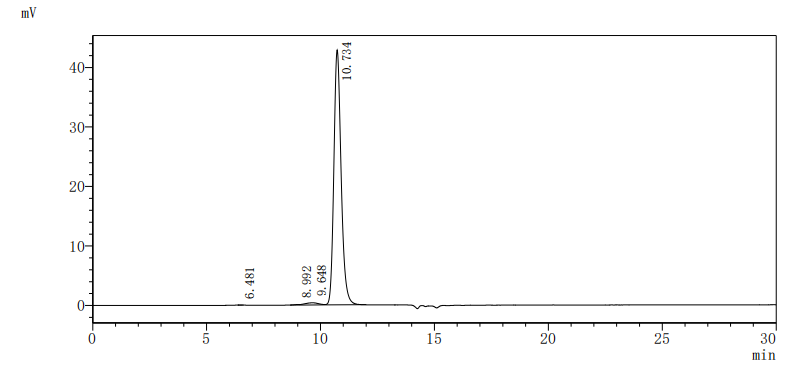
The purity of Human EPHA3 was greater than 95% as determined by SEC-HPLC.
参考文献:
[1] Birgit M, Bettina R, Christin N, et al. Eph Receptors and Ephrin Ligands: Important Players in Angiogenesis and Tumor Angiogenesis [J]. Journal of Oncology, 2010, 2010: 1-12.
[2] Mélanie H, Schaffner F, Augustin H G. Eph receptor and ephrin ligand-mediated interactions during angiogenesis and tumor progression [J]. Experimental Cell Research, 2006, 312(5): 642-650.
[3] Xi H Q, Wu X S, Wei B, et al. Aberrant expression of EphA3 in gastric carcinoma: correlation with tumor angiogenesis and survival [J]. Journal of Gastroenterology, 2012, 47(7): 785-794.
[4] Hirai H, Maru Y, Hagiwara K, et al. A novel putative tyrosine kinase receptor encoded by the eph gene [J]. Science, 1987, 238(4834): 1717-1720.
[5] Committee E N. Unified nomenclature for Eph family receptors and their ligands, the ephrins. Eph Nomenclature Committee [J]. Cell, 1997, 90(3): 403.
[6] Boyd A W, Ward L D, Wicks I P, et al. Isolation and characterization of a novel receptor-type protein tyrosine kinase (hek) from a human pre-B cell line [J]. Journal of Biological Chemistry, 1992, 267(5): 3262-3267.
[7] Pasquale, Elena B. Developmental Cell Biology: Eph receptor signalling casts a wide net on cell behavior [J]. Nat Rev Mol Cell Biol, 2005, 6(6): 462-475.
[8] Stein E, Lane A A, Cerretti D P, et al. Eph receptors discriminate specific ligand oligomers to determine alternative signaling complexes, attachment, and assembly responses [J]. Genes & Development, 1998, 12(5): 667-78.
[9] Singh D R, Cao Q, King C, et al. Unliganded EphA3 dimerization promoted by the SAM domain [J]. Biochemical Journal, 2015, 471(1): 101-109.
[10] Kilpatrick T J, Brown A, Lai C, et al. Expression of theTyro4/Mek4/Cek4Gene Specifically Marks a Subset of Embryonic Motor Neurons and Their Muscle Targets [J]. Molecular and Cellular Neuroscience, 1996, 7(1): 62-74.
[11] Hafner C, Schmitz G, Meyer S, et al. Differential Gene Expression of Eph Receptors and Ephrins in Benign Human Tissues and Cancers [J]. Clinical Chemistry, 2004, 50(3): 490-499.
[12] Chiari R, Gérald Hames, Stroobant V, et al. Identification of a Tumor-specific Shared Antigen Derived From an Eph Receptor and Presented to CD4 T Cells on HLA Class II Molecules [J]. Cancer Research, 2000, 60(17): 4855-63.
[13] Suksawat M, Techasen A, Namwat N, et al. Upregulation of endothelial nitric oxide synthase (eNOS) and its upstream regulators in Opisthorchis viverrini associated cholangiocarcinoma and its clinical significance [J]. Parasitology International, 2016: S1383576916300976.
[14] Hood G, Laufer-Amorim R, Fonseca-Alves C E, et al. Overexpression of Ephrin A3 Receptor in Canine Prostatic Carcinoma [J]. Journal of Comparative Pathology, 2016: S0021997516000037.
[15] Xi H Q, Zhao P. Clinicopathological significance and prognostic value of EphA3 and CD133 expression in colorectal carcinoma [J]. Journal of Clinical Pathology, 2011, 64(6): 498-503.
[16] Wicks I P, Wilkinson D, Boyd E S W. Molecular Cloning of HEK, the Gene Encoding a Receptor Tyrosine Kinase Expressed by Human Lymphoid Tumor Cell Lines [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(5): 1611-1615.
[17] Ogawa K. EphB2 and ephrin-B1 expressed in the adult kidney regulate the cytoarchitecture of medullary tubule cells through Rho family GTPases [J]. Journal of Cell Science, 2006, 119(3): 559-570.
[18] Feldheim D A. Loss-of-Function Analysis of EphA Receptors in Retinotectal Mapping [J]. Journal of Neuroscience, 2004, 24(10): 2542-2550.
[19] Lisabeth E M, Fernandez C, Pasquale E B. Cancer Somatic Mutations Disrupt Functions of the EphA3 Receptor Tyrosine Kinase through Multiple Mechanisms [J]. Biochemistry, 2012, 51(7): 1464-1475.
[20] Zhuang G, Song W, Amato K, et al. Effects of Cancer-Associated EphA3 Mutations on Lung Cancer [J]. JNCI Journal of the National Cancer Institute, 2012, 104(15): 1183-1198.
[21] Peng J, Wang Q, Liu H, et al. EphA3 regulates the multidrug resistance of small cell lung cancer via the PI3K/BMX/STAT3 signaling pathway [J]. Tumor Biology, 2016, 37(9): 11959-11971.
[22] Tao Kai-Shan. High levels of EphA3 expression are associated with high invasive capacity and poor overall survival in hepatocellular carcinoma [J]. Oncology Reports, 2013, 30(5).
[23] Lawrenson I D, Wimmerkleikamp S H, Lock P, et al. Ephrin-A5 induces rounding, blebbing and de-adhesion of EphA3-expressing 293T and melanoma cells by CrkII and Rho-mediated signaling [J]. Journal of Cell Science, 2002, 115(Pt 5): 1059.
[24] Pasquale E B. Eph-Ephrin Bidirectional Signaling in Physiology and Disease [J]. Cell, 2008, 133(1): 0-52.
[25] Vearing C. Concurrent Binding of Anti-EphA3 Antibody and Ephrin-A5 Amplifies EphA3 Signaling and Downstream Responses: Potential as EphA3-Specific Tumor-Targeting Reagents [J]. Cancer Research, 2005, 65(15): 6745-6754.
下一篇: 卵巢癌--沉默的杀手











