卵巢癌--沉默的杀手
日期:2019-09-24 11:06:39
卵巢是产生卵子的女性生殖器官,卵巢癌是指发生在卵巢的癌变。它是由卵巢中的某些细胞异常地,不可控制的繁殖所引起的肿瘤。卵巢癌是常见的女性生殖系统肿瘤,发病率高,仅次于宫颈癌和子宫体癌,其死亡率居妇科肿瘤死亡率的第一位[1]。
图1 卵巢癌 [1]
1. 卵巢癌的组织学分类
根据细胞组成的差异,卵巢癌主要分为三种:上皮性肿瘤、间质瘤、生殖细胞肿瘤。
1.1 上皮性肿瘤
上皮性肿瘤来源于卵巢的生发上皮,它是卵巢癌的主要的形式,大约90%的卵巢癌是上皮性肿瘤。这些肿瘤既可能是良性的,也有可能是恶性的。
1.2 间质瘤
这种卵巢癌来源于卵巢的特异性性索间质,因此也被称为性索间质瘤。大约7%的卵巢癌是间质性的。它包括颗粒细胞瘤、卵泡膜细胞瘤、纤维瘤、卵巢睾九母细胞瘤、两性母细胞瘤等。一般情况下,卵泡膜细胞瘤和纤维瘤为良性肿瘤,其它为低度恶性肿瘤。
1.3 生殖细胞肿瘤
生殖细胞肿瘤来源于卵巢的生殖细胞。通常发生在年轻人身上。
此外还有转移性肿瘤,它是指来源于原发在其它器官的恶性肿瘤,常见的包括消化道和妇科其它器官。卵巢癌中,90%~95%为卵巢原发性的癌,只有5%~10%的为其它部位原发的癌转移到卵巢。
2. 卵巢癌的症状
卵巢癌早期阶段几乎没有症状,即使有症状也不特异,因此早期诊断比较困难,就诊时60%~70%已为晚期。这严重影响卵巢癌患者的生存。也因此卵巢癌又被称为“沉默的杀手”。
卵巢癌早期阶段的症状往往是模糊的,很容易被认为是其他原因造成的。所以如果出现了这些症状,你应该警惕是否和卵巢癌有关。
卵巢癌的早期症状包括腹胀,腹部和/或盆腔疼痛,疲劳和呼吸急促[2],下半身的疼痛,下腹疼痛,背部疼痛,消化不良或胃灼热,吃东西时迅速感到饱,尿频和尿急,性交痛,改变排便习惯,如便秘。随着卵巢癌的进展,也会出现恶心、体重减轻和食欲不振等症状。若这些症状频繁出现,则需要尽早就诊。
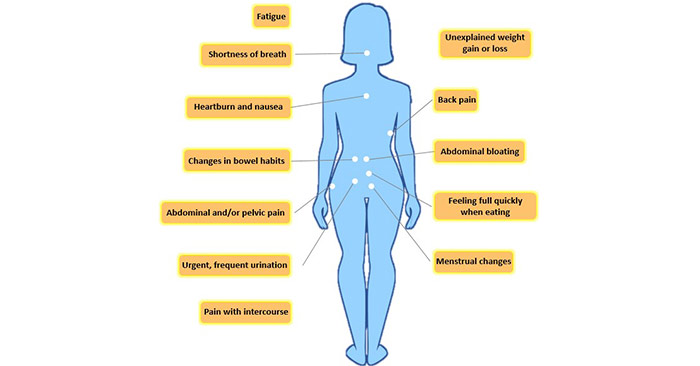
图2 卵巢癌的症状 [2]
3. 卵巢癌的危险因素
目前还不清楚卵巢癌的病因。然而,遗传因素、生育因素、环境因素和生活方式等因素都可能在其中发挥作用。
3.1 遗传因素
在卵巢癌研究中,BRCA1和BRCA2突变是卵巢癌最重要的已知遗传风险因素,高达17%的患者存在这两种突变[3]。普通妇女患卵巢癌的风险仅为l%左右,而BRCA1和BRCA2胚系突变携带者发生卵巢癌的风险分别达54%和23%,是卵巢癌的高危人群。除了BRCA1和BRCA2,很多基因都会增加患卵巢癌的风险。如RAD51C,RAD51D,BRIP1,BARD1和PALB2 [4] [5]。此外,CHEK2,MRE11A,RAD50,ATM和TP53,也可能增加患卵巢癌的风险。
3.2 家族病史
与其他女性相比,有卵巢癌、乳腺癌、子宫内膜癌、结直肠癌家族史者,卵巢癌的发病率明显升高。针对这些人群,可以通过基因筛查确定某人是否携带与风险增加相关的基因。
3.3 乳腺癌
被诊断患有乳腺癌的女性患卵巢癌的风险更高。
3.4 生殖因素
未产也是卵巢癌的危险因素。在26岁之前生孩子会降低患卵巢癌的风险,母乳喂养也是如此。与未生育的妇女相比,生育过的妇女患所有亚型卵巢癌的风险都有所降低,其中以透明细胞癌的风险降低最为显著。
而多次妊娠哺乳和口服避孕药可能会降低患卵巢癌的风险。口服避孕药5~9年的妇女中,患病风险降低了约35%。口服避孕药已被证明可以降低生殖系BRCA1突变个体和那些没有遗传倾向的人患卵巢癌的风险[6]。
3.4.1 生育治疗
有不孕病史的人患卵巢癌的风险更高,不孕治疗也可能提高卵巢癌的患病风险。
3.4.2 持续排卵
持续排卵使卵巢表面上皮不断损伤与修复,可能导致卵巢癌的发生。女性一生中排卵的总次数与患卵巢癌的风险之间存在关联。应用促排卵药物可增加发生卵巢肿瘤的危险性。
3.5 手术
一些研究表明输卵管结扎手术可以显著降低高达70%的卵巢癌风险。
3.6 激素替代疗法
激素替代疗法会增加绝经后妇女患卵巢癌的风险[7]。HRT持续的时间越长,风险就越大,一旦停止治疗,风险就会恢复正常。
3.7 子宫内膜异位
子宫内膜异位症是一种与子宫内膜组织相似的组织生长在子宫外的疾病,患有子宫内膜异位症的女性患卵巢癌的风险比其他女性高30%。
3.8 年龄
虽然卵巢癌在女性生命的任何阶段都有可能发生,但是大多数卵巢癌发生在65岁以上的女性身上,在大约90%的病例中,卵巢癌发生在40岁以后,而大多数病例发生在60岁以后。
3.9 肥胖
肥胖或超重的人患癌症的风险更高。研究表明肥胖也是绝经后卵巢癌发生的一个可能的危险因素[8]。
3.10 环境及其他因素
流行病学数据表明,工业的各种物理或化学产物可能与卵巢癌的发病相关。此外,有研究针对饮食因素与普通人群患卵巢癌风险之间的关系进行了调查,卵巢癌的发病是否与饮食习惯或成分(胆固醇含量高)相关,目前还无定论。其他可能影响卵巢癌风险的生活方式因素包括滑石粉的使用、非甾体抗炎药和吸烟等。
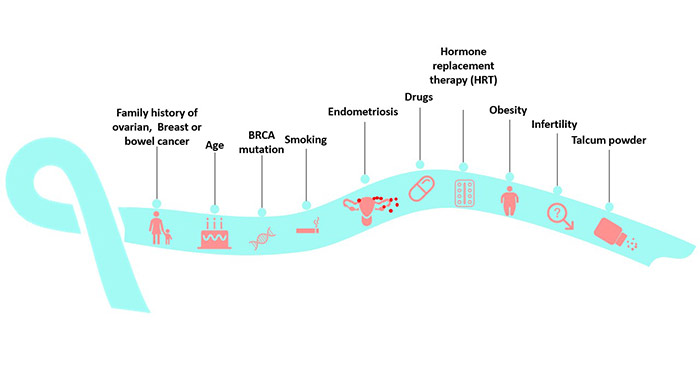
图3 卵巢癌的危险因素 [2]
4. 卵巢癌的诊断
卵巢癌早期典型症状不明显,并且目前还缺乏适当的筛查手段,这导致它具有高致死率的特点,也使得它成为女性生殖系统中第三大恶性肿瘤。寻找早期诊断的有效方法和提高诊断的特异性是诊断研究中的重点所在。
以下测试用于诊断卵巢癌:
血液测试:肿瘤标志物CA125、人附睾蛋白4(HE4)是卵巢上皮癌中应用价值最高的肿瘤标志物。但CA125水平在一些非卵巢癌疾病中,如乳腺癌、肺癌和子宫内膜癌及部分卵巢良性肿瘤中也会出现增高[9]。这表明血清CA125测定用于卵巢癌诊断的敏感度、特异度并不佳,假阳性率较高。因此CA125的单一检测对卵巢癌的诊断,可能存在特异性不足的问题。而应用人附睾分泌蛋白4和CA125联合诊断可以为卵巢癌提供更高的诊断率。HE4是一种在卵巢上皮性癌中表达的糖蛋白,在很多妇科良性疾病中不上升,对卵巢癌的诊断具有特异性。Ferraro等[10]研究发现,人附睾分泌蛋白4比CA125更具有优越性。
除了这两种肿瘤标志物,还有以下几种标志物:
癌胚抗原(carcinoembryonic antigen, CEA);
甲胎蛋白(alpha fetoprotein, AFP);
癌抗原199(carbohydrate antigen 199, CA199)。
许多新的肿瘤标志物还处于研究中,比如血清巨噬细胞集落刺激因子(M-CSF)和溶血磷脂酸(LPA)。LPA在手术病理分期Ⅰ、Ⅲ-Ⅳ期卵巢癌患者血清中的阳性率分别为90%和100%,而相应的血清CA125阳性率仅为22%和60%[11]。
超声波:超声检查是卵巢癌筛查的首选检查方法,可明确卵巢有无占位性病变,判断肿瘤的良恶性。目前广泛运用的是经阴超声、经腹超声及彩色多普勒血流显像。
腹腔镜检查:腹腔镜(一种末端装有摄像机的细观察管)通过下腹部的一个小切口插入病人体内。
结肠镜检查:如果病人有直肠出血或便秘的症状,医生可能会要求结肠镜检查大肠(结肠)。
CT扫描:CT扫描被应用于发现卵巢病变,可以预测疾病的分期,该项检查能清楚地显示肿瘤的位置、大小及与邻近器官、组织的关系,检测有无肿大淋巴结,有无腹腔积液等,还被应用于肿瘤手术定位、定性以及分期。
核磁共振成像:MRI通过其高空间分辨率和组织的对比以及多参数多方位成像,提供了精细盆腔的解剖,在卵巢疾病的检测中起着重要的作用。
基因组学和蛋白质组学检测技术:目前这些技术多处于实验室研究阶段。
此外,医生还会进行阴道检查,确认子宫或卵巢是否有明显异常。病人的病史和家族史的询问也是很有必要的。
对于确认为卵巢癌的患者,医生还需要进一步确定其分期和分级。癌症的分期(stage)是指癌细胞的扩散程度,而分级(grade)则是指癌细胞在显微镜下的样子,确认它们是否是恶性的。
5. 卵巢癌的治疗
卵巢癌的治疗方法包括手术、化疗、手术与化疗的结合,有时还包括放疗。使用哪种治疗方式需根据卵巢癌的类型、分期和分级,以及患者的总体健康状况来决定。细胞减少手术(cytoreductive surgery)和铂基化疗(platinum-based chemotherapy)是治疗卵巢癌的金标准。
5.1 手术
卵巢癌手术包括全子宫切除术,双侧卵巢输卵管切除术,减瘤术,网膜切除术[12]。如果患者想要保住自己的生育功能,可以为患者采取患侧附件切除手术来保证患者其附件具有正常的功能,但是这也为肿瘤的进一步恶化提供了更多的机会和风险。
5.2 化疗
除了手术之外,化疗也是治疗卵巢癌的一个重要的手段。化疗是使用化学物质(药物)来破坏癌细胞。卵巢癌和大多数其他癌症的化疗,都是针对手术无法切除的癌细胞。目前,紫杉醇联合铂类药物仍然是卵巢癌的一线化疗药物。化疗主要包括一线化疗、腹腔化疗、新辅助化疗、巩固化疗、复发化疗等等。
5.3 靶向治疗
靶向治疗是基于肿瘤组织特征有别于正常组织所给予的针对性治疗。与传统化疗相比,靶向治疗的优势在于限制了对正常细胞的损伤,因此减少了副作用。
5.3.1 卵巢癌靶向药物
PARP抑制剂:奥拉帕尼是评价最为广泛的PARP抑制剂。奥拉帕尼作为一种PARP抑制剂,在一期临床试验以及随机试验中与脂质体阿霉素相比较取得了较好的肿瘤抑制作用[13]。大量临床实验数据证实其耐受性良好,可显著延长卵巢癌患者无进展生存期[14]。维利帕尼、尼拉帕尼、Talazoparib等PARP抑制剂可延长卵巢癌患者的无进展生存期[15]。
血管生成抑制剂:肿瘤需要血管来满足生长和转移的需求,血管生成抑制剂能控制肿瘤生长。贝伐单抗,一种单克隆抗VEGF抗体,它主要通过抑制VEGF与其受体VEGFR1、VEGFR2结合,降低VEGF诱导的血管通透性异常,抑制了肿瘤的血管生成,减缓肿瘤生长和转移。
PI3K/AKT/mTOR信号通路抑制剂:PI3K/AKT/mTOR信号通路抑制剂可分为PI3K抑制剂、mTOR抑制剂、mTOR/PI3K抑制剂和AKT抑制剂。
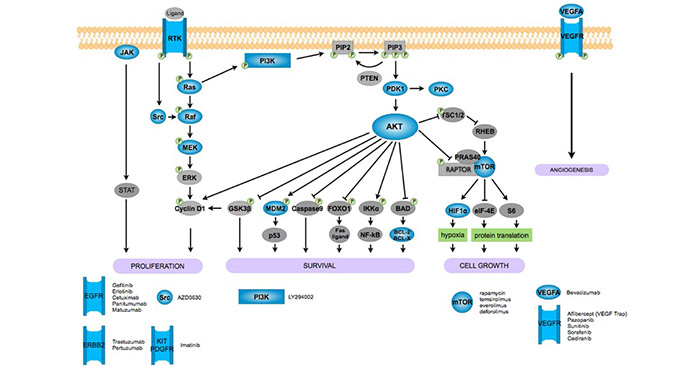
图4 卵巢癌的信号通路和新的治疗靶点[16]
在卵巢癌靶向治疗中,抗体药物偶联物(antibody drug conjugates,ADCs)的使用大大提高了偶联药物的特异性。
3C12‐DOX偶联物在体内外均具有明显的抑制肿瘤的作用,而且安全性优于单用化疗药物(DOX)[17]。该偶联物是以Sp17单克隆抗体3C12为靶向载体,与阿霉素(doxorubicin,DOX)偶联形成的,可特异性结合卵巢癌组织中的Sp17。
EpCAM单克隆抗体MOC31与假单胞菌外毒素A(pseudomonas exotoxin A,PE)偶联形成的免疫毒素MOC31PE能抑制卵巢癌细胞蛋白合成,减弱细胞活力,减少癌细胞转移。
随着对卵巢癌研究的深入,未来将会有更多卵巢癌的药物的问世。
References
[1] Gubbels J A, Claussen N, Kapur A K, et al. The detection, treatment, and biology of epithelial ovarian cancer [J]. Journal of Ovarian Research, 2010, 3(1): 8.
[2] Goff B A, Mandel L, Muntz H G, et al. Ovarian carcinoma diagnosis [J]. Cancer, 2015, 89(10): 2068-2075.
[3] Zhang S, Royer R, Li S, et al. Frequencies of BRCA1 and BRCA2 mutations among 1,342 unselected patients with invasive ovarian cancer [J]. Gynecologic Oncology, 2011, 121(2): 353-357.
[4] Pennington K P, Swisher E M. Hereditary ovarian cancer: Beyond the usual suspects [J]. Gynecologic Oncology, 2012, 124(2): 347-353.
[5] Norquist B M, Harrell M I, Brady M F, et al. Inherited Mutations in Women With Ovarian Carcinoma [J]. Jama Oncol, 2015, 2(4): 482-490.
[6] Moorman P G, Havrilesky L J, Gierisch J M, et al. Oral Contraceptives and Risk of Ovarian Cancer and Breast Cancer Among High-Risk Women: A Systematic Review and Meta-Analysis [J]. Journal of Clinical Oncology, 2013, 31(33): 4188-4198.
[7] Ellen Lokkegaard, Susanne KrugerKjaer. Hormone therapy and ovarian cancer [J]. Lancet, 2015, 386(9998): 298.
[8] Keum N N, Greenwood D C, Lee D H, et al. Adult Weight Gain and Adiposity-Related Cancers: A Dose-Response Meta-Analysis of Prospective Observational Studies [J]. JNCI Journal of the National Cancer Institute, 2015, 107(3).
[9] Moss E L, Hollingworth J, Reynolds T M. The role of CA125 in clinical practice [J]. Journal of Clinical Pathology, 2005, 58(3): 308-312.
[10] Ferraro S, Braga F, Lanzoni M, et al. Serum human epididymis protein 4 vs carbohydrate antigen 125 for ovarian cancer diagnosis: a systematic review [J]. Journal of Clinical Pathology, 2013, 66(4): 273-281.
[11] Jacobs I. Discussion: Ovarian Cancer Screening [J]. Gynecologic Oncology, 2003, 88(1-supp-S): 0-0.
[12] King M C. Breast and Ovarian Cancer Risks Due to Inherited Mutations in BRCA1 and BRCA2 [J]. Science, 2003, 302(5645): 643-646.
[13] Kaye S B, Lubinski J, Matulonis U, et al. Phase II, open-label, randomized, multicenter study comparing the efficacy and safety of olaparib, a poly (ADP-ribose) polymerase inhibitor, and pegylated liposomal doxorubicin in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer [J]. Journal of Clinical Oncology, 2012, 30(4): 372-379.
[14] Ledermann J A, El-Khouly F. PARP inhibitors in ovarian cancer: Clinical evidence for informed treatment decisions [J]. British Journal of Cancer, 2015, 113: S10-S16.
[15] Jones P, Wilcoxen K, Rowley M, et al. Niraparib: A Poly (ADP-ribose) Polymerase (PARP) Inhibitor for the Treatment of Tumors with Defective Homologous Recombination [J]. Journal of Medicinal Chemistry, 2015, 58(8): 3302-3314.
[16] Gianpiero D L, Croce C M. The Role of microRNAs in the Tumorigenesis of Ovarian Cancer [J]. Frontiers in Oncology, 2013, 3.
[17] Song J X, Li F Q, Cao W L, et al. Anti-Sp17 monoclonal antibody-doxorubicin conjugates as molecularly targeted chemotherapy for ovarian carcinoma [J]. Targeted Oncology, 2013, 9(3): 263-272.














