补体激活调节剂CD46
日期:2019-11-29 13:25:20
CD46是由Cole等人在1986年应用C3b亲和层析在外周血淋巴细胞上发现的一种膜蛋白,又称为膜辅蛋白(MCP)[1]。在核苷酸序列上MCP与衰变加速因子(DAF)具有同源性,但蛋白结构与功能不同,从而它被认为是补体系统的一种新的调节蛋白,在第四届国际白细胞分型讨论会上将其命名为CD46。随着对CD46认识的不断深入,人们逐渐意识到是一种具有多种功能的膜蛋白,并与多种免疫性疾病相关。那CD46到底是什么?在免疫系统中又是扮演什么角色?请继续往下看~
1. 什么是CD46?
CD46为一单链跨膜糖蛋白,其染色体定位于人类1号染色体短臂的32号区,分子量为45-70kDa,又命名为gp45-70,属于补体活化调节蛋白因子家族。CD46的N端由四个补体控制蛋白(CCP)组成,后面是通过选择性剪接产生的O-高度糖基化区域,并包含B和/或C异构体。B和C结构域富含氨基酸丝氨酸、苏氨酸和脯氨酸(STP),并通过功能未知的12个氨基酸区域与跨膜结构域相连。CD46的细胞内区域由两种氨基数目不同的短尾(Cyt1包含16个氨基,cyt2含有23个氨基)组成。选择性剪接可产生带有CYT-1的同工型或带有CYT-2的同工型,它们都含有信号传导基序,并且在炎症环境中差异表达。由于能够表达的CD46通常不包含外显子A,所以根据不同的组合方式,CD46分为四种亚型:C1、C2和BC1、BC2。BC亚型较C亚型分子量大[2][3][4]。
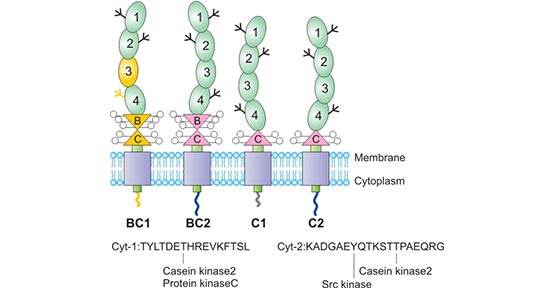
Figure 1. The structure of CD46
CD46在细胞表面分布很广,大多数正常细胞上都有CD46表达,包括造血细胞系、成纤维细胞、表皮细胞、内皮细胞及星状胶质细胞等,但不同类型的细胞上表达的数量有所不同[5]。如C2亚型主要表达于脑、精子,BC亚型则在肾脏、唾液腺、婴儿心脏表达较多。
2. CD46的功能
人CD46也称为膜辅因子蛋白(MCP),属于补体激活调节剂(RCA)蛋白质家族。除了CD46,RCA家族还包括衰变加速因子(CD55 / DAF)、补体受体1(CR1 / CD35)和2(CR2 / CD21)、C4结合蛋白和H因子(FH)。如Figure2所示,CD46作为膜辅因子介导的C3b和C4b裂解辅助因子,是先天免疫系统中经典和选择性补体激活级联反应的关键调节因子[6]。裂解多余的C3b可以产生膜结合的C3bi和可溶性C3f。C4b的裂解可以产生膜结合C4d和可溶性C4c。 而细胞结合的切割片段不能继续激活补体级联反应。这个过程可以保护宿主细胞免受补体系统的意外裂解[7] [8]。
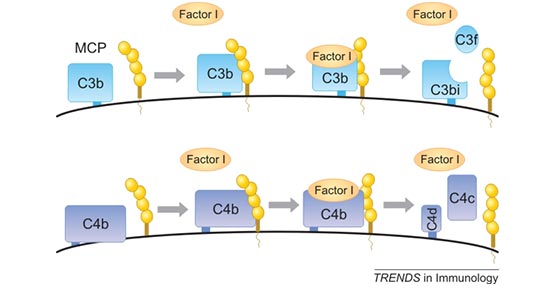
Figure 2. CD46 is a cofactor for the serine protease factor I to cleave C3b and C4b
近年来,CD46相关报道已经不局限于先天免疫系统。大量研究表明CD46可以调节T细胞免疫力,特别是能够控制炎症[9] [10]。CD46除了在补体激活和适应性免疫应答调节中起作用外,它还被多种病毒和细菌用作细胞受体。一些麻疹病毒(MV)和腺病毒(Adv)可以通过与CD46结合而附着在细胞上。尽管RCA蛋白家族的其他成员也可以与病毒结合,但是与CD46结合的病原体还是占多数,因此,CD46通常也被称为 “病原体的磁铁”[11]。在第一部分中已经提到,CD46在细胞表面分布很广,所有有核细胞都有表达CD46,这也是其在病原体相互作用中的突出地位的主要原因。一些研究显示,CD46与病原体的相互作用可以下调细胞中的CD46水平,从而增加了感染细胞的补体敏感性[12]。最近的一项研究揭露CD46和自噬相关因子之间存在直接联系。CD46对病原体的识别会触发自噬,这也是控制感染的关键步骤[13]。
3. CD46在天然免疫与适应性免疫中的作用机制
3.1 CD46与天然免疫
天然免疫,指个体出生时即具备,作用范围广,不针对特定抗原的免疫能力,所以也叫非特异性免疫。在机体防御机制中具有重要作用,是抵抗病原微生物感染的第一道防线。CD46与天然和致病性配体相互作用后可抑制小鼠和人的巨噬细胞和树突状细胞(DC)产生白介素IL-12。 此外,CD46介导的信号直接抑制γδT细胞产生效应细胞因子干扰素IFNγ。
除了CD46信号在巨噬细胞、树突状细胞和上皮细胞上的作用,CD46在其他先天免疫细胞(包括NK细胞、NK T细胞、肥大细胞、嗜中性粒细胞和单核细胞)上的作用还有待进一步研究。 目前只有一项体外研究发现CD46在NK细胞上募集激活后,细胞杀伤活性降低[14]。
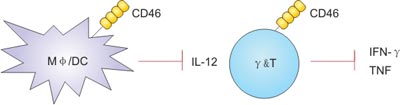
Figure 3. CD46 modulates innate cell functions
3.2 CD46与适应性免疫
适应性免疫又称获得性免疫或特异性免疫,这种免疫只针对一种病原体。它是人体经后天感染或人工预防接种而使机体获得的抵抗感染能力。一般是在微生物等抗原物质刺激后才形成的(免疫球蛋白、免疫淋巴细胞),并能与该抗原起特异性反应。
起初,在Astier等的研究中,他们观察到CD46在人CD4+ T细胞上作为共刺激分子起作用,可在抗原呈递过程中激活后诱导高细胞增殖。随后,在这一发现上开展了一系列的研究并最终证明,在T细胞活化过程中,CD46诱导了分泌IL-10-调节性T细胞(Treg)的活化或生成。由于Treg在自身免疫性疾病和移植排斥反应方面的治疗潜力,与Treg相关的研究也是越来越多。Treg可以抑制和控制效应Th1,Th2和Th17 T细胞的激活。如Figure 4所示,在Th1应答的诱导阶段,IL-2和C3b的产量较低,并支持增殖分泌IFN-γ型Th1细胞控制感染。Th1效应细胞的扩增可充分提高局部IL-2来诱导IL-10共表达和调控[15][16][17]。
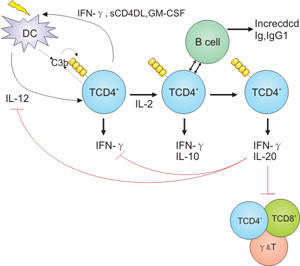
Figure 4. Regulation of adaptive T cell responses
4. CD46与疾病
多项研究已证明CD46与多种免疫炎性疾病相关。Sandra等人在已戒烟人群中发现CD46高表达可使其避免因自身免疫反应及炎症反应引起肺气肿及慢性梗阻性肺疾病。多发性硬化疾病过程中,缺乏CD46会影响T细胞的增殖与分化,从而导致抗炎症因子IL-10分泌减少[18]。Jones等人检测了类风湿关节炎患者的关节液和外周血中中性粒细胞里CD46表达,发现关节液中CD46表达较高,认为类风湿关节炎关节液中CD46表达变化可增强中性粒细胞黏附、抵抗补体以及增强清除免疫复合物的能力[19]。另外,CD46的表达在肿瘤逃逸、缺血再灌注中也有明显变化。综上所述,我们可以推出CD46可抑制补体系统活化从而减轻免疫反应以及通过调节T细胞从而影响抗炎因子的生成,最终影响炎性反应。
此外,M. Kathryn Liszewski等人也发现CD46突变与非典型溶血性尿毒综合征(Atypical hemolytic uremic syndrome)密切相关。导致aHUS沉淀的因素包括感染、妊娠、外伤或药物。对于为什么肾内皮是器官损伤的主要部位,目前尚不清楚。但目前清楚的是,这种疾病的病因是无法控制受损或受压细胞表面上的选择性途径(AP),从而导致“自我修复”过度激活。突变蛋白功能障碍可能是由于功能丧失或功能获得引起的。两者都会导致C3b降解效率降低及C3和C5转化酶持续活跃,进而产生过量的补体途径效应子。此外,C5b启动MAC组装,导致膜损伤,而C5a募集并激活白细胞并上调血管粘附性。由于补体激活与补体调节之间的微妙平衡干扰了内皮细胞,血栓性微血管病随之而来,血管壁变厚、细胞充血和破坏[20]。
5. 最新药物研究进展
目前相关数据库并未查到与CD46相关已上市药物,现在已经上临床的相关药物如下:
| 英文名称 | 研发代码 | 研发阶段 | 公司 | 适应症 |
|---|---|---|---|---|
| Enadenotucirev | ColoAd-1; Oncolytic Ad11/Ad3 | 临床二期 | PsiOxus Therapeutics, 默沙东 | 实体瘤, 结肠直肠癌, 膀胱癌, 卵巢癌 |
| Carcinoembryonic antigen-expressing measles virus (National Cancer Institute) | / | 临床一期 | 美国国立癌症研究所 | 神经胶质瘤, 成胶质细胞瘤, 原发性腹腔癌, 卵巢癌, 间变性星形细胞瘤 |
| AugmAb | BRM-132 | 临床一期 | 全福生物科技, PAI Life Sciences | 癌症 |
| FOR-46 | FOR-46,FOR 46,FOR46 | 临床一期 | 圣迭戈加利福尼亚大学 | 前列腺癌, 多发性骨髓瘤 |
CD46蛋白
Recombinant Human Membrane cofactor protein(CD46),partial (Active) (Code: CSB-MP004939HU)
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
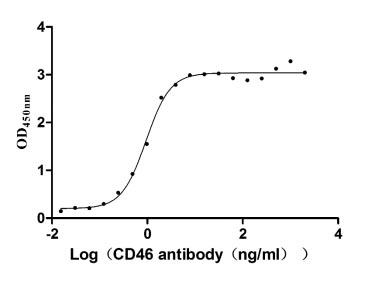
Immobilized CD46 at 2 μg/ml can bind Anti-CD46 rabbit monoclonal antibody, the EC50 of human CD46 protein is 0.8333-1.054 ng/ml.
References
[1] Cole JL, Housley GA Jr, et al. Identification of an additional class of C3-binding memberane protein of human peripheral blood leukocyters and cell lines [J]. Pro Natl Acad Sci USA. 1985, 85:859-863.
[2] J. Cardone, G. Le Friec, et al. CD46 in innate and adaptive immunity: an update [J]. Clinical and Experimental Immunology. 2011, 164: 301–311.
[3] Le Friec G, Kemper C. Complement: coming full circle [J]. Arch Immunol Ther Exp (Warsz). 2009, 57:393–407.
[4] Gill DB, Atkinson JP. CD46 in Neisseria pathogenesis [J]. Trends Mol Med. 2004, 10(9):459-65.
[5] B. David Persson, Nikolaus B. Schmitz, et al. Structure of the Extracellular Portion of CD46 Provides Insights into Its Interactions with Complement Proteins and Pathogens [J]. PLoS Pathog. 2010, 6(9): e1001122.
[6] Seya T, Turner J, et al. Purification and characterization of a membrane protein (gp45–70) that is a cofactor for cleavage of C3b and C4b [J]. J Exp Med. 1986, 163:837–855.
[7] Liszewski MK, Post TW, Atkinson JP. Membrane cofactor protein (MCP or CD46): newest member of the regulators of complement activation gene cluster. Annu Rev Immunol [J]. 1991. 9:431–455.
[8] Rebecca C. Riley-Vargas, Darcy B. Gill, et al. CD46: expanding beyond complement regulation [J]. Trends Immunol. 2004, 25(9):496-503.45.
[9] Astier AL. T-cell regulation by CD46 and its relevance in multiple sclerosis. Immunology [J]. 2008, 124:149–154.
[10] Griffiths MR, Gasque P, et al. The multiple roles of the innate immune system in the regulation of apoptosis and inflammation in the brain [J]. J Neuropathol Exp Neurol. 2009, 68:217–226.
[11] Cattaneo R. Four viruses, two bacteria, and one receptor: membrane cofactor protein (CD46) as pathogens magnet [J]. J Virol. 2004, 78:4385–4388.
[12] Sakurai F, Akitomo K, et al. Downregulation of human CD46 by adenovirus serotype 35 vectors [J]. Gene Ther. 2007, 14:912–919.
[13] Joubert PE, Meiffren G, et al. Autophagy induction by the pathogen receptor CD46 [J]. Cell Host Microbe. 2009, 6:354–366.
[14] Al-Shouli S, Cardone J, et al. Let’s connect: a novel role for CD46 in tight junction regulation [J]. Mol Immunol. 2010; 47:2252–3.
[15] Cardone J, Le Friec G, et al. Complement regulator CD46 temporally regulates cytokine production by conventional and unconventional T cells [J]. Nat Immunol. 2010; 11:862–71.
[16] Sakaguchi S, Miyara M, et al. FOXP3+ regulatory T cells in the human immune system [J]. Nat Rev Immunol. 2010; 10:490–500.
[17] Barrat FJ, Cua DJ, et al. In vitro generation of interleukin 10-producing regulatory CD4(+) T cells is induced by immunosuppressive drugs and inhibited by T helper type 1 (Th1)- and Th2-inducing cytokines [J]. J Exp Med. 2002; 195:603–16.
[18] AstierAL. T-cell regulation by CD46 and its relevance in multiple sclerosis [J]. Immunology. 2008, 124(2):149-154.
[19] Alvarez afuente R, Blanco Kelly F, et al. CD46 in a Spanish cohort of multiple sclerosis patients: genetics, mRNA expression and response to interferon beta treatment [J]. Mult Scler. 2011, 17(5):513-520.
[20] M. Kathryn Liszewski and John P. Atkinson. Complement regulator CD46: genetic variants and disease associations [J]. Hum Genomics. 2015; 9(1): 7.











