TNFRSF9:它是重要的激活型免疫检查点分子,肿瘤治疗未来之星
日期:2021-09-17 08:41:31
上个月,发表在Nature Communications(IF=14.919)上的一项研究指出,TNFRSF9激动剂与PD-L1联合使用可以有效地激活和扩增肿瘤特异性细胞毒性T细胞,增强对肿瘤的控制和杀伤 [1]。近年来,TNFRSF9作为癌症和各种自身免疫性以及炎症性疾病的治疗靶点受到了广泛关注。然而,最近的研究表明,TNFRSF9及其配体TNFSF9之间的调控网络更为复杂,主要是由于它们之间的双向信号传导。TNFRSF9作为增强抗肿瘤免疫反应的潜力靶点,其背后的复杂机制引起了研究人员的兴趣。那么,TNFRSF9及其配体介导的信号通路是什么?TNFRSF9靶向治疗的潜在价值如何?今天,我们一起来了解一下。
1. TNFRSF9的结构和表达
TNFRSF9(也称为ILA;4-1BB;CD137;CDw137)属于肿瘤坏死因子(TNF)受体超家族。TNFRSF9是一种II型膜糖蛋白,分子量约为30 kDa [2, 3]。TNFRSF9有两种存在形式,膜结合型和可溶分泌型,可溶性的TNFRSF9,无跨膜结构域 [4]。人TNFRSF9位于染色体1p36。如图1所示,人TNFRSF9全长包含255个氨基酸(amino acid, aa),其中,17aa信号肽、169aa的胞外区、27aa跨膜区(p.187–213)和42aa的胞内区。大量研究发现,TNFRSF9是T细胞表面一种重要的激活型免疫检查点分子 [5, 6]。
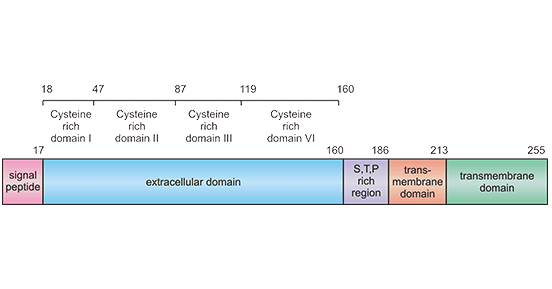
图1.TNFRSF9结构示意图
*图片来源于Cancer gene therapy出版物 [6]
TNFRSF9在小鼠和人CD4+和CD8+T细胞中广泛表达 [7]。此外,TNFRSF9还在小鼠活化的自然杀伤(NK)和树突状细胞(DC)中表达。人TNFRSF9也在DC、单核细胞、肝癌细胞、恶性肿瘤患者的血管中表达。TNFRSF9在抗原暴露后可迅速在CD4+和CD8+T细胞上表达,激活的TNFRSF9通过在免疫细胞间传递活化、增殖或者凋亡信号来调节T细胞介导的免疫反应 [6]。TNFRSF9作为一个新发现的免疫刺激分子,其潜在的实力不容小觑。
2. TNFRSF9的配体
TNFSF9为TNFRSF9的配体,也常见为4-1BBL或CD137L,是一种II型跨膜糖蛋白,常为三聚体,分子量约为34kDa,也属于肿瘤坏死因子超家族成员 [8, 9]。TNFSF9表达于抗原递呈细胞(如巨噬细胞、树突状细胞、B细胞)及多种肿瘤细胞的表面。TNFSF9经蛋白酶水解脱落可形成可溶性、具有生物活性的分子,并作为可溶性配体发挥作用 [10]。三个单体的TNFRSF9与三聚化的TNFSF9结合,激活TNFSF9在抗原呈递细胞(APCs)中的逆向信号(图2)。此外,多项研究表明,TNFRSF9/TNFSF9是一对重要的共刺激分子,在活化细胞与抗原呈递细胞之间传导双向信号。耐人寻味的是,人们发现TNFRSF9和TNFSF9这两种蛋白在各种癌症、自身免疫、感染和炎症疾病中扮演多种角色,介导着复杂的免疫反应 [11]。
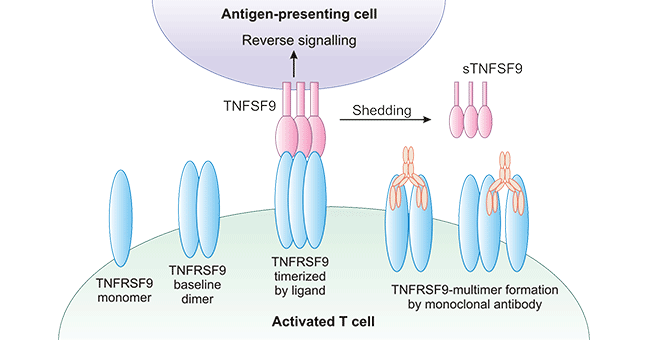
图2. TNFRSF9与TNFSF9的结合
*图片来源于Trends in pharmacological sciences出版物 [10]
3. TNFRSF9和TNFSF9介导的信号传导机制
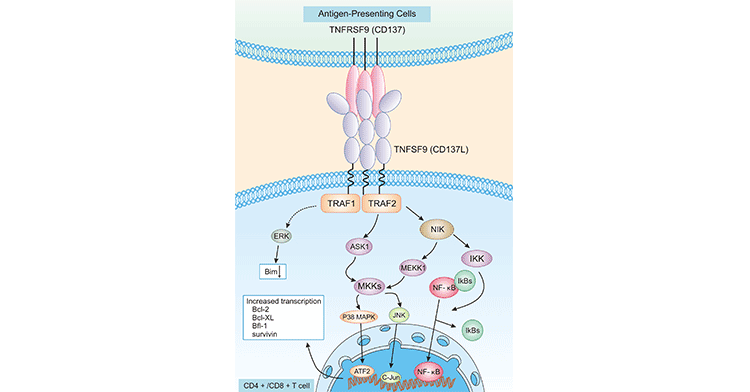
3.1 TNFRSF9信号传导机制
TNFRSF9与TNFSF9的结合,将激活TNFRSF9并启动一系列复杂的细胞内信号传导途径。如图3所示,TNFRSF9/TNFSF9激活,导致TNFR因子(TRAF1和TRAF2)的募集,从而导致活化B细胞的NF-κB、JNK/SAPK和p38 MAPK通路的激活。产生的共刺激信号可诱导CD4+和CD8+T淋巴细胞的活性。此外,通过p38 MAPK激活CD4+T淋巴细胞对于辅助性T细胞(Th)1和2的发育以及Th1效应细胞的调节也是非常重要的 [13]。这些信号通路将影响肿瘤相关蛋白的表达,包括促生存的Bcl-2、Bcl-XL和Bfl-1蛋白,促凋亡的Bim蛋白 [14]。由于TNFRSF9和TNFSF9在各种细胞上的结合可以引发双向信号,诱导各种免疫反应,涉及适应性免疫和先天性免疫,这种复杂调控网络的具体机制仍不明确 [15]。
3.2 TNFSF9逆向信号传导机制
如前所述,TNFSF9能向自身所在的细胞传递信号,也就是可激活配体依赖的信号转导途径,也称为“逆向信号”,引起逆向信号诱导的细胞反应 [16]。TNFSF9介导的逆向信号同TNFRSF9受体介导的信号一样复杂。此外,小鼠的TNFSF9逆向信号传导与人类的TNFSF9逆向信号传导非常不同。目前还不知道它们之间的具体联系。关于TNFSF9逆向信号传导机制方面有很多假设,一些研究指出,人TNFSF9逆向信号传导途径涉及Src酪氨酸激酶、PI3K、p38 MAPK、ERK1/2或NF-κB [17]。在小鼠巨噬细胞中,TNFSF9同TNFRSF9的结合会增加酪氨酸激酶(如Src)的磷酸化 [18]。综上所述,TNFRSF9和TNFSF9参与了多种调控机制,在各种细胞中的具体作用有待进一步阐明。
4. TNFRSF9在癌症和自身免疫性疾病中的作用
尽管TNFRSF9和配体TNFSF9之间的复杂机制尚未明确,但大量研究发现,TNFRSF9/TNFSF9在感染性炎症、自身免疫性疾病中扮演重要角色。值得注意的是,大量动物临床前研究表明,TNFRSF9参与到癌症免疫调节中,这将为开发TNFRSF9癌症免疫疗法提供新的方向。
肿瘤组织常低表达或不表达特异性抗原,免疫系统识别肿瘤抗原是引发机体抗肿瘤免疫的关键。已有大量研究报道TNFRSF9在肿瘤病人体内的异常表达情况。且TNFRSF9在血管壁、内皮层和血管平滑肌细胞中表达较强 [19]。一项免疫组化实验发现,在良性肿瘤(2/14)和炎性组织(2/9)中只有少数具有TNFRSF9表达的血管,然而在恶性肿瘤中有TNFRSF9表达的血管的比例明显增高(11/34)。TNFRSF9阳性血管的肿瘤组织包括纤维肉瘤、肾母细胞瘤和羊齿状细胞瘤 [19]。通过构建小鼠肿瘤模型研究发现,TNFRSF9可以促进CD8+T细胞增殖,同时促使CD8+向肿瘤内浸润。一方面TNFRSF9可增强CD8+的免疫效应,另一方面,可通过增强CD4+T细胞、NK细胞的免疫功能来增强CD8+T细胞介导的肿瘤免疫应答 [20, 21]。
在胃癌中,癌细胞的免疫状态与TNFRSF9和TNFSF9的表达状态有关,如果肿瘤细胞TNFRSF9呈高表达,则机体对于肿瘤细胞的杀伤作用会更强,反之,如果TNFSF9呈低表达,不能很好的构建TNFRSF9/TNFSF9信号通路,机体对于肿瘤的免疫监视作用便会减弱,更容易发生免疫逃逸。近年来,越来越多的研究发现,TNFRSF9/TNFSF9参与各种肿瘤免疫调控,包括胰腺癌 [22]和肝细胞癌 [23],但尚未明确它们在肿瘤发展中的具体作用。
在一些自身免疫性疾病中,研究发现TNFRSF9/TNFSF9信号的中断可以改善单纯疱疹病毒性角膜炎(HSK)和类风湿性关节炎(RA),但会加剧泪腺疾病和系统性红斑狼疮(SLE)的症状 [24, 25]。因此,在自身免疫性疾病中,TNFRSF9并不总是中发挥保护作用,因为它参与了极其复杂的免疫调控过程。TNFRSF9在人类疾病中的具体作用仍有待确定。无论如何,针对TNFRSF9和TNFSF9的研究将为肿瘤治疗或自身免疫性疾病提供新的诊疗思路。
5. 靶向TNFRSF9的临床应用前景
近年来一些TNFRSF9激活型单抗显示出临床应用潜力。例如全人源化TNFRSF9单抗Urelumab已经在人类黑色素瘤、肾癌并以及卵巢癌开展了临床I期和Ⅱ期试验,耐受性良好。另一个全人源化TNFRSF9单抗Utomilumab(辉瑞公司)被批准用于晚期实体瘤和恶性B细胞白血病I期临床(NCT01307267)试验。目前流行的理论认为,TNFRSF9激动剂可用于治疗主要由CD4+T细胞介导的癌症和自身免疫性疾病,而TNFRSF9激动剂可能会使由CD8+T细胞介导的自身免疫性疾病恶化。尽管大多数研究数据表明,TNFRSF9激动剂对CD8+T细胞的共同刺激,但在什么条件下它们会增强或抑制患者的免疫反应还需开展深入的临床研究。截至目前,以TNFRSF9为靶点的药物均尚未上市,但TNFRSF9激动剂或拮抗剂已在制药巨头中掀起了研发热潮,这些靶向TNFRSF9的药物正处于临床试验(见下表)。
| 药物名称 | 临床状态 | 公司 | 适应症 | 最后更新日期 |
|---|---|---|---|---|
| RO-7122290 | 临床二期 | F. Hoffmann-La Roche Ag; | 结直肠癌; | 2021-04-08 |
| EU-101 | 临床二期 | Eutilex; | 非小细胞肺癌; 结直肠癌; 实体瘤; |
2021-06-02 |
| ND-021 | 临床二期 | Numab Therapeutics Ag; | 非小细胞肺癌; 实体瘤; 肿瘤; |
2021-07-12 |
| GEN-1046 | 临床二期 | Genmab; | 非小细胞肺癌; 宫颈癌; 三阴性乳腺肿瘤; 实体瘤; 头颈部鳞状细胞癌; 移行细胞癌; 子宫内膜癌; |
2020-08-28 |
| GEN-1042 | 临床二期 | Genmab; | 非小细胞肺癌; 黑色素瘤; 结直肠癌; 实体瘤; |
2021-07-13 |
| ES101 | 临床二期 | Elpiscience Biopharma, Ltd; 科望(苏州)生物医药科技有限公司; |
非小细胞肺癌; 小细胞肺癌; 胸部肿瘤; 实体瘤; |
2021-04-14 |
| Utomilumab | 临床二期 | Kite, A Gilead Company; Morphosys; 辉瑞; |
口咽肿瘤; 鳞状细胞癌; 弥漫性大B-细胞淋巴瘤; 乳腺癌; B-细胞淋巴瘤; 肿瘤; 结直肠癌; 卵巢癌; 非霍奇金淋巴瘤; 非小细胞肺癌; 黑色素瘤; 滤泡中心淋巴瘤; 肾细胞癌; 头颈部鳞状细胞癌; 实体瘤; |
2020-12-30 |
| ADG-106 | 临床二期 | Adagene Inc; 天演药业(苏州)有限公司; |
非霍奇金淋巴瘤; 实体瘤; |
2021-01-14 |
| Delolimogene mupadenorepvec | 临床二期 | Lokon Pharma Ab; Uppsala University; |
胆管癌; 黑色素瘤; 结直肠癌; 卵巢癌; 胰腺癌; |
2020-08-28 |
| Urelumab | 临床二期 | 百时美施贵宝; 小野制药; |
慢性淋巴细胞白血病; B-细胞淋巴瘤; 多发性骨髓瘤; 结直肠癌; 头颈癌; 实体瘤; 非小细胞肺癌; 肿瘤; 非霍奇金淋巴瘤; 黑色素瘤; |
2020-08-28 |
| ATOR-1017 | 临床一期 | Alligator Bioscience; Alligator Bioscience Ab; |
转移癌; 实体瘤; |
2020-08-28 |
| INBRX-105 | 临床一期 | Inhibrx; Inhibrx Inc; |
非霍奇金淋巴瘤; 非小细胞肺癌; 黑色素瘤; 肾细胞癌; 实体瘤; 食道腺癌; 头颈部鳞状细胞癌; 胃癌; 移行细胞癌; |
2020-08-28 |
| 西达珠单抗 | 临床一期 | 山东泰泽惠康生物医药有限责任公司; 泰泽惠康(北京)生物医药有限责任公司; |
实体瘤; 黑色素瘤; 移行细胞癌; |
2021-07-12 |
| QL-1806 | 临床一期 | 齐鲁制药有限公司; | 肿瘤; | 2021-07-12 |
| HOT-1030 | 临床一期 | 华博生物医药技术(上海)有限公司; 上海华奥泰生物药业股份有限公司; |
实体瘤; | 2021-07-12 |
| IBI319 | 临床一期 | 信达生物制药(苏州)有限公司; | 肿瘤; | 2021-07-12 |
| GNC-039 | 临床一期 | 四川百利药业有限责任公司; | 胶质瘤; 实体瘤; 转移癌; 血液肿瘤; |
2021-07-12 |
| ABL-503 | 临床一期 | Abl Bio Inc; | 实体瘤; | 2021-04-07 |
| TJ-CD4B | 临床一期 | 天境生物科技(上海)有限公司; | 实体瘤; 食道癌; 食道腺癌; 胃癌; |
2021-06-01 |
| GNC-035 quadr-specific antibody(baili)(GNC-035四特异性抗体) | 临床一期 | 四川百利药业有限责任公司; | 实体瘤; | 2021-08-12 |
| FS-222 | 临床一期 | F-star Beta Ltd; | 转移癌; | 2021-08-12 |
| GNC-038 | 临床一期 | 四川百利药业有限责任公司; | 非霍奇金淋巴瘤; 急性淋巴细胞白血病; 实体瘤; |
2021-07-12 |
| LVGN-6051 | 临床一期 | 礼进生物医药科技有限公司; 礼进生物医药科技(苏州)有限公司; |
肿瘤; | 2021-01-14 |
| MP-0310 | 临床一期 | 百济神州有限公司; Molecular Partners Ag; |
实体瘤; | 2021-06-25 |
| CTX-471 | 临床一期 | Compass Therapeutics LLC; | 实体瘤; 转移癌; |
2020-10-23 |
| Cinrebafusp alfa | 临床一期 | Pieris Pharmaceuticals Inc; | 膀胱癌; 乳腺癌; 实体瘤; 胃癌; |
2021-04-13 |
| AGEN-2373 | 临床一期 | 安帝君斯公司; | 肿瘤; | 2020-08-28 |
| Anti BCMA CART cell therapy (Shanghai YaKe Biotechnology) | 临床一期 | 上海雅科生物科技有限公司; | 多发性骨髓瘤; | 2020-12-18 |
| PE-0116 | 临床一期 | 上海怀越生物科技有限公司; | 实体瘤; | 2021-07-12 |
| MCLA-145 | 临床一期 | Merus Nv; | 实体瘤; | 2020-08-28 |
| RG-7827 | 临床一期 | 罗氏; | 肿瘤; | 2020-08-28 |
| FS-120 | 临床一期 | F-Star; F-star Beta Ltd; |
转移癌; 肿瘤; |
2020-12-04 |
6. TNFRSF9相关科研产品
TNFRSF9蛋白
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
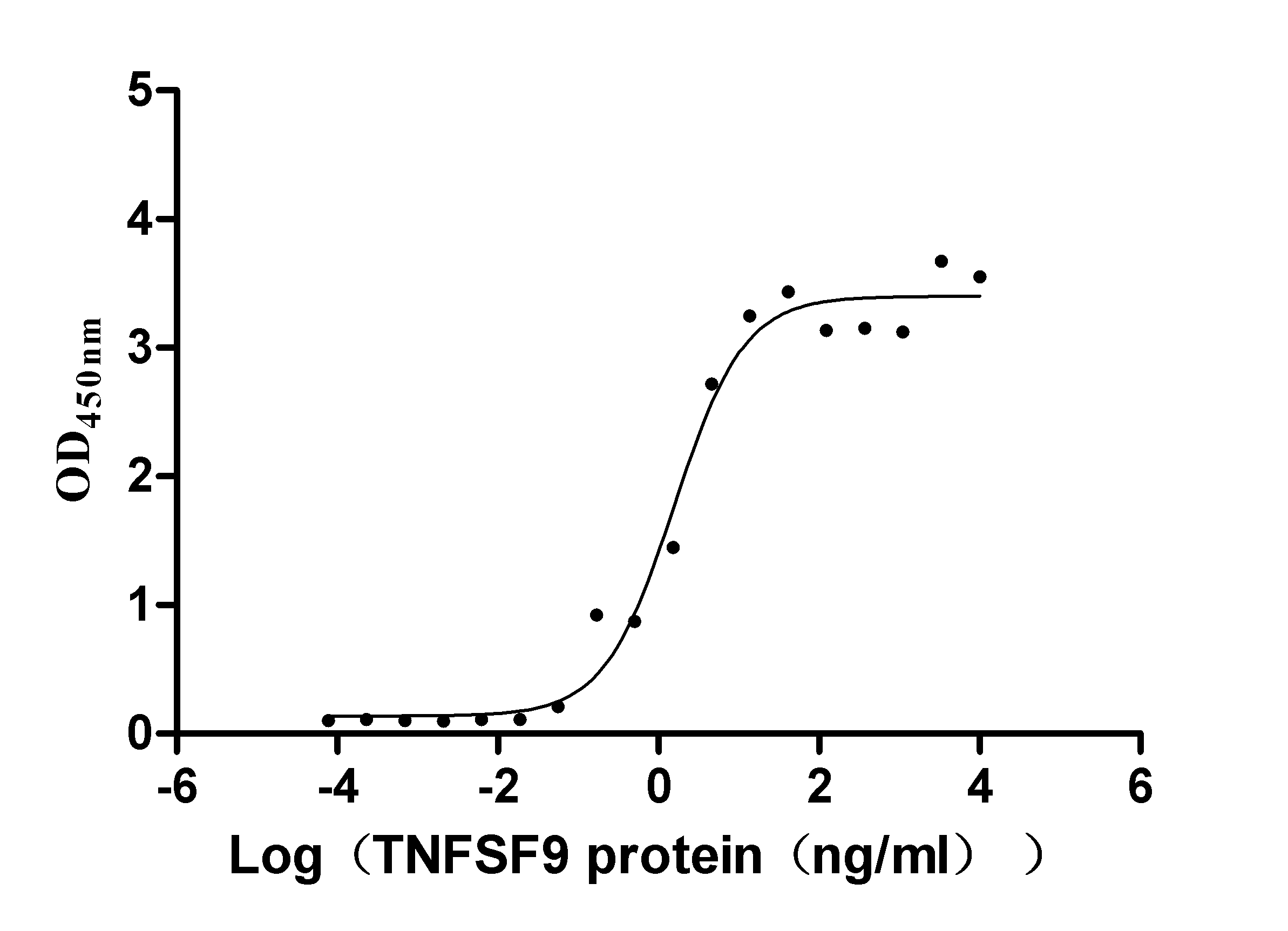
Immobilized TNFRSF9 at 2 μg/ml can bind TNFSF9(CSB-MP023997HU1), the EC50 is 1.011-2.429 ng/mL.
Recombinant Human TNFSF9, partial (Active) (CSB-MP023997HU1)
TNFRSF9 Antibody (ELISA, WB, IF) (CSB-PA08109A0Rb)
TNFSF9 Antibody (ELISA, IHC, IF) (CSB-PA08047A0Rb)
参考文献:
[1] Geuijen, Cecile, et al. "A human CD137× PD-L1 bispecific antibody promotes anti-tumor immunity via context-dependent T cell costimulation and checkpoint blockade." Nature Communications 12.1 (2021): 1-19.
[2] Lee, Seung-Woo, and Michael Croft. "4-1BB as a therapeutic target for human disease." Therapeutic Targets of the TNF Superfamily (2009): 120-129.
[3] Eckstrum, Kirsten, and Brent M. Bany. "Tumor necrosis factor receptor subfamily 9 (Tnfrsf9) gene is expressed in distinct cell populations in mouse uterus and conceptus during implantation period of pregnancy." Cell and tissue research 344.3 (2011): 567-576.
[4] Luu, Khang, Zhe Shao, and Herbert Schwarz. "The relevance of soluble CD137 in the regulation of immune responses and for immunotherapeutic intervention." Journal of leukocyte biology 107.5 (2020): 731-738.
[5] Eckstrum, Kirsten, and Brent M. Bany. "Tumor necrosis factor receptor subfamily 9 (Tnfrsf9) gene is expressed in distinct cell populations in mouse uterus and conceptus during implantation period of pregnancy." Cell and tissue research 344.3 (2011): 567-576.
[6] Cheuk, Adam TC, Ghulam J. Mufti, and Barbara-ann Guinn. "Role of 4-1BB: 4-1BB ligand in cancer immunotherapy." Cancer gene therapy 11.3 (2004): 215-226.
[7] Deng, Guo-Min, et al. "Lupus serum IgG induces skin inflammation through the TNFRSF9 signaling pathway." The Journal of Immunology 184.12 (2010): 7154-7161.
[8] Bitra, Aruna, et al. "Crystal structures of the human 4-1BB receptor bound to its ligand 4-1BBL reveal covalent receptor dimerization as a potential signaling amplifier." Journal of Biological Chemistry 293.26 (2018): 9958-9969.
[9] Choi, Beom K., and Hyeon-Woo Lee. "The Murine CD137/CD137 Ligand Signalosome: A Signal Platform Generating Signal Complexity." Frontiers in Immunology 11 (2020): 3184.
[10] Melero, Ignacio, et al. "Multi-layered action mechanisms of CD137 (4-1BB)-targeted immunotherapies." Trends in pharmacological sciences 29.8 (2008): 383-390.
[11] Shuh, Maureen, et al. "Tumor necrosis factor-α: life and death of hepatocytes during liver ischemia/reperfusion injury." Ochsner Journal 13.1 (2013): 119-130.
[12] Wu, Yongxia, Claudio Anasetti, and Xue-Zhong Yu. "T-Cell Costimulation and Coinhibition in Graft-Versus-Host Disease and Graft-Versus-Leukemia Effect." Immune Biology of Allogeneic Hematopoietic Stem Cell Transplantation. Academic Press, 2019. 167-194.
[13] Makkouk, Amani, Cariad Chester, and Holbrook E. Kohrt. "Rationale for anti-CD137 cancer immunotherapy." European journal of cancer 54 (2016): 112-119.
[14] Shao, Zhe, and Herbert Schwarz. "CD137 ligand, a member of the tumor necrosis factor family, regulates immune responses via reverse signal transduction." Journal of leukocyte biology 89.1 (2011): 21-29.
[15] Nedoszytko, Bogusław, et al. "Pathogenesis of psoriasis in the “omic” era. Part II. Genetic, genomic and epigenetic changes in psoriasis." Advances in Dermatology and Allergology/Postȩpy Dermatologii i Alergologii 37.3 (2020): 283.
[16] MMoh, Mei Chung, et al. "Tumor necrosis factor receptor 1 associates with CD137 ligand and mediates its reverse signaling." The FASEB Journal 27.8 (2013): 2957-2966
[17] Park, Sang Jun, et al. "Reverse signaling through the co-stimulatory ligand, CD137L, as a critical mediator of sterile inflammation." Molecules and cells 33.6 (2012): 533-537.
[18] Kim, Dong‐Ku, Sang Chul Lee, and Hyeon‐Woo Lee. "CD137 ligand‐mediated reverse signals increase cell viability and cytokine expression in murine myeloid cells: Involvement of mTOR/p70S6 kinase and Akt." European journal of immunology 39.9 (2009): 2617-2628.
[19] Sun, Yonglian, Jonathan H. Chen, and Yangxin Fu. "Immunotherapy with agonistic anti-CD137: two sides of a coin." Cell Mol Immunol 1.1 (2004): 31-36.
[20] Broll, Karin, et al. "CD137 expression in tumor vessel walls: high correlation with malignant tumors." American journal of clinical pathology 115.4 (2001): 543-549
[21] Zhe, Shao. "Characterization of murine soluble CD137 and its biological activities." (2009).
[22] Glorieux, Christophe, and Peng Huang. "Regulation of CD137 expression through K-Ras signaling in pancreatic cancer cells." Cancer Communications 39.1 (2019): 1-11.
[23] Wang, Jun, et al. "CD137-mediated pathogenesis from chronic hepatitis to hepatocellular carcinoma in hepatitis B virus-transgenic mice." The Journal of Immunology 185.12 (2010): 7654-7662.
[24] Seo, Su K., et al. "Blocking 4-1BB/4-1BB ligand interactions prevents herpetic stromal keratitis." The Journal of Immunology 171.2 (2003): 576-583.
[25] Thum, Elaine, Zhe Shao, and Herbert Schwarz. "CD137, implications in immunity and potential for therapy." Front Biosci 14 (2009): 4173-4188.