造血干细胞表面标志物
日期:2020-01-10 13:43:12
造血干细胞(Hematopoietic stem cells, HSC)是一类成体干细胞,具有干细胞的特性:自我更新和分化潜能。
造血干细胞是一种骨髓来源的多能干细胞,它是血液系统中的“种子”细胞。造血干细胞(HSCs)在造血过程中形成血系中的所有细胞,包括各种成熟细胞如白细胞、红细胞、血小板等。在受到适当刺激时还分化为其他非造血组织(如脂肪细胞、心肌细胞、内皮细胞和胰腺细胞)[1]。
造血干细胞具有调节体内平衡、免疫功能、抗微生物、抗炎症等生物学功能。它在血液病、遗传性血液病和自身免疫性疾病的治疗方面有重要作用。
1. 造血干细胞类型
已经定义了两种类型的造血干细胞:能够终生保持自我更新和多谱系分化潜能的长期再生细胞(LTRC);来源于LTRC的短期再生细胞(STRC),虽然它们保持了多能性,但它们表现出更有限的自我更新潜能。它们重建髓系和/或淋巴系间隔的时间很短,大约6周。
2. 造血干细胞的来源
造血干细胞存在于成年人的骨髓中,特别是在骨盆、股骨和胸骨中。它们也存在于脐带血和少量的外周血中。
2.1 骨髓
造血干细胞(HSCs)是一种骨髓来源的多能干细胞。
从骨髓中获取造血干细胞通过外科手术,从两个髂骨后嵴分次采集。骨髓中每10万个细胞中约有1个是长期造血干细胞(LT-HSC)。
2.2 外周血
大部分造血干细胞来源于骨髓,少量的干细胞和祖细胞在血液中循环。人类造血干细胞的临床移植,可以从外周血中收集供体细胞。造血干细胞的采集是在粒细胞集落刺激因子(G-CSF)等造血生长因子的作用下,将骨髓中的HSC动员到外周血后,通过分离的方式采集。
2.3 脐带血(UCB)
脐带血是造血干细胞和造血祖细胞的丰富来源,它所含不同类型的造血祖细胞的数量大约是成人血液中观察到的数量的10倍。脐带血作为再生医学的特殊细胞来源,也含有多种类型的干细胞。
2.4 胎儿造血系统与胚胎造血干细胞
胎儿造血系统是造血干细胞的重要来源,但在临床上尚未得到应用。
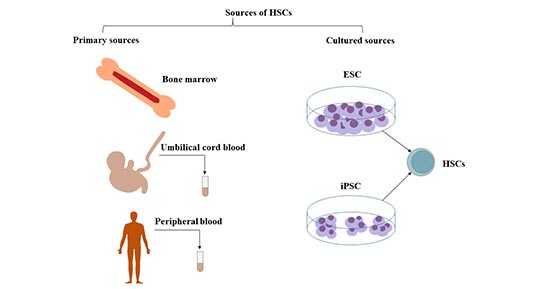
图1. 造血干细胞的来源
3. 造血干细胞的生物学特性
造血干细胞是真正的干细胞,因为它们具有多能性、自我更新能力。其他特性还包括它的异质性。
自我更新:造血干细胞的自我更新意味着造血干细胞产生与它们相同的子代细胞。它的这种能力,使得造血干细胞可以从单个细胞产生一个完整的造血系统,并在个体的一生中保持造血。
多能性:是指造血干细胞在需要时产生主要造血细胞类型的能力。造血干细胞(HSC)可分化为来自髓系(单核细胞和巨噬细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、巨核细胞/血小板、树突状细胞)和淋巴系(T、B和NK细胞)的各种血细胞。
造血干细胞具有极高的增殖潜能,使其能够满足正常成人一生中对造血的高需求。
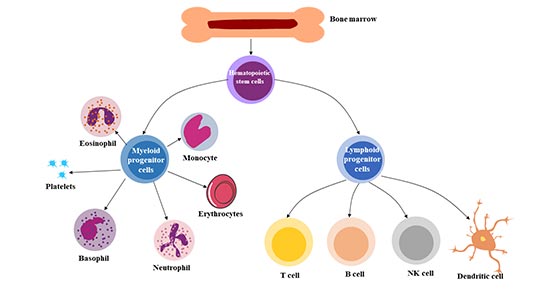
图2. 造血干细胞的多能性
可塑性:可塑性是指造血干细胞分化为多种非造血组织如心肌细胞的能力[2]。
造血干细胞运输:从胚胎起源开始,HSPC从一个生态位移动到另一个。造血干细胞(HSC)生态位是造血干细胞赖以生存和自我更新的空间位置和生理微环境。造血干细胞的运输可分为归巢、保留和植入。
异质性:造血干细胞内部的异质性是指造血干细胞具有不同的生理特征,如细胞周期状态[3]和自我更新能力[4],对不同的外部信号有不同的反应,在移植后有不同的谱系输出[5][6][7][8]。
造血干细胞内部的异质性是构成成人造血系统基础的最坚实的细胞部分,为什么存在HSC亚型、它们是如何产生的?
Muller-Sieberg组是最早确定HSC异质性的研究小组之一。HSC的异质性可以稳定地传播。HSC的异质性是如何产生的呢?目前认为造血干细胞(HSC)异质性产生的可能途径如下:
- 造血干细胞来源不同:HSC类型可能来自中胚层细胞、内皮细胞或来自于背主动脉前造血干细胞。
- 调控因素的差异:HSC的类型可能受不同的诱导性发育组织(如AGM、胎盘、卵黄囊、头部)的调节,并可能随着它们在循环中的迁移而改变;或受发育生态位(可能是血管、肝脏、神经或骨骼)的调节;或受不同的发育机制(如EHT)的调节。
- 此外,表观遗传修饰也可能解释不同HSC类型的存在。
4. HSC和免疫系统
造血干细胞(HSC)生态位是造血干细胞赖以生存和自我更新的空间位置和生理微环境。它保持干细胞在自我更新和分化之间的动态平衡。
研究表明,在活体内,造血干细胞的生态位为造血干细胞提供了免疫特权部位。调节性T细胞(Treg)与造血干细胞定位于骨髓的骨内膜区域,以保护造血干细胞免受免疫攻击。
此外,造血干细胞本身也通过调节表面免疫分子的表达而具有一定的免疫豁免潜能。
当HSCs被强炎症信号激活并动员进入循环时,HSCs表面的CD47水平显著上调。CD47与巨噬细胞上的信号调节蛋白结合,抑制吞噬作用。CD47在动员的造血干细胞表面表达的增加可以保护这些细胞不被吞噬。
5. 人体造血系统层次
造血系统中所有血细胞的起源被认为来自于具有自我更新能力的造血干细胞。
造血干细胞和祖细胞(HSPCs)库可分为三种类型的细胞:长期造血干细胞(LT-HSC)、短期造血干细胞(ST-HSPC)和多能祖细胞(MPP)。
造血系统中,静止的、长期再填充的造血干细胞(LT-HSC)位于所有成熟血细胞的顶端,通过其自我更新和不对称的细胞分裂潜能在一生中维持一个原始的多潜能池。在稳定状态下,造血干细胞衍生的子代具有对外周刺激的快速增殖能力,取代了活化的、消耗的或老化的血细胞的损失[9][10]。
ST-HSPC及其祖细胞具有维持正常造血6~8周的能力。丧失正常的LT-HSC和ST-HSPC功能是自然干细胞老化和几种造血疾病的标志,最显著的是血液系统恶性肿瘤的发展和进展[11]。
多能祖细胞(MPPs)是由造血干细胞产生的失去自我更新潜能但仍能完全分化为所有多系的多潜能祖细胞(MMPPs)。MPPs进一步产生低潜能祖细胞,即常见的淋巴和髓系祖细胞(CLPs和CMPs)。
所有这些低潜能祖细胞均可分化为有限的定型谱系:
CMPs可分化为巨核/红细胞祖细胞(MEPs)、粒/巨噬细胞祖细胞(GMPs)和树突状细胞(DC)祖细胞;
CLPs可分化为T细胞祖细胞、B细胞祖细胞、NK细胞祖细胞和DC祖细胞。[12][13]。
DC祖细胞(CD8+DC、CD8-DC和浆细胞样DC)可以来自CMPs和CLPs。
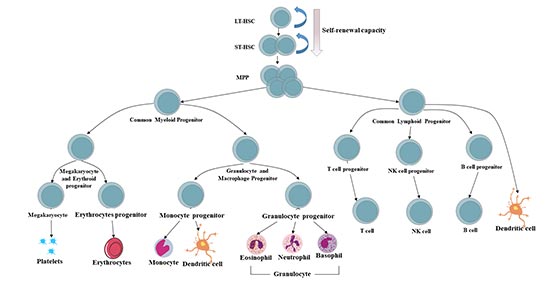
图3. 人体造血系统层次
6. 造血干细胞的细胞表面标志
尽管关于造血干细胞的研究很多,但是还没有发现一个单独的分子标记是由造血干细胞表达。由于造血干细胞缺乏成熟血细胞标志物的表达,因此被称为Lin-。对造血干细胞进行鉴定或分离一般都是采用多个不同的细胞表面标志物的组合,利用流式细胞术将稀少的造血干细胞从周围的血细胞中分离出来。
人造血干细胞与小鼠造血干细胞的标记物在普遍接受的造血干细胞类型上存在许多差异。
小鼠HSC:EMCN+、CD34lo/-、SCA-1+、Thy1.1+/lo、CD38+、C-kit+、lin-
人HSC:EMCN+、CD34+、CD59+、Thy1/CD90+、CD38lo/-、C-kit/CD117+、lin-
区分鼠标长期(LT-HSC)和短期(ST-HSC)造血干细胞和多能祖细胞(早期MPP和晚期MPP)标记如下:
LT-HSC:CD34-、CD38-、SCA-1+、Thy1.1+/lo、C-kit+、lin-、CD135-、Slamf1/CD150+
ST-HSC:CD34+、CD38+、SCA-1+、Thy1.1+/lo、C-kit+、lin-、CD135-、Slamf1/CD150+、Mac-1 (CD11b)lo
早期MPP:CD34+、SCA-1+、Thy1.1-、C-kit+、lin-、CD135+、Slamf1/CD150-、Mac-1 (CD11b)lo、CD4lo
晚期MPP:CD34+、SCA-1+、Thy1.1-、C-kit+、lin-、CD135high、Slamf1/CD150-、Mac-1 (CD11b)lo、CD4lo
6.1 主要标志物的介绍
6.1.1 CD34
CD34是最重要的标志之一,在造血干细胞及其祖细胞的分离和鉴定中,CD34分子是第一个被广泛研究的分子。CD34在人脐带血、骨髓和外周血中的表达约0.1 - 4.9%[14]。CD34在0.55%的人骨髓细胞上表达,在早期祖细胞上有表达,而在成熟的骨髓细胞上不表达。其他表面标记已经与CD34结合使用来区分原始细胞群体。
6.1.2 CD38
CD38又称环状ADP核糖水解酶,是一种存在于许多免疫细胞(白细胞)表面的糖蛋白,包括CD4+、CD8+、B淋巴细胞和自然杀伤细胞。CD38标记用于区分造血干细胞多能祖细胞(CD38-)和定向祖细胞(CD38+)。
6.1.3 CD90 (Thy1)
CD90,也被称为Thy-1,是一个28-30 kDa 的GPI连接膜糖蛋白。CD90表达于造血干细胞、神经元、胸腺细胞、外周T细胞、成纤维细胞和基质细胞。
CD90在CD34 + CD38-上的共表达定义了造血干细胞,而CD34 + CD38- CD90-定义了多能祖细胞。
6.1.4 CD117 (C-Kit)
CD117是一种145 kDa的蛋白酪氨酸激酶,也被称为c-Kit。CD117在多能造血祖细胞(约1-4%的骨髓细胞)、肥大细胞和急性髓系白血病细胞(AML)上表达。
通过与它的配体结合可诱导CD117的磷酸化,刺激原始造血干细胞、红细胞和单核细胞的增殖和存活。在配子形成、黑色素形成和造血过程中起着重要作用。
6.1.5 CD135 (Flk-2)
CD135,又称FLK-2、FLT3和Ly-72,是一种III型酪氨酸激酶受体。CD135既表达在正常的CD34+造血干细胞中,也表达于恶性造血细胞,包括AML、ALL和CML BC。
CD135与FLT3配体结合,可以调节造血干细胞的生长,促进具有髓系和B淋巴系潜能的原始造血祖细胞的存活。
6.1.6 CD150 (SLAM)
CD150又称SLAM,I型跨膜糖蛋白信号转导淋巴细胞活化分子,是CD2蛋白家族SLAM亚群的典型成员。
SLAM表达于胸腺细胞、T细胞亚群、B细胞、树突状细胞、巨噬细胞和造血干细胞。
6.1.7 CD184 (CXCR4)
CD184,又称Fusin或CXCR4。它广泛表达于血液和组织细胞,包括B细胞和T细胞、单核细胞、巨噬细胞、树突状细胞、粒细胞、巨核细胞/血小板、淋巴样细胞、髓样前体细胞、内皮细胞、上皮细胞、星形胶质细胞和神经元等组织细胞。
在骨髓龛中,造血干细胞表达CXCR4。CXCR4是趋化因子CXCL12 (SDF-1)的受体,介导血细胞迁移,参与B淋巴细胞和骨髓生成、心脏发生、血管形成和小脑发育。
CXCR4和SDF-1之间的相互作用负责HSC在小生境中的归巢和保留。HSC生态位中CXCR4/CXCL12 (SDF-1)的相互作用被认为是HSC动员的机制[15]。
6.1.8 Ly-6A/E (Sca-1)
Ly-6A/E,又称Sca-1,是Ly-6多基因家族的成员,是一种表达于造血干细胞上的糖基磷脂酰肌醇(GPI)连接蛋白。其在多能造血干细胞(HSC)上的表达已被用作两种Ly 6单倍体小鼠HSC的标记物。在成年动物的骨髓、胎肝、动员后的外周血和脾脏中均可见Sca-1阳性的造血干细胞。Ly-6A/E被认为参与了T细胞和B细胞反应的调节。
7. HSC的临床应用
7.1 造血细胞移植(HCT)
造血细胞移植按照干细胞来源可分为骨髓移植、外周血干细胞移植和脐血移植等。
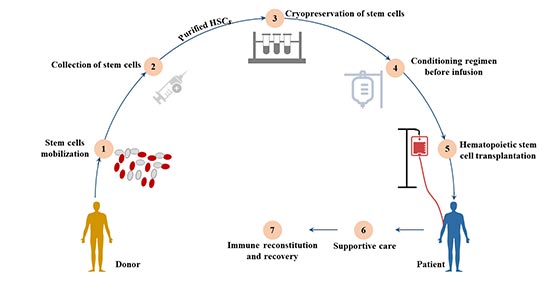
图4. 造血细胞移植
7.1.1 骨髓移植
骨髓移植是造血干细胞移植的一种常见类型,造血干细胞在骨髓移植中对患者血细胞的再增殖起着至关重要的作用。
按其供受者关系大体可分为自体造血干细胞移植和异体造血干细胞移植(包括同胞间、非亲缘间移植)。除了实体瘤外,骨髓移植还被用于治疗白血病和免疫系统紊乱等血液疾病[16]。
7.1.2 外围造血干细胞移植
外周血中循环的HSC在给予GM-CSF、IL-3或SCF等造血细胞因子后,其浓度可提高100倍。使用细胞分离器,通常可以从外周血中获得所需数量的HSC。
7.1.3 脐带血移植(UCB)
脐带血容易获得,且对捐赠者没有风险,因此是一个有吸引力的可移植造血干细胞的来源。
新生儿免疫系统的不成熟,脐带血中存在的淋巴细胞已被证明对HLA错配有更强的耐受性,因此在异基因移植环境中引发的急性和慢性移植物抗宿主病(GVHD)较少。
7.2 其他
造血干细胞还在包括移植物抗肿瘤治疗、耐受诱导、基因治疗[17]、再生医学等方面有广泛的应用。
References
[1] Chotinantakul K, Leeanansaksiri W. Hematopoietic stem cell development, niches, and signaling pathways [J]. Bone marrow research, 2012, 2012.
[2] Chatterjee T, Sarkar R S, Dhot P S, et al. Adult stem cell plasticity: Dream or reality? [J]. Medical journal, Armed Forces India, 2010, 66(1): 56.
[3] Wilson A, Laurenti E, Oser G, et al. Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair [J]. Cell, 2008, 135(6): 1118-1129.
[4] Ema H, Morita Y, Suda T. Heterogeneity and hierarchy of hematopoietic stem cells [J]. Experimental hematology, 2014, 42(2): 74-82. e2.
[5] Benz C, Copley M R, Kent D G, et al. Hematopoietic stem cell subtypes expand differentially during development and display distinct lymphopoietic programs [J]. Cell stem cell, 2012, 10(3): 273-283.
[6] Dykstra B, Kent D, Bowie M, et al. Long-term propagation of distinct hematopoietic differentiation programs in vivo [J]. Cell stem cell, 2007, 1(2): 218-229.
[7] Sieburg H B, Cho R H, Dykstra B, et al. The hematopoietic stem compartment consists of a limited number of discrete stem cell subsets [J]. Blood, 2006, 107(6): 2311-2316.
[8] Verovskaya E, Broekhuis M J C, Zwart E, et al. Heterogeneity of young and aged murine hematopoietic stem cells revealed by quantitative clonal analysis using cellular barcoding [J]. Blood, 2013, 122(4): 523-532.
[9] Busch K, Klapproth K, Barile M, et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo [J]. Nature, 2015, 518(7540): 542.
[10] Sawai C M, Babovic S, Upadhaya S, et al. Hematopoietic stem cells are the major source of multilineage hematopoiesis in adult animals [J]. Immunity, 2016, 45(3): 597-609.
[1] Sun J, Ramos A, Chapman B, et al. Clonal dynamics of native haematopoiesis [J]. Nature, 2014, 514(7522): 322.
[11] Yao J C, Link D C. Concise review: the malignant hematopoietic stem cell niche [J]. Stem Cells, 2017, 35(1): 3-8.
[12] Adams G B, Scadden D T. The hematopoietic stem cell in its place [J]. Nature immunology, 2006, 7(4): 333.
[13] Mosaad Youssef Mohamed,Hematopoietic stem cells: an overview. [J] .Transfus. Apher. Sci., 2014, 51: 68-82.
[14] Pranke P, Hendrikx J, Debnath G, et al. Immunophenotype of hematopoietic stem cells from placental/umbilical cord blood after culture [J]. Brazilian journal of medical and biological research, 2005, 38(12): 1775-1789.
[15] Herbert K E, Levesque J P, Mills A K, et al. How we mobilize haemopoietic stem cells [J]. Internal medicine journal, 2011, 41(8): 588-594.
[16] Rogers I, Casper R F. Umbilical cord blood stem cells [J]. Best Practice & Research Clinical Obstetrics & Gynaecology, 2004, 18(6): 893-908.
[17] Hirschi K K. Hemogenic endothelium during development and beyond [J]. Blood, 2012, 119(21): 4823-4827.











