CD22-B细胞受体辅因子
日期:2019-11-18 11:05:29
Autolus Therapeutics 是一家临床阶段的生物制药公司,开发用于治疗癌症的下一代程序化T细胞疗法。2019年4月23日,该公司宣布FDA已授予AUTO3药物名称。AUTO3用于逆转录病毒载体遗传修饰的自体富集T细胞以靶向CD19和CD22两种嵌合抗原受体,用于治疗急性淋巴细胞白血病。这一T细胞治疗法的出现,无疑是给了CAR-T细胞治疗研发人员一剂强心剂。截止到2019年11月,与CD22相关的临床研究已近108项。那究竟什么是CD22,主要的功能和作用机制又是什么?本文将从以下几个方面对CD22进行介绍:
1. CD22是什么?
CD22,又被称为Siglec-2,普遍存在于正常B细胞和B细胞恶性肿瘤中。CD22主要表达于成熟B细胞,是具有调控B细胞激活作用的细胞表面粘附分子,有助于B细胞对抗原反应敏感性的控制[1][2][3]。Tedder TF团队进一步证明了CD22表达在B细胞中具有特异性,并且在小鼠和人类中都受到发育调控[4]。如Figure 1所示,CD22可在原B细胞和前B细胞中表达,并逐渐转移到细胞表面,但是表达水平低;在IgM+和IgD+的成熟B细胞高表达,在滤泡性B细胞、套细胞、边缘区B细胞也高表达,但最终在CD27+记忆B细胞,尤其是浆细胞中,表达下调[5]。此外,最近的研究发现,在小鼠肠酸性粒细胞也观察到了CD22表达,这是一种新型的表达模式,表明CD22可能具有嗜酸性粒细胞调节功能[6]。
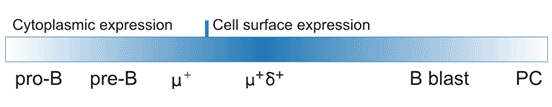
Figure 1. CD22 protein expression during B-cell development and activation.
2. CD22的结构
如Figure 2所示,人类CD22基因位于19号染色体长臂(19q13.1),至少有15个外显子,其中外显子4-10编码单链Ig域,外显子11-15编码跨膜结构域和胞内结构域。
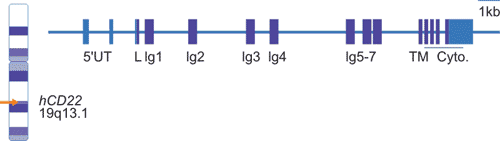
Figure 2. CD22 chromosomal location and organization.
CD22蛋白是I型跨膜蛋白,分子量为140 kDa,是唾液酸结合的免疫球蛋白样凝集素家族的重要成员。CD22的胞外域包含七个Ig域(Figure 3),最远端的V-set Ig域在结合α2,6唾液酸(α2,6sia)配体中起主要作用,相连的C2-set Ig域的功能可能是允许V-set Ig域正确折叠[7][8]。CD22的胞内域包括免疫受体酪氨酸抑制基序(ITIM)和免疫受体酪氨酸活化基序(ITAM)[9]。Ig样结构域1和2包含配体结合区; 当六个保守的酪氨酸残基中的一个或多个被磷酸化时,各种效应分子被募集到胞质域。CD22α和CD22β是CD22的两种亚型,其胞外域分别有5个和7个Ig域,这两种cDNA亚型来源于同一基因的不同拼接。
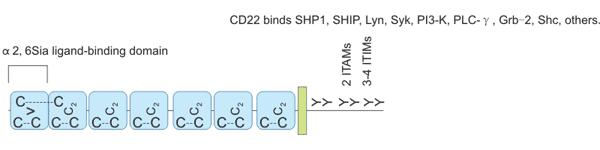
Figure 3. CD22 structure.
3. CD22的配体与信号通路
3.1 CD22的配体
CD22可以与含唾液酸的细胞相互作用,包括T细胞、B细胞、中性粒细胞、单核细胞和红细胞[10][11]。其中能与CD22胞外配体结合域相互作用的B细胞表面唾液酸配体为顺式配体,其他细胞表面配体则为反式配体。CD22通过顺式作用与B细胞表面的配体结合,通过反式作用与其他细胞表面配体、可溶性糖蛋白或细胞连接的抗原结合[12]。
顺式配体是CD22的主要结合配体,也是CD22活性的重要调节剂。CD22作为B细胞受体(BCR)的一个共受体,通过抗原引起CD22与BCR交联,触发CD22磷酸化,使下游信号蛋白去磷酸化和失活,从而抑制BCR信号传导,是抑制BCR的必需因子。CD22的反式作用可能介导细胞间交联、控制B细胞黏附和迁移,并对T细胞信号传导有重要意义。大多数B细胞表面的CD22呈遮蔽态,限制它们与反式配体的作用,除非细胞经过唾液酸酶或高碘酸盐预处理,才能结合外源性唾液酸。非遮蔽态CD22可能促进其与反式配体或顺式配体的特殊亚基(可能包括BCR)作用。
3.2 BCR调节机制及下游信号通路
CD22对B细胞信号传导的调节能力由CD22与BCR的远近决定,同时也受细胞外相互作用的控制。CD22是BCR的一个共受体,通过抗原或抗Ig引起CD22与BCR交联。CD22与BCR交联后会集中到脂筏上,然后Lyn会磷酸化CD22的酪氨酸残基[13][14]。磷酸化后,这些酪氨酸残基会变成下游信号分子SH2结构域的结合位点,这些分子会进一步激活其他信号传导分子(Figure 4)。例如Src同源性磷酸酶1(SHP-1)蛋白,主要作用是去磷酸化BCR,从而下调BCR信号并调节Ca2+信号转导[15]。
SHP-1的作用对象包括CD19和SLP65/B细胞接头蛋白(BLNK)[16]。其中SLP65/BLNK可形成一个支架并关联多个信号分子,包括Vav-1、Bruton酪氨酸激酶(Btk)和磷脂酶Cγ2(PLCγ2)。PLCγ2将磷脂酰肌醇4,5-双磷酸酯(PtdIns(4,5)P2)转化为1,4,5-三磷酸肌醇(Ins(1,4,5)P3)和二酰基甘油(DAG)。Ins(1,4,5)P3可通过多种途径促进Ca2+从细胞内存储的释放,包括Ca2+释放激活通道(CRAC)活化、核因子κB(NF-κB)激活,T细胞和因子(NFAT)活化及胞外信号调节激酶信号通路。
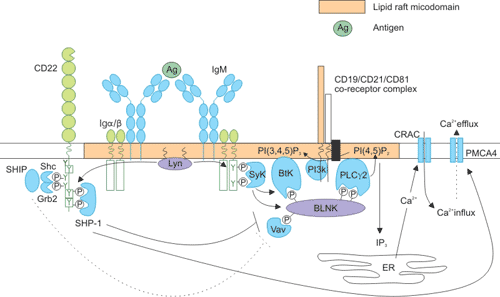
Figure 4. Intracellular signaling pathways of CD22
4. CD22与疾病
在第三部分中已经提到,CD22 分子对BCR复合物识别抗原产生的信号起抑制作用[16]。该抑制作用在CD22缺陷小鼠的研究实验中得到了进一步验证[17]。CD22缺陷小鼠的B细胞均表现出轻微活化状态,high IgD、low IgM的成熟B细胞比例增高,B细胞表面IgM (sIgM)水平降低,IgM的分泌增加,MHC II类分子表达量增加,B细胞激活的阈值下调[18]。作为限制B细胞的抗原,CD22为治疗自身免疫疾病和血液癌症中的B细胞失调提供了有效靶点。
4.1 CD22与自身免疫性疾病
CD22通过与BCR交联,抑制B细胞对自身抗原的反应,阻止自身反应性B细胞激活,从而抑制自身免疫性疾病的发生。CD22表达或功能受损在自身免疫性疾病的发病机制中起作用,如系统性红斑狼疮(SLE)、类风湿性关节炎(RA)等[19][20]。
SLE是一种常见的累及多脏器的慢性系统性自身免疫性疾病,其主要特征是多克隆B细胞异常活化、自身抗体产生、免疫复合物沉积,引起多脏器损伤。CD22缺陷小鼠的B细胞对受体信号的反应过度,BCR结合引起的Ca2+内流增加,使血清IgG抗dsDNA抗体滴度增加,这些抗体是多克隆起源的,存在不良变异和高亲和力。
4.2 CD22与血液癌症
在第一部分中,我们已经提到,CD22仅在成熟B细胞中表达。在大多数情况下,正常B细胞向肿瘤细胞转化过程中CD22 分子依然表达。相关数据显示,约60-80%的B细胞系淋巴瘤及白血病细胞表达CD22分子。目前除了化学疗法、放射疗法和裸mAb疗法之外,放射免疫疗法正在成为非霍奇金淋巴瘤患者的第四种治疗方法。放射性标记的CD22 mAb在B细胞淋巴瘤诊断和分期中敏感度很高。131I或90Y标记的CD22 mAb(LL2,埃普拉单抗)与CD22细胞外第三个Ig结构域结合可以完全缓解由裸CD22 mAb(LL2)在体外介导的抗体和补体依赖性细胞毒性[21][22]。
5. CD22相关药物研究进展
CD22分子是B细胞表面抑制性辅助受体之一,它与B细胞的发展、分化和功能有着密切的关系。CD22限制性地表达于成熟B细胞和大多数B淋巴瘤细胞表面。以CD22为靶点,进行肿瘤免疫治疗已经成为免疫研究热点之一。目前,关于CD22分子的免疫靶向治疗,除了治疗性抗体外,还有CAR-T细胞疗法。截止到2019年11月,虽然CD22相关抗体药物已批准上市的只有两种,但关于CD22 CAR-T细胞治疗和抗体药物的临床研究有近108项。FDA已批准上市的CD22相关药物如下表所示:
| Target | Name | Product Name | Actions | Indication | Company | Approved Time |
|---|---|---|---|---|---|---|
| B-cell receptor CD22 | Inotuzumab ozogamicin | Besponsa | Antibody | relapsed or refractory CD22-positive B cell precursor acute lymphoblastic leukaemia | WYETH PHARMS INC | 08/17/2017 |
| B-cell receptor CD22 | Moxetumomab Pasudotox | Lumoxiti | Binder | Relapsed/Refractory Hairy Cell Leukemia | ASTRAZENECA AB | 09/13/2018 |
在研药物:
| Target | Name | Product Name | Actions | Indication | Company | Phase |
|---|---|---|---|---|---|---|
| B-cell receptor CD22 | Epratuzumab | / | Antibody | Investigated for use/treatment in leukemia (lymphoid), lymphoma (non-hodgkins), and systemic lupus erythematosus | UCB Pharma | Phase II |
在研CAR-T细胞治疗详情请点击这里:https://clinicaltrials.gov/ct2/results?cond=&term=CD22&cntry=&state=&city=&dist=.
CD22蛋白
Recombinant Human B-cell receptor CD22(CD22),partial (Active) (Code: CSB-MP004900HU)
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
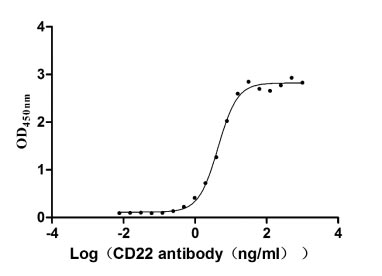
Immobilized CD22 at 2 μg/ml can bind Anti-CD22 rabbit monoclonal antibody, the EC50 of human CD22 protein is 4.034-4.800 ng/ml.
References
[1] Pezzutto A, Rabinovitch PS, et al. Role of the CD22 human B cell antigen in B cell triggering by anti-immunoglobulin [J]. J Immunol. 1988, 140:1791–1795.
[2] Wilson GL, Fox CH, et al. cDNA cloning of the B cellmembrane protein CD22: amediator of B-B cell interactions [J]. J ExpMed. 1991, 173:137–146.
[3] Thomas Dorner, Anthony Shock, et al. CD22 and Autoimmune Disease [J]. International Reviews of Immunology. 2012, 31:363–378.
[4] Tedder TF, Poe JC, et al. CD22: a multifunctional receptor that regulates B lymphocyte survival and signal transduction [J]. Adv Immunol. 2005, 88:1-50.
[5] Daridon C, Blassfeld D, et al. Epratuzumab targeting of CD22 affects adhesion molecule expression andmigration of B-cells in systemic lupus erythematosus [J]. Arthritis ResTher. 2010, 12:R204.
[6] Wen T, Mingler MK, et al. The pan-B cell marker CD22 is expressed on gastrointestinal eosinophils and negatively regulates tissue eosinophilia [J]. J Immunol. 2012, 188:1075–1082.
[7] Engel P, Wagner N, et al. Identification of the ligand-binding domains of CD22, a member of the immunoglobulin superfamily that uniquely binds a sialic acid-dependent ligand [J]. J ExpMed. 1995, 181:1581–1586.
[8] Nath D, van derMerwe PA, et al. Theamino-terminal immunoglobulin like domain of sialoadhesin contains the sialic acid binding site: comparison with CD22 [J]. J Biol Chem. 1995, 270:26184–26191.
[9] Wilson GL, Fox CH, et al. cDNA cloning of the B cell membrane protein CD22: a mediator of B-B cell interactions [J]. J ExpMed. 1991, 173:137–146.
[10] Engel P, Nojima Y, et al. The same epitope on cD22 of B lymphocytes mediates the adhesion of erythmcytes, T and B lymphocytes, neutrophils, and monocytes [J]. J Immunol. 1993, 150(11):4719-4732.
[11] Ramya TN, Weerapana E, et al. In situ trans ligands of CD22 identi6ed by glycan-protein photocross-linking-enabled proteomics [J].Mol Cell Pmteomics. 2010, 9(6):1339-1351.
[12] Smith KGC, Tarlinton DM, et al. Inhibition of the B cell by CD22: a requirement for Lyn [J]. J ExpMed. 1998, 187:807-811.
[13] Xu Y, Harder KW, et al. Lyn tyrosine kinase: accentuating the positive and the negative. Immunity [J]. 2005, 22:9–18.
[14] Doody GM, Justement LB, et al. A role in B cell activation for CD22 and the protein tyrosine phosphatase SHP [J]. Science. 1995, 269:242–244.
[15] Gerlach J, Ghosh S, et al. B cell defects in SLP65/BLNK-deficient mice can be partially corrected by the absence of CD22, an inhibitory coreceptor for BCR signaling [J]. Eur J Immunol. 2003, 33:3418–3426.
[16] June Ereño-Orbea, Taylor Sicard, et al. Molecular basis of human CD22 function and therapeutic targeting [J]. Nature Communications. 2017, 8(764).
[17]Samardzie T, Marinkovic D, et al.Reduction of marginal zone B cells in CD22-deficient mice [J]. Eur J Immunol. 2002, 32(2):561-567.
[18] Tooze RM, Doody GM, et al. Counterregulation by the coreceptom CDl9 and CD22 of MAP kinase activation by membrane immunoglobulin [J]. Immunity. 1997, 7(1):59-67.
[19] O Keefe TL, Williams GT, et al. Hyperresponsive B cells in CD22-de6cient mice [J]. Science. 1996, 274(5288):798-801.
[20] Nakiri Y, Minowa K, et al. E1pression of CD22 on peripheral B cells in patients with rheumatoid arthritis: relation to CD5-positive B cells [J]. Clin Rheumatol. 2007, 26(10):1721-1723.
[21] Thomas F. Tedder, Jonathan C. Poe, et al. CD22: A Multifunctional Receptor That Regulates B Lymphocyte Survival and Signal Transduction [J]. Advances in immunology. 2005, 88:1-50.
[22] Carnahan, J., Wang, P., et al. Epratuzumab, a humanized monoclonal antibody targeting CD22: Characterization of in vitro properties [J]. Clin. Cancer Res. 2003, 9:3982S–3990S.
上一篇: 自然杀伤细胞的表面标记
下一篇: PD-1——重要的免疫检查点











