多功能分子-CD31
日期:2019-08-29 11:31:08
CD31抗原,又称为血小板内皮细胞黏附分子(PECAM-1),是相对分子质量为130kDa 的I 型跨膜糖蛋白,属于免疫球蛋白超家族成员,可在内皮细胞、循环的血小板、单核细胞、中性细胞及T细胞亚群表面表达。在2015年ASCO会议上,Michael J. Birrer, MD团队结合他们的研究提出CD31是卵巢癌中贝伐单抗疗效的潜在标志物。因为贝伐单抗对无进展生存期和总生存期的影响在高CD31的患者中最为明显。这一发现再次引起了国内外学者对CD31的关注。本文就CD31的定义、结构、共受体、功能、信号通路及相关疾病进行简单介绍。
1. 什么是CD31?
CD31是是由位于17号染色体长臂末端的75kb基因编码的跨膜糖蛋白。CD31最早是Newman及其同事于1990年发表于Science上的一篇报告中提出。该文通过血小板整膜糖蛋白抗体结合实验发现了新的免疫球蛋白超家族细胞粘附分子(cell adhesion molecule,CAM)成员即是曾经确定为CD31的粒一单核细胞分化抗原[1] [2] [3]。
细胞粘附分子(CAM)是参与细胞与细胞之间及细胞与细胞外基质之间相互作用的分子。可大致分为五类:钙粘素(cadherin)、选择素(selectin)、免疫球蛋白超家族(IgSF)、整合素(integrin)及透明质酸粘素(hyaladherin)。免疫球蛋白超家族中的细胞粘附分子还有各种神经细胞粘附分子(N-CAM),细胞问粘附分子(I-CAM)及脉管细胞粘附分子(V-CAM)等,其中N-CAM和CD31属于亲同性CAM(两相邻细胞表面的同种CAM分子间的相互识别与结合);I-CAM和V-CAM属于亲异性CAM(两相邻细胞表面的不同种CAM分子间的相互识别与结合)。
2. CD31的结构
CD31是分子量为130kDa的跨膜糖蛋白。由于糖基化差异在不同细胞类型中分子有些许不同。人的CD31蛋白包含三个结构域,分别是胞外结构域,跨膜结构域和胞内结构域。其中,胞外结构域由574个氨基酸组成,跨膜结构域包含19个疏水氨基酸,胞内结构域包含118个氨基酸。功能区主要集中在胞外结构域和胞内结构域。结构如图一所示:
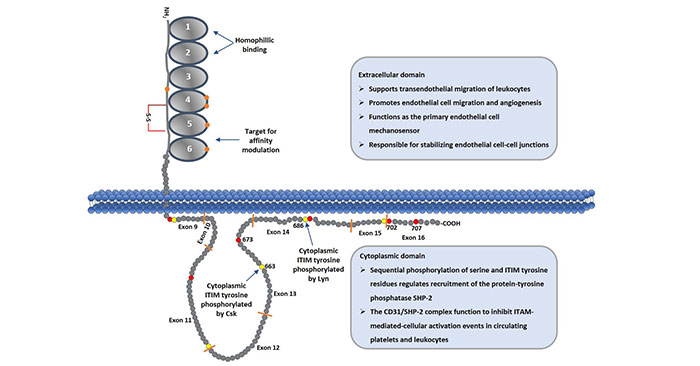
图1 Schematic Diagram of CD31 Protein
2.1 胞外结构域
CD31的胞外部分,除了信号肽之外,剩余的氨基酸形成6个免疫球蛋白亚单位组成的同源区,每个同源区由一个单独的外显子编码,并借助半胱氨酸残基形成的二硫键组成保守的IgC2型亚单位, 每个亚单位约含100个氨基酸残基。
CD31胞外区的第一、二免疫球蛋白样区(IgD1和IgD2)为嗜同种性粘附的结合位点,共同介导嗜同种性粘附,第六免疫球蛋白样区可调节CD31的粘附表型。增加受体与配体之间的第一、二免疫球蛋白样区的亲和力;CD31胞外区的第二免疫球蛋白样区为异嗜性粘附的结合位点,第二免疫球蛋白样区的肝素结合序列可介导异嗜粘附,且依赖于氨基葡聚糖的存在[4]。
2.2 胞内结构域
CD31胞内结构域的结构是由二维核磁共振确定,含有由非控制区域隔开的两个脂质相关区域。CD31基因通常由16额外显子组成(每个外显子之间由内含子隔开)。该结构域由8个外显子组成(如figure1所示)。
CD31胞内结构域含有两个共有序列,分别形成两个免疫受体酪氨酸抑制基序(ITIM),是含有SH2的酪氨酸磷酸酶2(SHP-2)停泊的特异位点,这两个特定的酪氨酸为Y663和Y686。SHP-2与磷酸化的Y663和Y686的结合引发反馈抑制性信号转导的发生,从而具有多种生理效应。CD31的胞内区含有12个Ser残基,4个Thr残基,5个Tyr残基。这些都是可进行磷酸化的位点。
通过编码胞浆区的变化性拼接可产生异构的CD31,因为异构的CD31可含有(或无)上述位点的氨基酸残基,所以可产生不同表型的CD31。胞浆区有助于CD31定位于细胞间连接和介导细胞间粘附,去除部分胞浆区可明显改变CD31的结合特性,使得CD31介导的粘附性由异嗜性向同种性转变[5] [6]。
3. CD31的共受体
大量研究证实CD31的共受体之一是其本身。亲和作用力通常是由CD31分子的第一和第二C2结构域(胞外第一和第二个IgD结构域)介导。另外,整联素的IgSF/CAM也可以与CD31结合,目前已证实的CD31共受体整联蛋白是αvβ3(或CD51 / CD61)整联蛋白。 尽管整联蛋白在T细胞,NK细胞,肥大细胞和内皮上表达,但它作为IgSF配体有点不寻常,因为所有其他ICAM / VCAM受体都是β1,β2或β7整联蛋白类型。
4. CD31的功能
CD-31 通常位于血管内皮细胞、血小板、巨噬细胞和kuffer细胞、粒细胞、T/NK细胞、淋巴细胞、巨核细胞、破骨细胞、嗜中性粒细胞。在某些肿瘤也发现CD31的表达,如上皮样血管内皮瘤、上皮样肉瘤样血管内皮瘤、其他血管肿瘤、组织细胞性恶性肿瘤和浆细胞。在循环血小板和白细胞中,CD31主要是通过调节其胞内结构域磷酸化顺序而限制细胞活化反应,通常是作为抑制性受体起作用。 另外,D31也在内皮细胞细胞间连接处高度表达,作为机械传感器,白细胞运输的调节剂和维持内皮细胞连接完整性起作用。
与CD31相关的大多数活性可归因于嗜同性CD31-CD31相互作用。其中包括白细胞外渗、骨髓造血和血管发育。CD31可以促进各种白细胞相关整联蛋白与ICAM/VCAM IgSF成员的结合,并帮助外周血白细胞穿过内皮屏障。促进CAM-IgSF结合是由于白细胞CD31-内皮细胞CD31参与后,β1和β2整联蛋白活性的普遍上调引起的。
5. CD31信号传导
如2.2部分所述,胞内结构域中存在许多丝氨酸、苏氨酸和酪氨酸残基。CD31介导的信号传导通常是由702位丝氨酸的磷酸化引发,然后与质膜结合释放ITIM的686位酪氨酸,进而磷酸化Src-家族激酶Lyn。此外,ITIM的663位酪氨酸会继续发生顺序磷酸化。一旦ITIM的663位酪氨酸完成磷酸化,CD31会募集Src同源性2结构域蛋白,比如酪氨酸磷酸酶SHP-2。
2010年,Federica M. Marelli-Berg团队的一项研究揭示了T细胞中CD31作用机制。在初始T细胞中,细胞表面CD31表达下调与稳态增殖有关,当胸腺流出减少时,CD31负责维持T细胞库中T细胞含量的稳定。而在记忆T细胞中,CD31调节记忆T细胞的流量,但不影响它们的激活[7]。
CD31最显着的特征是在其细胞质结构域中存在两个ITIM。这些ITIM在TCR活性后磷酸化,随后募集蛋白酪氨酸磷酸酶(PTP),例如Src同源性2(SH2),抑制TCR信号传导。如图2所示[8]:
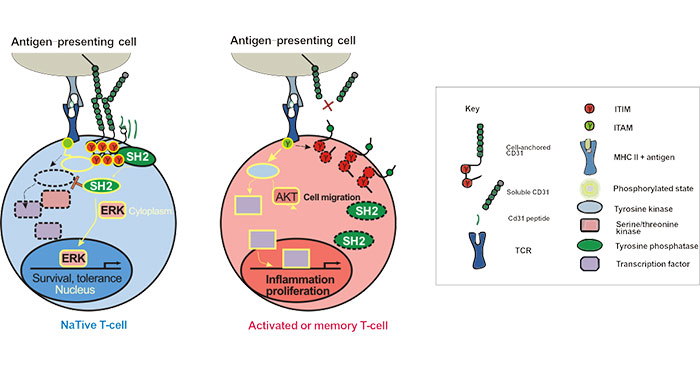
图2 CD31 Signaling Pathways in T-lymphocytes
6. CD31相关疾病
CD31可在所有白细胞中表达,包括T细胞、B细胞和树突细胞。CD31复杂的生物学功能主要源于其在免疫和血管系统中粘附和信号传导功能的整合。CD31的异常表达可引发多种疾病,例如动脉粥样硬化、炎症和血液病等。
6.1、CD31与动脉粥样硬化
在动脉粥样硬化的过程中,CD31的作用主要表现在对冠状斑块稳定性的影响。在心肌梗塞(MI)病人中,血小板CD31复合物浓度是升高的,而在动物模型中梗死区抗CD31抗体的浓度是下降的[9]。在延迟或失败的溶栓病人中血小板CD31复合物表达是增高的。另外,有研究证实过氧化物酶有抗血管氧化的作用,而CD31则影响酶与内皮的接触,从而起到机械性控制粥样硬化的进程。所以推测CD31基因变异在冠心病的进展中有深远的影响。此外,研究发现心绞痛,急性心肌梗死,心源性休克,猝死等均好发于清晨6时到12时这段时间。这与CD31的水平在夜晚和清晨达高峰有一定时间上的吻合性[10]。
6.2 CD31与炎症
大量研究数据表明,在急性腹膜炎、急性肺损伤、心肌缺血再灌注损伤和皮肤炎症模型中,CD31抗体可阻断中性粒细胞和单核细胞的募集。Steren等人报道称,在抗CD31抗体处理的鼠肠系膜静脉中,白细胞位于血管腔面,但不能外渗。其中一些研究也存在分歧,Gza.Rlek等发现,在鼠的急性胰腺炎模型中,大部分粘附、活化和迁移的白细胞都伴有氧自由基的释放,而Murat.Turegun等研究发现,在猎的心肌缺血再滔注损伤模型中.抗CD31抗体不能显著抑制中性粒细胞释放氧自由基[11]。
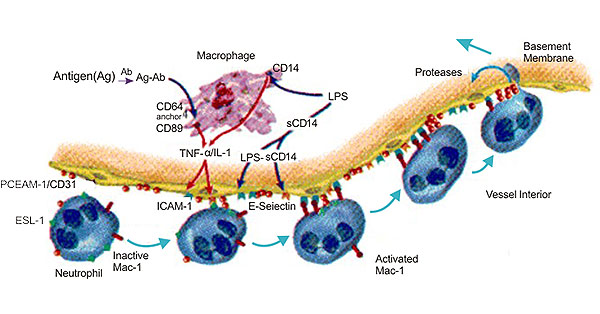
图3 The Diagram of CD31 and Inflammation
在炎症反应中,白细胞与内皮细胞之间的相互作用是关键环节,它使得白细胞进入炎症部位并引起组织损伤。CD31特异地定位于血管内皮细胞腔面侧的浆膜,参与不同类型白细胞外渗的最后步骤。因此CD31在炎症微循环损伤中有重要作用,但作用机制尚未弄清楚,还需进一步研究[12] [13]。
6.3 CD31与血液疾病
Karen Ballen[14]等人发现,在再生障碍贫血患者外周血及骨髓中,再障组骨髓及外周血单个核细胞CD31、CD44抗原水平明显低于正常对照组。而且相关分析发现,骨髓、外周血单个核细胞CD31、CD44水平与外周血白细胞数、血红蛋白、血小板,骨髓中粒系比例、红系比例、巨核细胞均呈正相关。这些数据表明粘附分子表达异常可能在再障发病中起一定作用。
根据Gordon等[15]的研究可推测,细胞粘附分子能够提示瞄定位点,从而使初始造血细胞粘附到骨髓基质,并提供调节信号,从而使初始造血细胞从骨髓释放前进一步分化。认为再障三系减少与粘附分子表达缺陷密切相关,是再障造血衰竭的重要因素之一。但其确切作用机制仍需要进一步的探讨。
Reference:
[1] 10hto, H., Maeda, H., et al. Blood. 1985, 66,873-88.
[2] AIbelda, S.M., Oliver, P.D., et al. J. Cell Biol. 1990, 110, 1227-1237.
[3] Horace M. DeLisser, Peter J. Newman, et al. Molecular and functional aspects of PECAM-I/CD31 [J]. Immunology Today. 1994, 15(10):490-495.
[4] Paddock C, Zhou D, et al. Structural basis for PECAM-1 homophilic binding [J]. Blood. 2016, 127:1052–1061.
[5] Paddock C, Lytle BL, et al. Residues within a lipid-associated segment of the PECAM-1 cytoplasmic domain are susceptible to inducible, sequential phosphorylation [J]. Blood. 2011, 117:6012–6023.
[6] Panida Lertkiatmongkol, Danying Liao, et al. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31) [J]. Vascular biology. 2016, 23(3):253-259.
[7] Manes, T. D., Hoer, S., et al. Kaposis sarcoma-associated herpesvirus K3 and K5 proteins block distinct steps in transendothelial migration of effector memory CD4+ T cells by targeting different endothelial proteins [J]. J. Immunol. 2010, 184, 5186–5192.
[8] Federica M. Marelli-Berg, Marc Clement, et al. An immunologists guide to CD31 function in T-cells [J]. Journal of Cell Science. 2013, 126: 2343-2352.
[9] Nounhargh S.Krombach F, et al. The role of JAM-A and PECAM?l in modulating leukocyte infiltration in inflamed and ischemic tissues [J]. J Lonkoc Biol. 2006, 80(4):714—718.
[10] Kalinowska A,Losy J.PECAM-1,a key player in neuro-inflammation[J]. Eur J Neurol. 2006, 13(12):1284-1290.
[11] Dangerfiled J, Larbi KY, et al. PECAM-1(CD31) hemophilic interaction up-regulated α6β1 on transmigrated neutrophils in vivo and play a functional role in the ability of α6 integrins to mediate leukocyte migration through the perivascular basement membrane [J]. J Exp Med. 2002, 196(9): 1201-1211.
[12] Ostermann G, Weber KSC, et al. JAM-1 is a ligand of the β2 intergrin LFA-1 involved in transendothelial migration of leukocytes [J]. Nature Immunol. 2002, 3(2):151-158.
[13] Schenkel AR, Mamdouh Z, et al. CD99 plays a major role in the migration of monocytes through endothelial junctions [J]. Nature Immunol. 2002, 3(2):143-150.
[14] Karon Ballen, Pamela S, et al.Effect of ex vivo cytokine treatment on human cord blood engraftment in NODseid mice[J].Br J Haematol. 2001, 108(3):629-640.
[15] Gordon MY, Clark D, et al. Hemopoietic progenitor cell binging to the stromal microenvironment in vitro [J]. Exp Hematol. 1990, 18(7):837.
上一篇: 资源|七大模式生物数据库
下一篇: 生长激素-不仅仅促进长高














