CXCR4:G蛋白耦联受体(GPCR)家族,再出肿瘤免疫治疗新药!
日期:2022-02-28 10:17:51
2022年1月18日,趋化因子受体CXCR4拮抗剂Motixafortide,进行了新药上市申请前(pre-NDA)会议,药物开发公司BioLineRx表示,计划今年上半年递交NDA。目前,CXCR4拮抗剂已有多款在研,按研究进度,Motixafortide有望率先获批,成为继普乐沙福(Plerixafor)之后获批的第二款CXCR4拮抗剂,用于乳腺癌治疗。
人体中,不同趋化因子受体-配体轴的相互作用构成了复杂的趋化因子调控网络,对自身免疫和癌症等疾病方面有着重要影响。近年来,随着对趋化因子受体结构和机制的深入理解,更多趋化因子受体相关抗体类药物也步入临床。CXCR4作为具有代表性的G蛋白耦联受体(GPCR)一员,在介导肿瘤定向迁移、侵袭和转移中发挥着重要的作用,多项CXCR4开发药物在临床治疗中表现出巨大的潜力,这些药物将为肿瘤免疫治疗开辟一条新的途径。
什么是CXCR4?
趋化因子受体(C X C chemokine receptor 4,CXCR4)是一个具有7次跨膜结构的G蛋白耦联受体(G Protein-Coupled Receptor,GPCR),由352个氨基酸组成,其编码基因位于染色体2q21 [1-2]。CXCR4作为GPCR家族中的一员,GPCR的超家族群已经被证明是许多药物的药理作用靶点(点击查看GPCR抗体药物研究进展大盘点)。CXCR4在体内大部分组织和器官上都有表达,包括骨髓、脐血和动员的外周血来源的细胞表面,以及多种非造血干细胞表面表达。近年来研究发现,肿瘤细胞转移到特定器官是不同器官通过趋化作用吸引特定类型肿瘤细胞归巢的结果。在众多的趋化因子受体中,CXCR4在许多肿瘤中都存在表达增强。目前的研究表明,与趋化因子受体CXCR4相关的癌症超过23种,它还能促进血管生成,细胞的转移、生长或生存 [3]。此外,还参与HIV病毒感染 [4]。这些生物学功能决定了CXCR4靶向药可用于肿瘤、造血干细胞动员、HIV等疾病的治疗。
CXCR4的配体
趋化因子CXCL12(又称SDF-1,基质细胞衍生因子1)是CXCR4的唯一配体,属于CXC趋化因子家族成员,分子量约为8 kD。CXCL12包含α和β两个异构体,由骨髓基质细胞及其他相关的间皮细胞和上皮细胞分泌 [5]。CXCR4作为CXCL12行使功能的唯一跨膜受体,组成的CXCR4/CXCL12轴参与诸多生物学过程,包括①肿瘤的转移、增殖、黏附以及血管新生多种机制;②介导造血干细胞的动员与归巢,与趋化干细胞靶向受损组织、扩大旁分泌和促进血管新生有关;③调节成熟B细胞、浆细胞、中性粒细胞、单核细胞、T细胞和树突状细胞的运动,与机体的免疫功能有着密切的关系 [3, 6]。因此,CXCR4通过结合CXCL12,在介导免疫及炎症反应、调控造血、诱导血管生成、肿瘤侵袭转移等多种生理和病理过程中发挥重要作用。
CXCR4的调节机制
CXCR4与其配体CXCL12特异性结合,可激活下游一系列细胞内信号转导通路和效应分子,进而调节细胞存活、增殖、迁移和粘附等生物学行为。如图1,在肿瘤中,CXCR4-CXCL12参与激活多种促癌调节机制,从而促进肿瘤增殖、抑制癌细胞凋亡、促进转移,包括RAS-MAPK-MEK1/2 [7]、ERK1/2 [8]、PI3K-AKT [9]和NF-kB [10]等信号通路。
以PI3K-AKT为例子,有研究发现,在胃癌细胞中,CXCL12-CXCR4生物轴激活PI3K/Akt途径得以促进肿瘤细胞的生长、浸润及转移,其机制具体如下:高表达的CXCL12-CXCR4轴可使PI3Kγ活化,通过与磷脂酰肌醇3-激酶γ(phos-photidylionsitol 3-kinasseγ,PI3Kγ)的调节亚基相结合,进而激活 PI3Kγ的下游的信号分子,如核因子κB(nuclear factor κB,NF-κB)、蛋白激酶 B(protein kinase B,PKB),细胞外调节蛋白激酶1/2(extracellular regulated protein kinase1/2,ERK1/2)和有丝分裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)等的表达 [11, 12]。
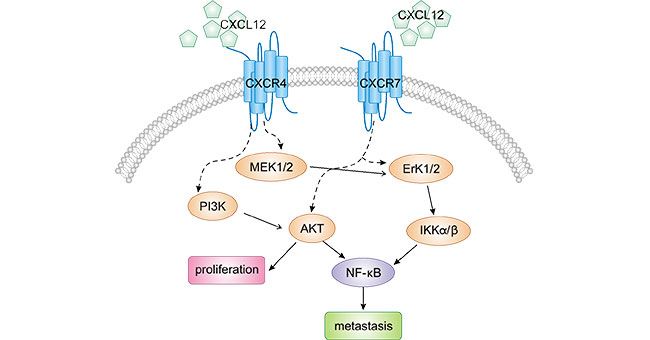
图1. CXCR4/CXCL12在肿瘤细胞中的信号通路
CXCR4在肿瘤等疾病中的作用
CXCR4作为肿瘤细胞表达最为普遍的趋化因子受体,与多种肿瘤的发展和转移有关,包括乳腺癌 [13]、卵巢癌 [14]、肺癌 [15]、结肠直肠癌 [16]、原发性脑肿瘤(如胶质瘤)[17]、胰腺癌 [18]、前列腺癌 [19]、多发性骨髓瘤(MM) [20]、急性髓系白血病(AML) [21]、慢性淋巴细胞白血病(CLL) [22]、非霍奇金淋巴瘤(NHL) [23]等等。
在血液肿瘤方面,CXCR4与多种血液肿瘤疾病具有无可争议的临床相关性。首个CXCR4拮抗剂普乐沙福(Plerixafor)于2008年在欧美获批,2018年引进国内。目前,Plerixafor可联合G-CSF用于接受自体造血干细胞移植(ASCT)的NHL和MM患者造血干细胞动员。多项CXCR4靶向抑制剂也正在展开研究,一种抗CXCR4抗体ulocuplumab(BMS-936564)的Ib/II期试验(NCT01359657)证实,阻断CXCR4-CXCL12与来那度胺和地塞米松联合治疗复发性或难治性骨髓瘤患者,具有较高的应答率。此外,人源化CXCR4抗体PF-06747143在包括NHL、AML和MM在内的多种血液肿瘤模型中显示出强烈的抗肿瘤作用。
在实体瘤方面,CXCR4抑制剂也被证明具有重要的抗癌潜力。有几项临床试验正在评估CXCR4抑制剂对胶质瘤患者的临床益处。另外,一项I/II期试验(NCT01977677)研究表明,普乐沙福Plerixafor抑制CXCL4介导的血管生成,增强了放射治疗的效果;一种CXCR4肽拮抗剂(LY2510924)在各种实体瘤和转移性乳腺癌临床前模型中显示出抗肿瘤活性。
CXCR4不仅在肿瘤中扮演关键角色,还与一些免疫疾病(比如,系统性红斑狼疮 [24]、风湿性相关疾病 [25]等等),遗传性疾病WHIM综合征 [26],以及病毒疾病HIV [27]有密切关系。另有报道指出,CXCR4在胚胎发育过程中,介导受损视神经的轴突再生,或为视觉治疗提供新策略 [28]。因此,靶向CXCR4将为多种疾病的药物开发带来新办法,尤其在血液肿瘤以及实体瘤的免疫治疗方面。
CXCR4的临床应用前景
目前,以CXCR4为靶向的研究正在进行中或已经相当成熟。除了FDA批准的CXCR4抑制剂Plerixafor,普乐沙福,用于血液恶性肿瘤。近年来,伴随着对CXCR4功能机制的进一步认识,已经探索出了多种CXCR4靶向抑制剂(如下表),例如,国内已获批临床的Motixafortide,目前处于临床III期,用于治疗局部晚期或转移性三阴性乳腺癌;同样处于临床III期阶段的Mavorixafor,作用造血干细胞动员用于多发性骨髓瘤患者自体骨髓移植,计划于今年上半年递交NDA,有望成为全球第二款CXCR4靶向药。相信很快,针对CXCR4受体的治疗方法,将为癌症等多种疾病的疗法提供新的突破。
| 药物名称 | 最高研发状态 | 公司 | 作用机制 | 治疗领域/适应症 |
|---|---|---|---|---|
| Plerixafor(普乐沙福) | 2008年,FDA批准上市 2018年,NMPA批准上市 |
美国健赞公司;Genzyme Europe Bv;Magenta Therapeutics Inc;赛诺菲 | CXCR4拮抗剂 | 多发性骨髓瘤;非霍奇金淋巴瘤;造血干细胞移植;淋巴瘤;骨髓增生异常综合征急性淋巴细胞白血病急性髓细胞样白血病;霍奇金病慢性淋巴细胞白血病;慢性髓细胞白血病;脑停;神经母细胞瘤;尤因肉瘤:器官移植排斥;胃脏疾病 |
| Mavorixafor | 临床三期 | 上海和置生物医药科技有限公:Abbisko Therapeutics CoLtd;Mayne Pharma Inc;X4 Pharmaceuticals | CXCR4拮抗剂 | WHIM综合征;三阴性乳腺肿瘤:肾细胞癌;中性粒细胞减少;华氏巨球蛋白血症黑色素瘤;HIV感染 |
| Balixafortide | 临床三期 | Polyphor Ltd | CXCR4拮抗剂 | 乳腺德;多发性骨髓瘤;骨髓增生性疾病;骨髓增生异常综合征;急性淋巴细胞白血病;急性髓细胞样白血病;慢性淋巴细胞白血病;慢性随细胞白血病 |
| NRP-2945 | 临床二期 | Neuren Pharmaceuticals | CXCR4调节剂 | 癫痫 |
| [68Ga]Pentixafor | 临床二期 | PentixaPharm GmbH;The University Of lowa | CXCR4拮抗剂 | 中枢神经系统肿瘤;神经内分泌瘤:诊断剂 |
| PTX-9908 | 临床二期 | 北京迈康斯德医药技术有限公司;Pertinax Therapeutics;泰宗生物科技股份有限公司 | CXCR4调节剂 | 肝癌;肝细胞癌 |
| MSX-122 | 临床二期 | Altiris Therapeutics:Que Oncology | CXCR4拮抗剂 | 血管舒缩症;热潮红:实体 |
| Ulocuplumab | 临床二期 | 百时美施贵宝 | CXCR4拮抗剂 | 小细胞肺癌;胰腺癌;多发性骨瘤;急性髓细胞样白血病:白血病实体瘤;淋巴细胞白血病;滤泡中心淋巴宿:慢性淋巴细胞白血病 |
| Motixafortide | 临床二期 | Biolinerx Ltd;F.Hoffmann-La Roche Ag | CXCR4拮抗剂 | 非小细胞肺癌;食道癌:胰腺癌;骨随增生异常综合征:再生障碍性贫血;急性细胞样白血病;多发性骨随瘤 |
| JVS-100 | 临床二期 | Cleveland Clinic;Juventas Therapeutics;Sironrx Therapeutics | 白细胞刺激剂;CXCR4刺激剂;基因转移;细胞凋亡抑制剂;血管生成诱导剂 | 缺血;外周动脉疾病;心脏衰竭 |
| LY-2510924 | 临床二期 | 礼来制药 | CXCR4拮抗剂 | 肾细胞癌小细胞肺癌;实体瘤 |
| AD-214 | 临床一期 | AdaltaLtd;Addpharma Inc | CXCR4拮抗剂 | 间质性肺疾病;胃食管反流病 |
| CXCR4 modified anti-BCMA CAR T celltherapy (SichuanUniversity) | 临床一期 | 四川大学 | Anti-BCMA(抗BCMA) | 多发性骨髓瘤 |
| Anti-CD4CART-celltherapy (University ofPennsylvania) | 临床一期 | 宾夕法尼亚大学 | CD4调节剂 | HIV感染 |
| GMI-1359 | 临床一期 | Glycomimetics Inc | CXCR4拮抗剂 | 乳腺癌;转移性乳腺癌 |
| MLB-1707 | 临床申请 | 主流源生物科技(上海)有限公司 | CXCR4抗剂 | 三阴性乳腺肿瘤 |
| MLB-010 | 临床前 | 主流源生物科技(上海)有限公司 | CXCR4拮抗剂 | 肿瘤 |
| MLB-014 | 临床前 | 主流源生物科技(上海)有限公司 | CXCR4拮抗剂 | 白血病 |
| MLB-1807 | 临床前 | 主流源生物科技(上海)有限公司 | CXCR4拮抗剂 | 肿瘤 |
| X4P-002 | 临床前 | X4 Pharmaceuticals | CXCR4拮抗剂 | 胶质母细胞瘤 |
| GP-01CR11 | 临床前 | GPCR Therapeutics USA Inc | CXCR4拮抗剂 | 肿瘤 |
| GP-01CR21 | 临床前 | GPCR Therapeutics USA Inc | CXCR4拮抗剂 | 肿瘤 |
数据来自:药渡
为鼎力协助各药企针对CXCR4在肿瘤、造血干细胞动员、HIV、自身免疫性等疾病在临床中的研究,CUSABIO推出CXCR4活性蛋白产品(Code: CSB-MP006254HU(F1),助力您在CXCR4机制方面的研究或其潜在临床价值的探索。
● Recombinant Human C-X-C chemokine receptor type 4 (CXCR4)-VLPs (Active)
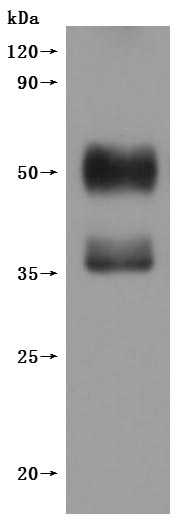
CSB-MP006254HU(F1) is detected by Mouse anti-6*His monoclonal antibody.
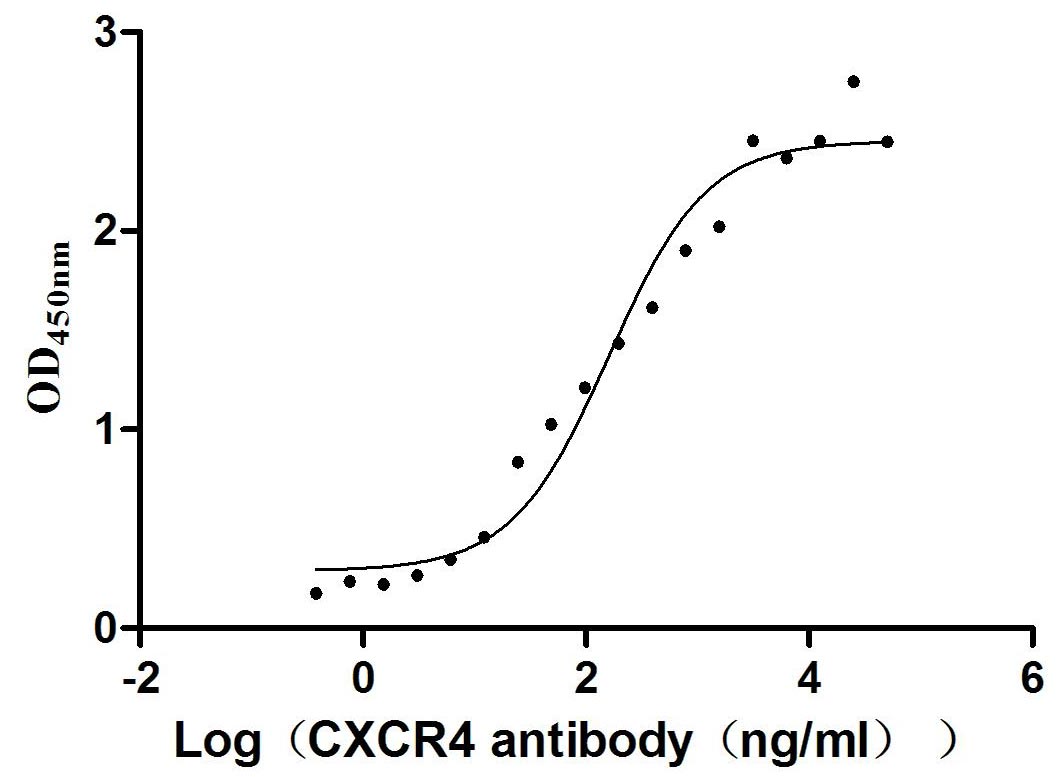
Immobilized Human CXCR4 at 10 μg/ml can bind Anti-CXCR4 recombinant antibody (CSB-RA006254MA01HU), the EC50 is 101.7-253.6 ng/mL.
参考文献:
[1] Wescott, Melanie P., et al. "Signal transmission through the CXC chemokine receptor 4 (CXCR4) transmembrane helices." Proceedings of the National Academy of Sciences 113.35 (2016): 9928-9933.
[2] Van den Bosch, Thierry, et al. "Chemokine receptor CCR7 expression predicts poor outcome in uveal melanoma and relates to liver metastasis whereas expression of CXCR4 is not of clinical relevance." Investigative ophthalmology & visual science 54.12 (2013): 7354-7361.
[3] Chatterjee, Samit, Babak Behnam Azad, and Sridhar Nimmagadda. "The intricate role of CXCR4 in cancer. "Advances in cancer research 124 (2014): 31-82.
[4] Hernandez, Paolo A., et al. "Mutations in the chemokine receptor gene CXCR4 are associated with WHIM syndrome, a combined immunodeficiency disease." Nature genetics 34.1 (2003): 70-74.
[5] De Paepe, Boel, et al. "Localization of the α-chemokine SDF-1 and its receptor CXCR4 in idiopathic inflammatory myopathies. "Neuromuscular disorders 14.4 (2004): 265-273.
[6] Asri, Amir, et al. "Homing in hematopoietic stem cells: focus on regulatory role of CXCR7 on SDF1a/CXCR4 axis." Excli Journal 15 (2016): 134.
[7] Dushyanthen, Sathana, et al. "Agonist immunotherapy restores T cell function following MEK inhibition improving efficacy in breast cancer." nature communications 8.1 (2017): 1-18.
[8] Chetram, Mahandranauth A., Valerie Odero-Marah, and Cimona V. Hinton. "Loss of PTEN permits CXCR4-mediated tumorigenesis through ERK1/2 in prostate cancer cells." Molecular cancer research 9.1 (2011): 90-102.
[9] Zheng, Hao, et al. "Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1α/CXCR4 via PI3K/Akt/eNOS signal transduction pathway." Journal of cardiovascular pharmacology 50.3 (2007): 274-280.
[10] Cheng, Y., et al. (2020). Positive Cross-Talk Between CXC Chemokine Receptor 4 (CXCR4) and Epidermal Growth Factor Receptor (EGFR) Promotes Gastric Cancer Metastasis via the Medical science monitor: international medical journal of experimental and clinical research, 26, e925019.
[11] Chen, Guang et al. "Inhibition of chemokine (CXC motif) ligand 12/chemokine (CXC motif) receptor 4 axis (CXCL12/CXCR4)-mediated cell migration by targeting mammalian target of rapamycin (mTOR) pathway in human gastric carcinoma cells." The Journal of biological chemistry vol. 287,15 (2012): 12132-41. doi:10.1074/jbc.M111.302299
[12] Qin, Yan et al. "Cancer-associated fibroblasts in gastric cancer affect malignant progression via the CXCL12-CXCR4 axis." Journal of Cancer vol. 12,10 3011-3023. 19 Mar. 2021, doi:10.7150/jca.49707
[13] Chen, Ivy X et al. "Blocking CXCR4 alleviates desmoplasia, increases T-lymphocyte infiltration, and improves immunotherapy in metastatic breast cancer." Proceedings of the National Academy of Sciences of the United States of America vol. 116,10 (2019): 4558-4566. doi:10.1073/pnas.1815515116
[14] Zeng, Yang et al. "Dual blockade of CXCL12-CXCR4 and PD-1-PD-L1 pathways prolongs survival of ovarian tumor-bearing mice by prevention of immunosuppression in the tumor microenvironment." FASEB journal : official publication of the Federation of American Societies for Experimental Biology vol. 33,5 (2019): 6596-6608. doi:10.1096/fj.201802067RR
[15] Wald, Ori. "CXCR4 Based Therapeutics for Non-Small Cell Lung Cancer (NSCLC)." Journal of clinical medicine vol. 7,10 303. 25 Sep. 2018, doi:10.3390/jcm7100303
[16] Wang, Dong et al. "Exosome-encapsulated miRNAs contribute to CXCL12/CXCR4-induced liver metastasis of colorectal cancer by enhancing M2 polarization of macrophages." Cancer letters vol. 474 (2020): 36-52. doi:10.1016/j.canlet.2020.01.005
[17] Jiang, Zheng et al. "Contribution of SDF-1α/CXCR4 signaling to brain development and glioma progression." Neuro-Signals vol. 21,3-4 (2013): 240-58. doi:10.1159/000339091
[18] Bockorny, Bruno et al. "BL-8040, a CXCR4 antagonist, in combination with pembrolizumab and chemotherapy for pancreatic cancer: the COMBAT trial." Nature medicine vol. 26,6 (2020): 878-885. doi:10.1038/s41591-020-0880-x
[19] Baci, Denisa et al. "Acetyl-L-Carnitine downregulates invasion (CXCR4/CXCL12, MMP-9) and angiogenesis (VEGF, CXCL8) pathways in prostate cancer cells: rationale for prevention and interception strategies." Journal of experimental & clinical cancer research : CR vol. 38,1 464. 12 Nov. 2019, doi:10.1186/s13046-019-1461-z
[20] Ullah, Tomalika Rahmat. "The role of CXCR4 in multiple myeloma: Cells' journey from bone marrow to beyond. "Journal of bone oncology vol. 17 100253. 16 Jul. 2019, doi:10.1016/j.jbo.2019.100253
[21] Cancilla, Daniel et al. "Targeting CXCR4 in AML and ALL." Frontiers in oncology vol. 10 1672. 4 Sep. 2020, doi:10.3389/ fonc.2020.01672
[22] El-Sherif, Wafaa T et al. "CXCR4 as a prognostic marker in Egyptian chronic lymphocytic leukemia patients." the Egyptian journal of immunology vol. 28,3 (2021): 114-126.
[23] Beider, Katia et al. "Targeting the CD20 and CXCR4 pathways in non-hodgkin lymphoma with rituximab and high-affinity CXCR4 antagonist BKT140." Clinical cancer research : an official journal of the American Association for Cancer Research vol. 19,13 (2013): 3495-507. doi: 10.1158/1078-0432.ccr-12-3015
[24] Ma, Kongyang et al. "TLR4+CXCR4+ plasma cells drive nephritis development in systemic lupus erythematosus." Annals of the rheumatic diseases vol. 77,10 (2018): 1498-1506. doi:10.1136/annrheumdis-2018-213615
[25] Peng, Liping et al. "Expression levels of CXCR4 and CXCL12 in patients with rheumatoid arthritis and its correlation with disease activity ." Experimental and therapeutic medicine vol. 20,3 (2020): 1925-1934. doi:10.3892/etm.2020.8950
[26] Kallikourdis, Marinos et al. "The CXCR4 mutations in WHIM syndrome impair the stability of the T-cell immunologic synapse." Blood vol. 122,5 (2013): 666-73. doi:10.1182/blood-2012-10-461830
[27] Zhang, Chaozai et al. "Discoveries and developments of CXCR4-targeted HIV-1 entry inhibitors." experimental biology and medicine (Maywood, N.J.) vol. 245,5 (2020): 477-485. doi:10.1177/1535370220901498
[28] Zanetti, Giulia et al. "A CXCR4 receptor agonist strongly stimulates axonal regeneration after damage." annals of clinical and translational neurology vol. 6,12 (2019): 2395-2402. doi:10.1002/acn3.50926











