ACE2—新型冠状病毒入侵人体的靶标
日期:2020-03-06 18:15:27
2019年底新型冠状病毒(SARS-CoV-2,前称:2019-nCoV)首次现身武汉,引发的肺炎(COVID-19)在春节之际,以迅雷不及掩耳的态势席卷全国,一时之间,风声鹤唳,全城戒备。随着关于SARS-CoV-2研究的深入展开,新型冠状病毒入侵人体的途径也逐渐明了,首先揭露的便是ACE2,新型冠状病毒入侵人体门户的靶标。其实,ACE2与细胞因子风暴一样,并不是第一次以这种形式为人们所熟知。17年前引发非典型肺炎的SARS-CoV也是通过肺泡细胞表面的ACE2受体入侵人类细胞的。那ACE2究竟是个啥?咋就如此受冠状病毒的青睐呢?来来来,紧跟小编的脚步,我们一起来了解下~
1. 什么是ACE2?
血管紧张素转化酶2(ACE2),也称为ACEH,在2000年作为第一个被报道的ACE同源物开始为世人所知。该基因编码的蛋白属于二肽基羧基二肽酶的血管紧张素转换酶家族。ACE2与ACE均属于肾素-血管紧张素-醛固酮系统(RAAS)和激肽-缓激肽系统(KKS)家族。ACE2是一种金属蛋白酶,全长805个氨基酸,是具有单一胞外催化结构域的I型跨膜糖蛋白。人类ACE2基因已经被克隆并被定位到X染色体上。
像ACE一样,ACE2有两个结构域:氨基末端催化结构域和羧基末端结构域。催化结构域有一个活性位点--锌金属肽酶结构域(HEXH基序)--并且与ACE的氨基结构域显示出41.8%的序列一致性(Figure 1)。ACE2的羧基末端结构域与Collectrin有48%的序列一致性,Collectrin是一种非催化蛋白,最近被证明在肾脏的氨基酸再吸收、胰腺β细胞增殖,以及可能胰岛素胞吐等方面具有关键作用。
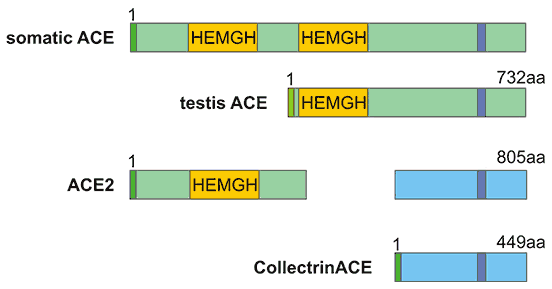
Figure 1. The structure comparison of ACE and ACE2
2. ACE2的主要功能是什么?
早期研究观察到ACE2主要在心脏、肾脏和睾丸中定位,在其他多种组织中低水平表达,尤其是结肠和肺,而后来的研究也表明ACE2在肝脏和肠等其他器官中也具有重要作用。ACE和ACE2都属于金属蛋白酶的M2家族,其活性位点域暴露于细胞外表面,促进循环肽的代谢。ACE和ACE2都通过利用锌催化反应,锌与活性位点内保守的组氨酸配位,促进水分子对底物羰基键的亲核攻击,形成非共价结合的中间体。
尽管有相似之处,ACE2和ACE的作用不一样,并不是激活肾素-血管紧张素系统(RAS),反而是这个系统刹车。当血管紧张素I(Ang I)由ACE转化成强效血管紧张素II(Ang II)时,ACE2可裂解Ang I,产生无活性的血管紧张素1-9(Ang 1-9),后者可通过ACE转化为血管紧张素1-7(Ang 1-7)。另一方面,ACE2可将AngⅡ水解成Ang(1-7),水解AngII的效率大于其水解AngI的效率的400倍,说明ACE2主要通过水解AngⅡ这一途径生成Ang 1-7。Ang 1-7通过作用于Mas受体,起到舒张血管、抗炎、抗增生、抗纤维化、抗肺泡上皮细胞凋亡和抗氧化应激的心血管保护作用,达到拮抗AngⅡ的生物学作用(Figure 2)。在生物体内,ACE/AngⅡ/AT1R轴和ACE2/Ang 1-7/MAS轴相互制衡,既弥补不足,又防止矫枉过正。
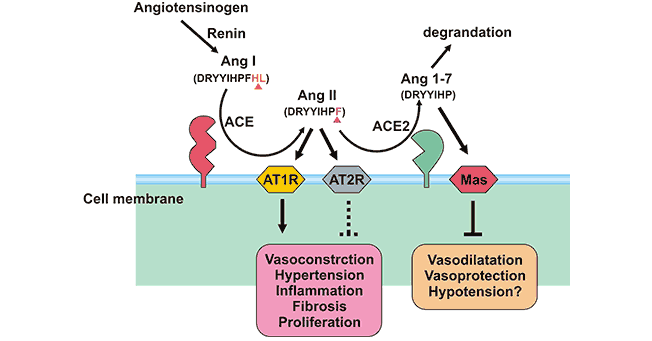
Figure 2. The role of ACE2 and ACE
ACE2与Ang II的1型和2型受体有很强的亲和力,调节血压、体液平衡、炎症、细胞增殖、肥大和纤维化。同时该基因的器官和细胞的特异性表达提示其可能在调节心血管和肾脏功能以及生育方面发挥作用。
3. ACE2的主要分布在哪?
ACE2组织分布具有器官特异性,主要表达于肾脏、心血管及胃肠道系统,在正常肺组织中,Ⅰ型及Ⅱ型肺泡上皮细胞中均存在ACE2。相关研究表明,SARS-CoV-2和SARS-CoV都是通过人体细胞表面的ACE2受体进入人体细胞,所以原则上来说,表达ACE2的组织会被新冠病毒侵入,不表达ACE2的组织新冠病毒无法侵入。这也为COVID-19的主要传播途径与预防手段奠定了理论基础。
比如眼睛,ACE2通常定位于上皮细胞的腔面。这意味着SARS-CoV-2通过眼球表面侵染人体的可能性非常低,但是眼睛不是只有一个眼球,还有上眼皮和下眼皮的黏膜,所以勤洗手和不用手揉眼睛还是非常重要的新冠病毒预防环节。
另外,肺泡上皮细胞和小肠上皮细胞的ACE2蛋白表达水平很高,这就能解释为什么新冠病毒是下呼吸道疾病但有些病人出现腹泻的症状。鼻腔和口腔黏膜也有ACE2受体的表达,这说明戴口罩非常必要。但是脾脏,胸腺,淋巴结,骨髓,免疫细胞都是ACE2阴性。COVID-19对人体的最大伤害,还是急性肺部损伤。
4. SARS-CoV-2是怎样通过ACE2入侵人体的?
ACE2不仅在心血管系统中发挥了重要的功能,而且作为SARS-CoV-2入胞的受体在肺部疾病中发挥了一定作用。那SARS-CoV-2到底是怎样通过ACE2入侵人体的呢?最近研究已经进一步证实:对于SARS-CoV-2而言,刺突蛋白(S蛋白)是介导病毒入侵宿主细胞的关键蛋白。SARS-CoV-2是通过S蛋白与ACE2结合入侵肺部细胞。ACE2与新冠病毒的RBD(受体结合结构域)之间的亲和力,比其与SARS病毒的RBD的亲和力高10到20倍。新冠病毒S蛋白以三聚体形态存在,每一个单体中约有1300多个氨基酸,其中300多个氨基酸构成了“受体结合结构域”(RBD),即S蛋白与ACE2相联结的地方。
病毒进入人体后,主要通过激活免疫系统,通过细胞因子、炎症因子等导致肺损伤。那ACE2在冠状病毒导致肺损伤的病理途径中,到底发挥了怎么样的作用?
结合SARS相关研究(Figure 3),我们发现冠状病毒进入人体后,下调ACE2水平,导致肺内ACE2的水平下降,而ACE未受影响,肺内ACE2和ACE失衡,AngⅡ水平升高,过度激活肺部AT1a受体,导致肺部毛细血管通透性增加,随之出现肺水肿,诱发干咳,同时加重炎症反应和细胞凋亡,加速肺损伤。同时ACE2水平降低导致Des-Arg缓激肽-BK1受体途径激活,进一步加重症状,放大肺部炎症与损伤。
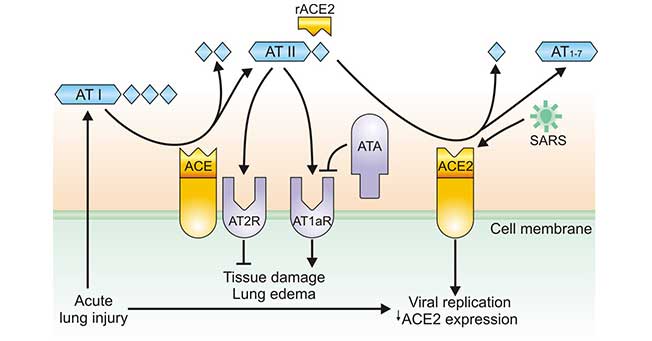
Figure 3. Regulation of ACE and ACE2 during coronavirus-induced lung injury
5. COVID-19治疗策略研究进展
随着ACE2为SARS-CoV-2入侵人体靶点的揭露,阻断病毒和 ACE2 的结合也成为了治疗方向之一。之前在 SARS 的治疗研究中发现,使用可溶性的 ACE2 受体或抗 ACE-2 的抗体,可以用来阻断 SARS-CoV 和该受体的结合,从而达到扰乱病毒感染细胞过程的目的。
● 1月31日,德国莱布尼兹灵长类动物研究所 Markus Hoffmann 等人在 bioRxiv 发表题为《The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells》的文章,证明SARS-CoV-2通过SARS冠状病毒受体ACE2进入人体,而细胞蛋白酶 TMPRSS2 用于SARS-CoV-2 spike(SARS-CoV-2-S)引发。TMPRSS2 抑制剂阻止进入,可作为治疗选择。最后,该研究显示了来自恢复期SARS患者的血清中和了SARS-CoV-2-S的进入。该研究结果揭示了SARS-CoV-2和SARS冠状病毒感染之间的重要共性,提供了抗病毒干预的潜在靶标。
● 2月7日,来自美国Johns Hopkins医院的Robert L. Kruse博士发表了文章《Therapeutic strategies in an outbreak scenario to treat the novel coronavirus originating in Wuhan, China》,作者阐述了相比与ACE2受体结合的阻断剂,利用可溶性ACE2与免疫球蛋白Fc域(ACE2-Fc)融合,既可阻断2019-nCoV的进入,又可以帮助免疫系统建立持久的免疫。此外,ACE2- Fc治疗还可以补充感染期间肺部ACE2水平的降低,从而直接治疗急性呼吸窘迫综合征。
6. 研究冠状病毒,还有其他哪些靶点?
当前,冠状病毒的预防与治疗是科研界与医药界最紧急的研究热点。除了最热门的新型冠状病毒受体ACE2靶点外,还有哪些靶点值得当前冠状病毒研究人员关注呢?我们结合了SARS相关研究,罗列出了以下与冠状病毒研究相关的靶点:
● APN位于细胞膜上,该蛋白参与肽的裂解、病毒感染、内吞作用和细胞信号转导等生物学过程。最近在骆驼和羊驼中发现了类似hCoV-229E的冠状病毒,从蝙蝠到人类的传播可能涉及到这些中间宿主。这些病毒可能以结构保守的方式结合其宿主APN。
● DPP4是在ACE2和APN之后,第三个被发现为冠状病毒受体的外肽酶。DPP4以同源二聚体的形式存在于细胞表面,肽酶的二聚化依赖于水解酶结构域和b螺旋桨叶片IV延伸链之间的分子进行连接。因此,MERS-CoV RBD与DPP4的侧向结合不会破坏DPP4的二聚化。
● AGO4是一种核酸内切酶,可以“切割” RNA,在RNA干扰和短干扰RNA介导的基因沉默中起着不可或缺的作用。AGO4可以结合病毒来源的siRNA(vsiRNA)来介导病毒DNA和TGS的甲基化,从而抑制病毒的转录和复制。
● IFITM3对多种病毒具有抑制活性,有助于增强对甲型H1N1流感病毒、西尼罗河病毒和登革热病毒的免疫力。有研究表明SARS冠状病毒(SARS-CoV)的复制和由SARS-CoV Spike蛋白介导的入侵受到IFITM蛋白的限制。IFITM限制了多种包膜病毒进入宿主,并独立于病毒受体的表达来调节细胞的嗜性。
ACE2蛋白
● Recombinant Human Angiotensin-converting enzyme 2(ACE2),partial (Active) (Code: CSB-MP866317HU)
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
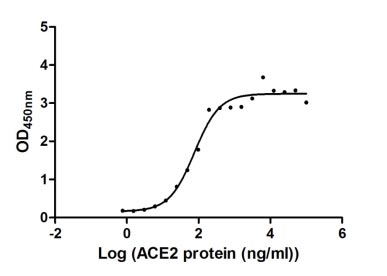
Immobilized SARS-CoV-2-S (CSB-MP3324GMY) at 2 μg/ml can bind human ACE2, the EC50 of SARS-CoV-2-S protein is 56.64 - 103.6 ng/ml.
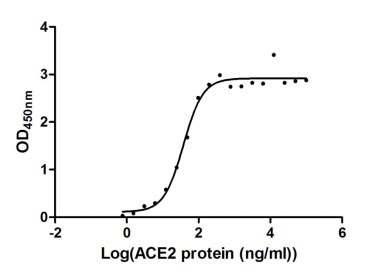
Immobilized SARS-CoV-2-S1-RBD (CSB-YP3324GMY1) at 5 μg/ml can bind human ACE2, the EC50 of human ACE2 protein is 31.80 - 44.69 ng/ml.
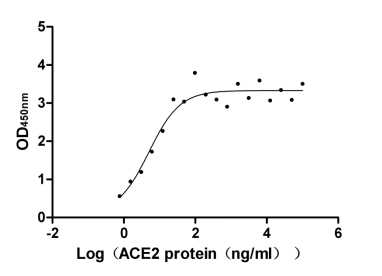
Immobilized SARS-CoV-2-S1-RBD (CSB-MP3324GMY1b1) at 5 μg/ml can bind human ACE2, the EC50 is 2.785-9.139 ng/ml.
References
[1] Xu X, Chen P, et al. Evolution of the novel coronavirus fromthe ongoing Wuhan outbreak and modeling of its spike protein for riskof human transmission[J]. Sci China Life Sci. 2020.
[2] Zhou P, Yang X, et al. A pneumonia outbreak associated with anew coronavirus of probable bat origin[J]. Nature. 2020.
[3] View ORCID ProfileMarkus Hoffmann, Hannah Kleine-Weber, et al. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells [J]. bioRxiv. 2020.
[4] Daniel Wrapp, Nianshuang Wang, et al. Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation [J]. bioRxiv. 2020.
[5] Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung [J]. Nature. 2005, 436(7047): 112-116.
[6] Wenhui Li, Michael J Moore, et al. Angiotensin- converting enzyme 2 is a functional receptor for the sars coronavirus [J]. Nature. 2003, 426(6965):450–4.
上一篇: COVID-19细胞因子风暴
下一篇: 战疫时刻|Th17细胞分化











