白血病
白血病是一种在血液和骨髓中发现的癌症,是体内白血细胞过多导致的一种疾病。白血细胞是强大的感染防御者,它们通常以有序的方式生长和分裂,以满足身体的需求。但在患有白血病的人体内,骨髓产生过多的异常白血细胞,这些细胞无法正常发挥功能(图1)。
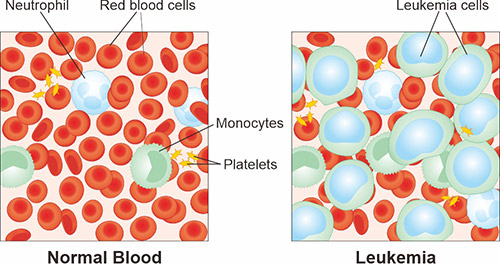
图1. 正常血液和白血病的成分示意图
一般来说,白血病可分为四种类型,包括急性淋巴细胞性白血病(ALL)、急性髓系白血病(AML)、慢性淋巴细胞白血病(CLL)和慢性髓系白血病(CML)。其中,AML是成人中最常见的急性白血病类型。它发生在儿童和成人身上。
增加某些类型白血病风险的因素包括以往的癌症治疗、遗传性疾病、接触某些化学物质、吸烟以及家族中有白血病病史。其中,遗传异常似乎在白血病的发展中起着一定的作用。某些遗传性疾病(如唐氏综合征)与白血病的风险增加有关。
在本文中,我们根据NCG(用于分析癌症基因的重复性、同源性和网络特性的网络资源)提供的信息,列出了与白血病相关的部分蛋白质。
在这里,我们展示了白血病机制中涉及的几个关键靶点,包括:
● NRAS(神经母细胞瘤RAS)是RAS(鼠肉瘤)家族的成员,该家族还包括KRAS(Kirsten RAS)和HRAS(Harvey RAS)。Ras蛋白是低分子量GTP酶家族的一部分,野生型RAS在细胞增殖中起着关键作用[1]。NRAS突变存在于15%至20%的黑色素瘤、10%的急性髓系白血病(AML)和8%至10%的甲状腺癌中[2]。此外,NRAS突变也存在于其他多种造血恶性肿瘤中,包括急性淋巴细胞白血病(ALL)(11%)、多发性骨髓瘤(18%)、骨髓增生异常综合征(MDS)(5%)和慢性髓细胞白血病(CML)(19%)[3][4]。
● DNMT3A(NA(胞嘧啶-5)甲基转移酶3A)是一种酶,它催化甲基基团转移到DNA中特定的CpG结构上,这个过程被称为DNA甲基化。Hsin-An Hou等人进行的研究报告中指出,在500例初发AML患者中,DNMT3A突变在总体患者中检测到14%,在正常核型AML患者中检测到22.9%。DNMT3A突变与年龄较大、白细胞计数和血小板计数较高、中风险和正常细胞遗传学、FLT3内串联重复、NPM1、PTPN11和IDH2突变呈正相关,与CEBPA突变呈负相关 [5]。
● RUNX1(Runt相关转录因子1),也称为急性髓系白血病1蛋白,结合到DNA的特定区域,并帮助控制特定基因的活性。它广泛表达于造血细胞中。大量证据表明RUNX1在调控哺乳动物造血的发育和精确维持中发挥着关键作用 [6]。RUNX1通常被认为是髓系肿瘤的抑癌基因。失活的RUNX1突变在骨髓增生异常综合征(MDS)和细胞遗传学正常的AML患者中频繁被发现 [7]。
● TET2(ten-eleven translocation 2)参与调控转录过程。该蛋白是一个肿瘤抑制因子,其基因突变在髓系恶性肿瘤和其他血液系统疾病中被观察到。在骨髓增生异常综合征、急性髓系白血病(AML)和其他髓系恶性肿瘤中检测到了TET2的突变和缺失 [8][9]。
● FLT3(FMS样酪氨酸激酶3)是一个细胞因子受体,属于酪氨酸激酶III类受体酪氨酸激酶。它在造血干/祖细胞的存活和增殖中发挥着关键作用。约1/3的急性髓系白血病(AML)患者存在FLT3的突变,可能是通过近膜域内串联重复(ITD)或点突变(通常涉及激酶结构域)[10]。
● NOTCH1(Notch同源蛋白1)作为膜结合型配体Jagged-1(JAG1)、Jagged-2(JAG2)和Delta-1(DLL1)的受体,参与细胞命运决定。越来越多的证据表明,NOTCH1信号传导的异常和NOTCH1的突变在慢性淋巴细胞白血病(CLL)中起着关键作用 [11]。最初在T细胞急性淋巴细胞白血病(T-ALL)中发现NOTCH1基因的染色体重排和突变,超过60%的病例显示NOTCH1信号的异常激活 [12]。
参考文献:
[1] Douglas B. Johnson, Keiran S.M. Smalley and Jeffrey A. Sosman. Molecular Pathways: Targeting NRAS in Melanoma and Acute Myelogenous Leukemia [J]. Clin Cancer Res. 2014, 20 (16) : 4186-4192.
[2] Pylayeva-Gupta Y, Grabocka E, Bar-Sagi D. RAS oncogenes: weaving a tumorigenic web [J]. Nat Rev Cancer. 2011, 11:761–74.
[3] Ward AF, Braun BS, Shannon KM. Targeting oncogenic Ras signaling in hematologic malignancies [J]. Blood. 2012, 120:3397–406.
[4] Irahara N, Baba Y, Nosho K et al. NRAS mutations are rare in colorectal cancer [J]. Diagn Mol Pathol. 2010, 19:157–63.
[5] Hsin-An Hou, Yuan-Yeh Kuo, Chieh-Yu Liu et al. DNMT3A mutations in acute myeloid leukemia: stability during disease evolution and clinical implications [J]. Blood. 2012, 119 (2): 559–568.
[6] Ichikawa M, Yoshimi A, Nakagawa M et al. A role for RUNX1 in hematopoiesis and myeloid leukemia [J]. Int J Hematol. 2013, 97 (6):726-34.
[7] Goyama S, Schibler J, Cunningham L et al. Transcription factor RUNX1 promotes survival of acute myeloid leukemia cells [J]. J Clin Invest. 2013, 123 (9): 3876-88.
[8] Tefferi A, Pardanani A, Lim KH et al. TET2 mutations and their clinical correlates in polycythemia vera, essential thrombocythemia and myelofibrosis [J]. Leukemia. 2009, 23: 905–911.
[9] Jankowska AM, Szpurka H, Tiu RV et al. Loss of heterozygosity 4q24 and TET2 mutations associated with myelodysplastic/myeloproliferative neoplasms [J]. Blood. 2009, 113: 6403–6410.
[10] Small D. FLT3 mutations: biology and treatment [J]. Hematology Am Soc Hematol Educ Program. 2006:178-84.
[11] Rosati E, Baldoni S, De Falco F et al. NOTCH1 Aberrations in Chronic Lymphocytic Leukemia [J]. Front Oncol. 2018, 8:229.
[12] Emanuela Rosati, Stefano Baldoni, Filomena De Falco et al. NOTCH1 Aberrations in Chronic Lymphocytic Leukemia [J]. Front. Oncol. 2018, 8:229.






