子宫内膜癌
子宫内膜癌是美国最常见的妇科恶性肿瘤。该癌症发生在子宫内膜,子宫是一个空心的梨形盆腔器官,胎儿在其中发育。子宫内膜癌在恶性妇科肿瘤中的发病率随着生活方式和环境变化而增加,在西方国家已经占据了近一半的子宫癌病例 [1]。
传统上,子宫内膜癌的分类通常基于临床和内分泌特征:I型和II型。I型子宫内膜癌通常在绝经前发生。II型子宫内膜癌主要发生在年龄较大的绝经后妇女中。关于子宫内膜癌的致癌机制,目前已经明确细胞的基因异常(DNA突变)在内膜中起着重要作用。图1显示,根据对内膜增生的观察以及在子宫内膜癌中至少有类似突变发生率的数据,已经有多个基因突变被认为可能在I型和II型子宫内膜癌的致癌过程中发挥作用。
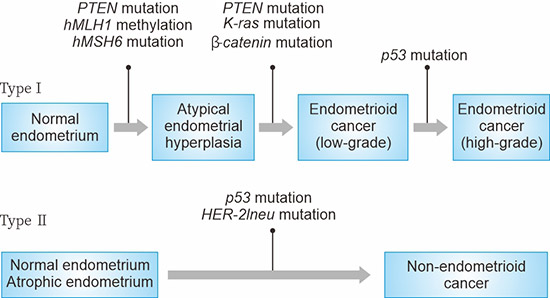
图1. 子宫内膜癌发生中的基因突变
*此图表来自《妇产科研究杂志》[2]
本文根据NCG(分析癌基因的可重复性、同源性和网络特性)提供的信息,列出了与子宫内膜癌相关的部分蛋白。
在此,我们展示了参与子宫内膜癌发生机制的几个关键靶点,包括:
● PPP2R1A(蛋白磷酸酶2支架亚单位Aalpha)是蛋白磷酸酶2复合物的亚单位,与细胞生长和分裂的负性调控有关。PPP2R1A突变在浆液型子宫内膜癌中很常见。此外,PPP2R1A突变区域在物种间保守,并已知与PP2A酶的调节亚单位相互作用[3]。此外,Dorien Haesen等人揭示了子宫癌中经常性出现的PPP2R1A突变通过优势负性机制促进恶性细胞生长 [4]。
● ARID1A(AT富集互动结构域蛋白1A)是几种不同SWI/SNF蛋白复合物的亚单位,它们在通过染色质重塑过程调节基因活动(表达)中发挥关键作用。ARID1A的突变通过染色质重塑功能障碍引起多个基因(CDKN1A、SMAD3、MLH1和PIK3IP1)表达的改变,从而促进癌变。已经显示它与PI3K/AKT通路一起引起细胞转化 [5]。最近,ARID1A缺失在各类型的子宫内膜癌中被发现,表明其在该疾病的发生和进展中起着重要作用 [6]。
● CHD4(染色质结构域螺旋酶DNA结合蛋白4)通过调节PHF5A,通过RhoA/ROCK通路介导非小细胞肺癌的增殖和迁移。CHD4是核小体重塑和去乙酰化(NuRD)复合物的核心亚单位,在子宫内膜癌患者中频繁发生突变。杨力的研究表明,CHD4的突变可以通过TGFβ信号通路增加CSC特性,促进子宫内膜肿瘤发生 [7]。
● FBXW7(F-box/WD重复蛋白7)是泛素连接酶复合物的组成部分,其功能与磷酸化依赖性泛素化相关。Diego A. Garcia-Dios等人发现PIK3CA、TP53、PTEN和FBXW7的突变与高肿瘤分级、子宫内膜癌类型和淋巴结状态相关,而PIK3CA H1047R突变可作为子宫内膜癌患者无复发存活的预后标志物 [8]。
● SPOP(斑点型BTB/POZ蛋白)可能调节死亡相关蛋白6(DAXX)的转录抑制活性。它是基于CUL3的E3泛素连接酶复合物的适配蛋白。它选择性地招募底物进行泛素化和进一步降解。最近,关于子宫内膜癌的几个外显子测序研究发现SPOP的体细胞突变频率较高(5.7-10%)[9]。
参考文献:
[1] Kouji Banno, Megumi Yanokura, Yusuke Kobayashi et al. Endometrial Cancer as a Familial Tumor: Pathology and Molecular Carcinogenesis (Review) [J]. Curr Genomics. 2009, 10(2): 127–132.
[2] Kouji Banno, Megumi Yanokura, Miho Iida et al. Carcinogenic mechanisms of endometrial cancer: Involvement of genetics and epigenetics [J]. The Journal of Obstetrics and Gynaecology Research. 2014.
[3] Haesen D, Abbasi Asbagh L, Derua R et al. Recurrent PPP2R1A Mutations in Uterine Cancer Act through a Dominant-Negative Mechanism to Promote Malignant Cell Growth [J]. Cancer Res. 2016, 76(19): 5719-5731.
[4] Nagendra DC, Burke J 3rd, Maxwell GL, Risinger JI. PPP2R1A mutations are common in the serous type of endometrial cancer [J]. Mol Carcinog. 2012, 51(10):826-31.
[5] TAKASHI TAKEDA, KOUJI BANNO, RYUICHIRO OKAWA et al. ARID1A gene mutation in ovarian and endometrial cancers (Review) [J]. Oncol Rep. 2016, 35(2): 607–613.
[6] CHRISAVGI TOUMPEKI, ANASTASIOS LIBERIS, IOANNIS TSIRKAS et al. The Role of ARID1A in Endometrial Cancer and the Molecular Pathways Associated With Pathogenesis and Cancer Progression [J]. In Vivo. 2019, 33(3): 659–667.
[7] Yang Li, Qingxin Liu, Daniel J McGrail et al. CHD4 mutations promote endometrial cancer stemness by activating TGF-beta signaling [J]. Am J Cancer Res. 2018, 8(5): 903- 914.
[8] Garcia-Dios, Diego A.; Lambrechts, Diether; Coenegrachts, Lieve et al. High-throughput interrogation of PIK3CA, PTEN, KRAS, FBXW7 and TP53 mutations in primary endometrial carcinoma [J]. Gynecologic Oncology. 2013, 128(2), 327–334.
[9] P Zhang, K Gao, X Jin et al. Endometrial cancer-associated mutants of SPOP are defective in regulating estrogen receptor-α protein turnover [J]. Cell Death Dis. 2015, 12;6(3):e1687.






