乳腺癌
乳腺癌是全球女性最常见的恶性肿瘤,在早期非转移性疾病患者中可治愈率达到70%至80%。全球每年有超过130万名女性被诊断出乳腺癌,使其成为仅次于肺癌的第二常见癌症形式 [1][2]。
所有乳腺癌起源于乳腺的终末小叶单位(乳腺的功能单位)的集合管(图1)。目前,临床实践通常根据组织学和分子特征使用五个亚型的代理分类,包括三阴性、HER2丰富型(非内皮样)、luminal B样HER2阳性、luminal B样HER2阴性和luminal A样乳腺癌。
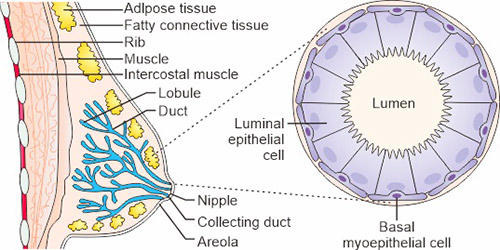
图1. 乳腺的结构
*该图源自《自然评论》的一篇出版物 [3]。
临床上通常使用代理内在亚型,并基于组织学和免疫组化表达关键蛋白质,包括雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)和增殖标记物Ki67。表达ER和/或PR的肿瘤被称为“激素受体阳性”;不表达ER、PR和HER2的肿瘤被称为“三阴性”。
除了上述的三种关键蛋白质外,还有许多蛋白质在乳腺癌的发展中起着重要作用。在本文中,我们根据NCG(癌症基因的重复性、同源性和网络特性分析的网络资源)提供的信息,列出了乳腺癌中涉及的部分蛋白质。
在这里,我们展示了乳腺癌机制中涉及的几个关键靶点,包括:
● ERBB2(受体酪氨酸激酶2),也被称为CD340或HER2,是人类中由ERBB2基因编码的蛋白质。在正常细胞中,HER2在不同的细胞过程和维持HER2蛋白的表达水平中起着重要作用。然而,HER2基因或蛋白质的过度表达可能导致肿瘤形成和迁移。HER2形成二聚体后抑制自噬以促进细胞迁移。
越来越多的证据表明,25%~30%的乳腺癌患者为HER2阳性。此外,目前乳腺癌最常用的靶向药物就是以ERBB2作为靶点开发的,包括曲妥珠单抗(Trastuzumab)、佩珠珠单抗(Pertuzumab)、埃替妥珠单抗(Ado-trastuzumab emtansine)、依奈替单抗(Inetetamab)和曲妥珠单抗生物类似药物(Trastuzumab biosimilar)等。
● PIK3CA(磷酸二酯酶酯酶4,5-双磷酸3-激酶催化亚基α)基因提供了制造p110α蛋白质的指令,它是一种称为磷酸二酯酶酯酶3激酶(PI3K)的酶的一部分(亚单位)。PIK3CA是浸润性乳腺癌(IBC)中最常见的突变基因之一,并且是不良预后的生物标志物。这些突变通常与磷酸二酯酶酯酶3激酶信号通路的过度激活有关,其中涉及AKT的磷酸化增加(p-AKT)[4]。目前,一种名为Alpelisib的磷酸二酯酶酯酶3激酶α抑制剂已被批准用于乳腺癌治疗。此外,目前有三种磷酸二酯酶酯酶3激酶α抑制剂正在临床III期研究中用于乳腺癌治疗,包括Taselisib、Dactolisib和Buparlisib。
● TP53(肿瘤蛋白P53),也被称为p53,作为一种肿瘤抑制因子,它通过阻止细胞过快或无控制地生长和分裂(增殖)来调节细胞分裂。TP53突变是浸润性乳腺癌中最常见的遗传改变。虽然在30%的乳腺癌中发生突变,但在大约80%的三阴性(TN)肿瘤中发生突变 [5]。目前,已经有一种名为INGN 225的P53基因刺激剂进入了乳腺癌治疗的II期临床开发阶段。
● AKT1(RAC-alpha丝氨酸/苏氨酸蛋白激酶)是Akt家族中的三种同功异构体之一,编码一种称为激酶B alpha(PKBα)的蛋白质。激活的AKT1磷酸化大量下游底物,在调节细胞生长、代谢、增殖、凋亡、血管生成和药物反应方面起着关键作用 [6]。许多研究证明AKT1是乳腺癌转移的抑制剂 [7]。Akt1的激活抑制了乳腺癌细胞的运动和侵袭。目前,Ipatasertib Dihydrochloride和Capivasertib作为AKT1抑制剂已进入临床III期开发阶段。
● GATA3是GATA转录因子家族的成员之一,含有六个锌指结构,被发现在乳腺上皮的发育中起着重要作用。它在乳腺中的腺上皮细胞中高表达 [8]。GATA3的表达水平最高出现在乳腺癌的腺型类型中,并且随着肿瘤分级的增加而降低 [9]。此外,高水平的GATA3表达与绝经前ER阳性乳腺癌患者的生存结果显著相关,但与绝经后患者无关 [10]。
参考文献:
[1] Grayson M. Breast cancer [J]. Nature. 2012, 485(7400): S49.
[2] Woolston C. Breast cancer [J]. Nature. 2015, 19;527(7578):S101.
[3] Nadia Harbeck, Frédérique Penault-Llorca, Javier Cortes, et al. Breast cancer [J]. Nature review. 2019, 5:66.
[4] Marie Colombe Agahozo, Anieta M. Sieuwerts, S. Charlane Doebar et al. PIK3CA mutations in ductal carcinoma in situ and adjacent invasive breast cancer [J]. Endocr Relat Cancer. 2019, 26(5):471-482.
[5] Michael J Duffy, Naoise C Synnott and John Crown. Mutant p53 in breast cancer: potential as a therapeutic target and biomarker [J]. Breast Cancer Res Treat. 2018, 170(2):213-219.
[6] Andrés López-Cortés , Paola E. Leone , Byron Freire-Paspuel, et al. Mutational Analysis of Oncogenic AKT1 Gene Associated with Breast Cancer Risk in the High Altitude Ecuadorian Mestizo Population [J]. BioMed Research International. 2018.
[7] Wei Li, Jiu-Zhou Hou, Jie Niu et al. Akt1 inhibition promotes breast cancer metastasis through EGFR-mediated β-catenin nuclear accumulation [J]. Cell Communication and Signaling. 2018, 16(82).
[8] Ashley Cimino-Mathews, Andrea P Subhawong, Peter B Illei et al. GATA3 expression in breast carcinoma: utility in triple-negative, sarcomatoid, and metastatic carcinomas [J]. Hum Pathol. 2013, 44 (7): 1341-9.
[9] Yoon NK Maresh EL Shen D et al. Higher levels of GATA3 predict better survival in women with breast cancer [J]. Hum Pathol. 2010, 41:1794–1801.
[10] Hosoda M Yamamoto M Nakano K et al. Differential expression of progesterone receptor, FOXA1, GATA3, and p53 between pre- and postmenopausal women with estrogen receptor-positive breast cancer [J]. Breast Cancer Res Treat. 2014, 144: 249–261.






