前列腺癌
如果活得够久,大多数男人都会得前列腺癌。在全球范围内,它是男性第二常见的癌症。前列腺癌发生在前列腺腺体中,该腺体位于男性的膀胱下方,并环绕着从膀胱排尿的管道的顶部部分。前列腺像其他腺体器官一样,由上皮和间质两个区域组成,这些区域包含多种细胞类型。如图1所示,前列腺腺体中的间质和上皮区域由基底膜分隔开,基底膜是由胶原纤维组成的紧密结构,其中包含由上皮细胞和间质细胞产生的各种细胞外基质蛋白 [1]。
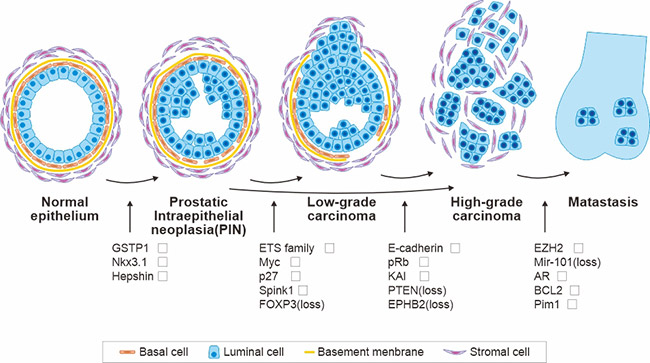
图1. 前列腺癌进展模型
*此图示源自于《进展癌症研究》[2] 的出版物
通常情况下,前列腺癌的发生和进展会引起上皮细胞和间质细胞区域的显著变化。图1描述了前列腺癌发生和进展过程中的组织学变化以及相关的遗传和表观遗传事件。肿瘤抑制基因的缺失或失活突变以"(loss)"表示。基因的过表达以向上的箭头表示,而表达的下调则以向下的箭头表示。需要注意的是,这些变化仅是表达水平的初始变化。在更进一步的阶段,表达的上调或下调可能会持续存在。
在本文中,我们根据NCG(癌症基因的重复性、同源性和网络属性分析的网络资源)提供的信息,列出了参与前列腺癌的一部分靶点。
这里,我们列出了参与前列腺癌机制的几个关键靶点,包括:
● PTEN(磷酸酶和张力蛋白双功能蛋白)是一种双特异性磷酸酶,将磷脂酰肌醇3,4,5-三磷酸(PIP3)转化为磷脂酰肌醇4,5-二磷酸(PIP2)[3]。PTEN基因的基因组异常在前列腺癌中是最常见的。PTEN基因的缺失或突变在根治性前列腺切除术后的原发性前列腺肿瘤样本中约占20%,在去势抵抗性肿瘤中高达50%。PTEN功能丧失导致PI3K-AKT通路的激活,并且与不良肿瘤学结果密切相关,使PTEN成为在临床局部化肿瘤患者中区分低度恶性和高度恶性疾病的潜在有用的基因标记 [4]。
● ATM(遗传性毛细血管扩张性共济失调)编码一种PI3K相关的丝氨酸/苏氨酸蛋白激酶(PIKK),有助于维持基因组完整性。ATM在修复DNA双链断裂(DSB)中起着核心作用 [5]。前列腺癌与DNA损伤后缺陷的DNA链断裂修复相关,导致遗传不稳定性和前列腺癌的进展 [6]。然后,一些科学家假设并证明了ATM错义变异P1054R的患病率增加了患前列腺癌的风险。
● SPOP(斑点样POZ蛋白)是原发性前列腺癌中最常见的突变基因,调节DNA双链断裂(DSB)修复。SPOP突变与基因组不稳定性相关。Gunther Boysen等人已经证明,SPOP突变在一定程度上通过基因组不稳定性驱动前列腺肿瘤发生,并表明突变的SPOP可能增加对DNA损伤治疗的反应 [7]。
● APC(腺瘤性息肉样多发性结肠腺瘤)是一个关键的肿瘤抑制基因,编码一个具有多个结构域的蛋白质,通过这些结构域与各种蛋白质结合,包括β-连环蛋白、Axin、CtBP、Asefs、IQGAP1、EB1和微管。使用突变小鼠和培养细胞的研究已经证明,APC抑制经典Wnt信号通路,该通路对于肿瘤发生至关重要 [8]。越来越多的证据显示,由于Apc缺失引起的前列腺肿瘤中β-连环蛋白水平升高且高度增殖 [9]。
● AR(雄激素受体)是睾丸酮和二氢睾丸酮的类固醇受体转录因子,在前列腺癌中发挥关键作用,特别是去势抵抗性前列腺癌(CRPC) [10]。目前,已经有八种雄激素受体拮抗剂被批准用于前列腺癌治疗,包括达罗他胺、阿帕曲胺、恩杂胺、乙酸环丙孕酮、比卡鲁胺、氟他胺、尼鲁他胺和乙酸环丙孕酮/乙烯雌酚。
参考文献:
[1] Bonkhoff, H., Wernert, N., Dhom, G. et al. Distribution of basement membranes in primary and metastatic carcinomas of the prostate [J]. Hum. Pathol. 1992, 23,934–939.
[2] Beatrice S. Knudsen and Valera Vasioukhin. Mechanisms of Prostate Cancer Initiation and Progression [J]. Adv Cancer Res. 2010, 109:1-50.
[3] Maehama T, Dixon JE. The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate [J]. J Biol Chem. 1998, 273(22):13375-8.
[4] Tamara Jamaspishvili, David M. Berman, Ashley E. Ross et al. Clinical implications of PTEN loss in prostate cancer [J]. Nat Rev Urol. 2018, 15(4): 222–234.
[5] Michael Choi, Thomas Kipps and Razelle Kurzrock. ATM Mutations in Cancer: Therapeutic Implications [J]. Molecular Cancer Therapeutics. 2016.
[6] AndreasMeyer, BettinaWilhelm, ThiloDörk et al. ATM missense variant P1054R predisposes to prostate cancer [J]. Radiotherapy and Oncology. 2007, 83(3):283-288.
[7] Gunther Boysen, Christopher E Barbieri, Davide Prandi et al. SPOP mutation leads to genomic instability in prostate cancer [J]. Elife. 2015, 16(4): e09207.
[8] Koji Aoki, Makoto M Taketo. Adenomatous polyposis coli (APC): a multi-functional tumor suppressor gene [J]. J Cell Sci. 2007, 120(Pt 19): 3327-35.
[9] Katia J. Bruxvoort, Holli M. Charbonneau, Troy A. Giambernardi, et al. Inactivation of Apc in the Mouse Prostate Causes Prostate Carcinoma [J]. Cancer Res. 2007, 67(6):2490–6.
[10] Kazutoshi Fujita , Norio Nonomura. Role of Androgen Receptor in Prostate Cancer: A Review [J]. World J Mens Health. 2019, 37(3):288-295.






