结直肠癌
结肠癌是一种起源于结肠(大肠)的癌症。结肠是消化道的最后一部分。结直肠癌是西半球第三常见的癌症,发病率随着年龄增长而增加 [1]。导致结直肠癌的环境和遗传因素促使结肠上皮细胞获得癌症的典型行为特征。许多研究观察到在结肠早期肿瘤病变(如异常腺瘤样息肉、腺瘤和锯齿状息肉)中,基因组和/或表观基因组稳定性的丧失,这很可能是结直肠癌发生和形成的中心分子和病理生理学事件 [2][3]。
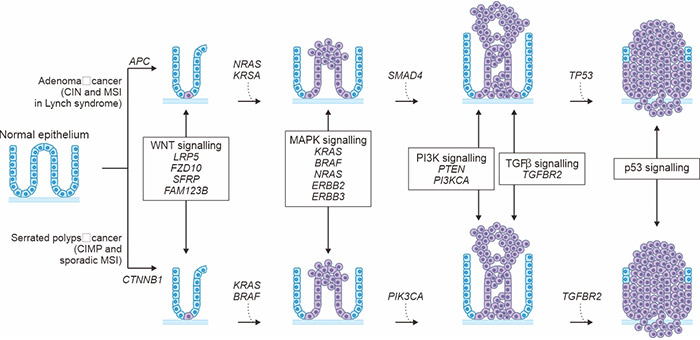
图1. 息肉到结直肠癌的演变序列
*此图示源自于《癌症研究进展》[4] 的出版物
目前,已经确定了两种离散的正常结肠到结直肠癌的演变序列(图1)。这两种序列都涉及正常结肠上皮细胞向畸形隐窝、早期和晚期息肉的演变,然后进展到早期癌和晚期癌。“经典”或传统途径(顶部)涉及结肠腺瘤的发展,可进展为腺癌。另一条途径(底部)涉及齿状息肉及其演变为齿状结直肠癌,在过去的5-10年中已有描述。图1显示了每个序列中发生突变或表观遗传改变的基因。正如您所见,两条途径之间有一些共享的基因(如KRAS),而其他基因是独特的(如BRAF)。
在本文中,我们根据NCG提供的信息列出了部分涉及结直肠癌的靶点(NCG是一个用于分析癌症基因的复制能力、同源性和网络特性的网络资源)。
结直肠癌的进展受一系列明确定义的遗传改变驱动,包括APC、BRAF、KRAS、PIK3CA、p53和FBXW7的突变。在这里,我们列出了几个参与结直肠癌机制的关键靶点,包括:
● APC(腺瘤性息肉患者大肠癌基因)的功能与Wnt信号传导通路有关。在正常情况下,APC能导致α-连环蛋白的降解,从而影响细胞粘附、迁移和凋亡 [5-7]。由于APC失活足以引发肿瘤发展,APC突变会影响α-连环蛋白的降解,截断的APC片段会刺激结直肠癌细胞迁移并引发染色体不稳定性 [8]。
● KRAS(Kirsten rat sarcoma viral oncogene homolog)是MAP激酶(MAPK)通路的成员,是参与细胞内信号转导的小GTP酶 [9]。KRAS突变会导致KRAS蛋白活性的失调,使其失去GTP酶活性并获得致癌活性。KRAS基因的第2和第3外显子的点突变负责恶性转化。KRAS突变在伊朗结直肠癌患者中的观察率约为37.4% [10]。
此外,结直肠癌中的KRAS突变通常与BRAF突变呈负相关 [11]。Li等人此前证明与低期癌相比,KRAS/PIK3CA双突变在IV期结直肠癌患者中明显更频繁。KRAS/PIK3CA双突变可能通过协同作用在PI3K-AKT通路的激活中诱导转移 [12] [13]。● SMAD4(SMAD家族成员4),也称为反对异头二十面体同源物4,是一种在所有后生动物中高度保守的蛋白质。它属于SMAD家族的转录因子蛋白,作为TGF-β信号转导的介质。关于SMAD4蛋白在结直肠癌中的丢失报道范围从9%到66%(9.3%,14%,66%),它是早发型结直肠肿瘤和其他年龄组诊断的结直肠癌的共同特征 [14]。
● FBXW7(F-box和WD重复结构域含有7)是F-box家族蛋白的一员,构成Skp1、Cul1和F-box蛋白(SCF)泛素连接酶复合物的一个亚单位。它是一个潜在的肿瘤抑制基因,调节多个目标如cyclin E、c-Myc、c-Jun和Notch的泛素化和蛋白质降解 [15]。
参考文献:
[1] Sigurdis Haraldsdottir, Hulda M Einarsdottir, Agnes Smaradottir et al. Colorectal cancer – review [J]. Laeknabladid. 2014, 100(2):75-82.
[2] Colussi D, Brandi G, Bazzoli F et al. Molecular pathways involved in colorectal cancer: implications for disease behavior and prevention [J]. Int J Mol Sci. 2013, 14(8):16365-85.
[3] Grady WM, Carethers JM. Genomic and epigenetic instability in colorectal cancer pathogenesis [J]. Gastroenterology. 2008, 135(4):1079-99.
[4] Ernst J. Kuipers, William M. Grady, David Lieberman et al. Colorectal cancer [J]. Nat Rev Dis Primers. 2015, 1: 15065.
[5] Yang J, Zhang W, Evans PM et al. Adenomatous polyposis coli (APC) differentially regulates beta-catenin phosphorylation and ubiquitination in colon cancer cells [J]. J Biol Chem. 2006, 30; 281(26):17751-7.
[6] Etienne-Manneville S, Hall A. Cdc42 regulates GSK-3beta and adenomatous polyposis coli to control cell polarity [J]. Nature. 2003, 421(6924):753-6.
[7] Watanabe T, Wang S, Noritake J et al. Interaction with IQGAP1 links APC to Rac1, Cdc42, and actin filaments during cell polarization and migration [J]. Dev Cell. 2004, 7(6):871-83.
[8] M Toma, D Cimponeriu, A Pompilia et al. Molecular analysis of mutations for the adenomatous polyposis coli (APC) gene in Romanian patients with colorectal cancer [J]. J Med Life. 2008, 1(4): 423–428.
[9] Velho S, Moutinho C, Cirnes L et al. BRAF, KRAS and PIK3CA mutations in colorectal serrated polyps and cancer: Primary or secondary genetic events in colorectal carcinogenesis [J]? BMC Cancer. 2008, 8:255.
[10] Atena Irani Shemirani, Mahdi Montazer Haghighi, Saman Milanizadeh et al. The role of kras mutations and MSI status in diagnosis of colorectal cancer [J]. Gastroenterol Hepatol Bed Bench. 2011, 4(2): 70–75.
[11] Daniele Calistri, Claudia Rengucci, Ian Seymour et al. KRAS, p53 and BRAF gene mutations and aneuploidy in sporadic colorectal cancer progression [J]. Cellular Oncology. 2006, 28: 161–166.
[12] Li HT, Lu YY, An YX et al. KRAS, BRAF and PIK3CA mutations in human colorectal cancer: relationship with metastatic colorectal cancer [J]. Oncol Rep. 2011, 25(6):1691-7.
[13] Luca Reggiani Bonetti, Valeria Barresi, Antonino Maiorana et al. Clinical Impact and Prognostic Role of KRAS/BRAF/PIK3CA Mutations in Stage I Colorectal Cancer [J]. Dis Markers. 2018, 2018: 2959801.
[14] S. G. Royce, K. Alsop, A. Haydon et al. The role of SMAD4 in early-onset colorectal cancer [J]. Colorectal Dis. 2010, 12(3): 213–219.
[15] Hao Liu, Kai Wang, Haixiao Fu et al. Low expression of the ubiquitin ligase FBXW7 correlates with poor prognosis of patients with colorectal cancer [J]. Int J Clin Exp Pathol. 2018, 11(1): 413–419.






