肺癌
肺癌是一种起源于肺部的癌症。它会导致肺部细胞不受控制地分裂,形成肿瘤,从而降低人体的呼吸功能。全球约四分之三的肺癌与吸烟有关,其他原因包括职业环境暴露、氡气暴露和空气污染(图1)。男性患肺癌的比例较高,发病率随年龄增加而增加 [1][2]。
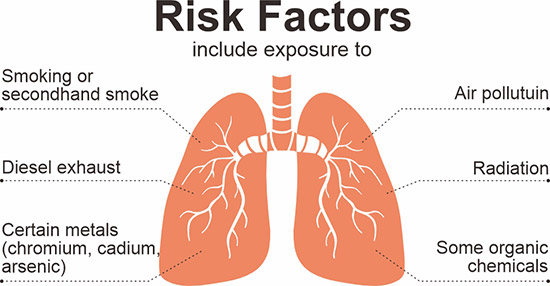
图1. 获得肺癌的危险因素
肺癌是一种异质性疾病,包括几种具有病理和临床相关性的亚型。小细胞肺癌(SCLC,占所有肺癌的15%)和非小细胞肺癌(NSCLC,占85%)是肺癌的两种主要形式。非小细胞肺癌(NSCLC)进一步分为鳞状细胞癌、腺癌和大细胞癌。作为最常见的亚型,NSCLC已成为该疾病治疗的重要决定因素。近年来,对大部分肺癌患者进行分子异常的鉴定,使个体化靶向治疗逐渐出现。在本文中,我们列出了基于NCG提供的信息,涉及肺癌的部分靶点。NCG是一个用于分析癌症基因的重复性、同源性和网络属性的网络资源。
- APC
- ARID1A
- ATM
- BRAF
- CDH10
- CDKN2A
- COL22A1
- CTNNB1
- EGFR
- EPHA3
- EPHA5
- ERBB4
- FBXW7
- GRM8
- INHBA
- KDR
- KEAP1
- KMT2D
- KRAS
- LRP1B
- MET
- MGA
- NF1
- NFE2L2
- NLRP3
- NOTCH1
- NRAS
- PIK3CA
- PIK3CG
- PTEN
- RB1
- RBM10
- RIT1
- SETD2
- SMARCA4
- STK11
- TP53
- U2AF1
在这里,我们展示了几个参与肺癌机制的关键靶点,包括:
● TP53,也称为p53,是一种应激反应蛋白,在基因毒性应激、致癌信号、DNA损伤和细胞损伤等方面介导基因转录。几乎所有的小细胞肺癌和超过一半的非小细胞肺癌都存在TP53的变异。除了失去肿瘤抑制功能外,TP53突变还可能导致增殖有利、抑制凋亡和基因组不稳定性的功能增强 [3]。目前,Aprea Therapeutics公司开发的肿瘤蛋白p53刺激剂Eprenetapopt已进入III期临床试验,用于肺癌治疗。
● KRAS(Kirsten大鼠肉瘤病毒肿瘤基因同源物)是经典RAS家族的成员,该家族还包括HRAS和NRAS。三十年前,人们首次在大鼠中认识到RAS在癌症发病机制中的重要性。现在,已经发现RAS突变存在于大约30%的人类肿瘤中,其中KRAS是最常见的突变家族成员 [4]。导致癌症的RAS突变严重损害了GTP酶活性,导致RAS蛋白锁定在活性GTP结合构象中,不受上游信号的影响。过去几十年的研究产生了大量关于KRAS突变在肺癌中临床相关性的信息。目前,开发了几种针对KRAS的抑制剂进入了临床阶段,包括AMG-510、MRTX-849、D-1553、LY-3499446、AZD-4785、Antroquinonol、GDC-6036和JAB-3312。其中,AMG-510和MRTX-849的开发已进入临床III期。
● EGFR(表皮生长因子受体)是一种跨膜蛋白,具有细胞质激酶活性,可将重要的生长因子信号从细胞外环境传递到细胞内。几项研究表明,超过60%的非小细胞肺癌表达EGFR。现在,EGFR已成为这些肿瘤治疗中的重要靶点 [5]。目前,已经开发出许多针对EGFR激酶结构域的拮抗剂,并且已经获得肺癌治疗的批准,如Almonertinib Mesilate、Dacomitinib、Brigatinib、Olmutinib、Necitumumab等等。
● KEAP1(Kelch-like ECH-associated protein 1)是一种新鉴定的Nrf2相关蛋白,它作为电泳亲合性/氧化应激的传感器发挥功能。电泳亲合性/氧化应激被Keap1感知,通过调节药物代谢和抗氧化应激酶/蛋白的表达来激活Nrf2,以实现细胞保护作用。由于氧化应激和电泳亲合性应激导致许多疾病,包括癌症,在Nrf2-KEAP1系统的异常被假设有助于癌细胞的生长 [5]。越来越多的证据表明,KEAP1是LUAD中第三常见的突变基因 [6]。
● RB1(Retinoblastoma transcriptional corepressor 1)是一种RB口袋蛋白,通过与多种转录因子相互作用,在细胞周期进程中起重要作用,同时也是一个肿瘤抑制因子 [7]。小细胞肺癌(SCLC)占据了肺癌的15%,几乎总是与失活的RB1和TP53突变相关 [8]。
参考文献:
[1] Malhotra J, Malvezzi M, Negri E et al. Risk factors for lung cancer worldwide [J]. Eur Respir J. 2016, 48:889-902.
[2] Richard D, Fei Sun, Jon D et al. Lung cancer [J]. BMJ. 2019, 365: 1725.
[3] Ramaswamy Govindan and Jason Weber. TP53 Mutations and Lung Cancer: Not All Mutations Are Created Equal [J]. Clin Cancer Res. 2014, 20(17):4419–21.
[4] Peter M. K. Westcott and Minh D. To. The genetics and biology of KRAS in lung cancer [J]. Chin J Cancer. 2013, 32(2): 63–70.
[5] Tsutomu Ohta, Kumiko Iijima, Mamiko Miyamoto et al. Loss of Keap1 Function Activates Nrf2 and Provides Advantages for Lung Cancer Cell Growth [J]. Cancer Res. 2008. 68(5):1303–9.
[6] Rodrigo Romero, Volkan I. Sayin, Shawn M. Davidson et al. Keap1 loss promotes Kras-driven lung cancer and results in a dependence on glutaminolysis [J]. Nat Med. 2017. 23(11): 1362–1368.
[7] Priyanka Bhateja, Michelle Chiu , Gary Wildey et al. Retinoblastoma mutation predicts poor outcomes in advanced non small cell lung cancer [J]. Cancer Med. 2019. 8(4):1459-1466.
[8] Matthew G Oser, Raquel Fonseca, Abhishek A Chakraborty et al. Cells Lacking the RB1 Tumor Suppressor Gene Are Hyperdependent on Aurora B Kinase for Survival [J]. Cancer Discov. 2019. 9(2):230-247.






