黑色素瘤
黑色素瘤是西方世界常见的一种癌症,其发病率逐渐增加。它是最具侵袭性和致命性的皮肤癌类型。黑色素瘤的致病特征包括异型黑素细胞的生长和扩增,涉及到多种特征,包括对生长因子的自主性依赖、对生长抑制剂的不敏感、逃避细胞凋亡、组织侵袭和转移 [1] [2]。这些黑色素瘤的致病事件可以通过激活致癌基因或灭活肿瘤抑制基因来触发 [3]。
黑色素瘤与紫外线引起的DNA损伤和基因组改变有关。对基因组的基因异常分析已经揭示了信号通路的复杂相互作用(图1)[4]。
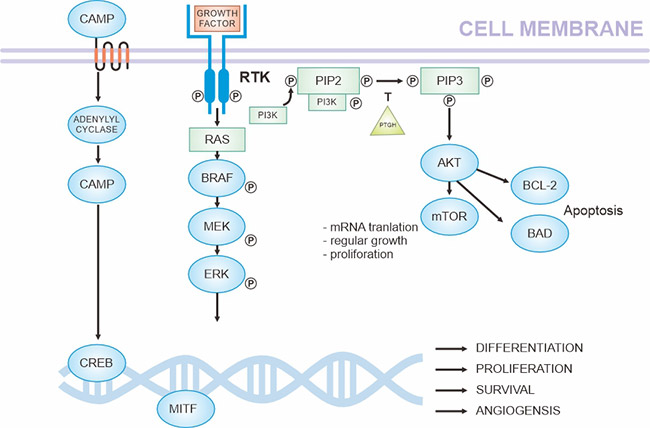
图1. 黑色素瘤发病的关键通路(基于现有知识)
*此图表来自于克罗地亚皮肤性病学报 [4] 的出版物
遗传因素在黑色素瘤(散发性和家族性黑色素瘤)的发病机制中尤为重要。本文根据NCG(分析肿瘤基因的可重复性、同源性和网络特性)提供的信息,列出了与黑色素瘤相关的部分蛋白。
在此,我们展示了参与黑色素瘤发病机制的几个关键靶点,包括:
● BRAF(丝氨酸/苏氨酸蛋白激酶B-raf)是一个被称为RAS/MAPK通路的信号传导途径的一部分,控制着多个重要的细胞功能。越来越多的证据表明,躯干和四肢皮肤的黑色素瘤与BRAF(50%)和NRAS(20%)的突变频繁相关。而在黏膜和掌跖黑色素瘤中,BRAF突变的比率较低(5-20%),而KIT突变的比率较高(5-10%)[5]。
● RAC1(与C3肉毒杆菌毒素亚基1相关的Ras蛋白)是一种21kDa的GTP酶,在各种细胞事件中充当分子开关(如细胞运动、发育、信号传导、细胞骨架组织、免疫反应和细胞周期)。最近发现RAC1 P29S是黑色素瘤中第三常见的经常性突变,影响4-7%的黑色素瘤患者。这是一个致癌突变,因为突变蛋白大部分保持在其活性的GTP结合形式,并且其异位表达增加了正常黑色素细胞的增殖和迁移速率 [6]。
● CDKN2A(细胞周期依赖性激酶抑制剂2A)编码两种蛋白质,包括INK4家族成员p16和p14arf。它们通过调控细胞周期起到肿瘤抑制剂的作用。据报道,CDKN2A的生殖细胞系突变会增加发展黑色素瘤的风险,并且在家族性和多发性黑色素瘤病例中分别存在于20%和10%的患者中 [7]。
● PPP6C(丝氨酸/苏氨酸蛋白磷酸酶6催化亚单位)是磷蛋白磷酸酶6(PP6)的一个亚单位,它是一个信号传导途径的组成部分,可调节细胞周期在IL2受体刺激下的进展。最近的全基因组黑色素瘤测序研究发现,编码丝氨酸/苏氨酸磷酸酶6催化亚单位(PPP6C/PP6C)的基因中存在经常性突变。此外,该研究还指出,PP6C突变与常见的BRAF和NRAS突变无关 [8]。
● ARID2(AT-rich interactive domain-containing protein 2)在染色质重塑复合物中发挥作用,促进基因转录。ARID2耗竭减弱了由于紫外线暴露引入的DNA损伤位点的核苷酸切除修复(NER)。我们实验室最近进行的外显子测序研究发现,ARID2在9%的黑色素瘤样本中发生突变。在所有新发现的黑色素瘤基因中,ARID2的功能丧失突变负担最高,这表明ARID2可能在黑色素瘤中被失活 [9]。
参考文献:
[1] Kosmidis C, Sofia Baka S, Sapalidis K et al. Melanoma from molecular pathways to clinical treatment: An Up to Date Review [J]. J Biomed. 2017, 2:94-100.
[2] Leong SP, Mihm MC Jr, Murphy G et al. Progression of cutaneous melanoma: implications for treatment [J]. Clin Exp Metastasis. 2012, 29:775-96.
[3] Garbe C, Bauer J. Melanoma. In: Bolognia J, Jorizzo JL, Schaffer JV, eds. Dermatology. 3rd ed., Vol. 2. Philadelphia, PA: Elsevier/Saunders; 2012. pp. 1885- 914.
[4] Liborija Lugović-Mihić, Diana Ćesić, Petra Vuković et al. Melanoma Development: Current Knowledge on Melanoma Pathogenesis [J]. Acta Dermatovenerol Croat. 2019, 27(3):163-168.
[5] Ribas A, Slingluff CL, Rosenberg SA. Cutaneous Melanoma. In: Devita VT, Hellman TS, Rosenberg SA, et al., eds. Principles and practice of oncology. Philadelphia: Wolters Kluwer, 2015. pp. 1346-94.
[6] Ruth Halaban. RAC1 and Melanoma [J]. Clinical Therapeutics. 2015, 37: 682-685.
[7] Blanca De Unamuno, Zaida García-Casado, José Bañuls et al. CDKN2A germline alterations in melanoma patients with personal or familial history of pancreatic cancer [J]. Melanoma Res. 2018, 28(3):246-249.
[8] Gold HL, Wengrod J, de Miera EV et al. PP6C hotspot mutations in melanoma display sensitivity to Aurora kinase inhibition [J]. Mol Cancer Res. 2014, 12(3):433-9.
[9] Flora Luo and Levi Garraway. Functional characterization of ARID2 in melanoma and melanocytes. AACR Annual Meeting 2014; April 5-9, 2014; San Diego, CA.






