黄病毒属(Flaviviruses)
黄病毒起源于大约10万年前的一个共同祖先,约在4万年前分成了蚊媒传播和蜱媒传播的两个亚属 [1]。最初,由于其结构构造的相似性,它们被认为是 togaviruses。基因序列和复制策略上的差异使得黄病毒属被分类为 Flaviviridae 科的一员,这是一个主要存在于蚊子和蜱虫中,偶尔会感染人类的正链单股、二十面体包膜的RNA病毒家族 [2][3]。Flavivirus 的名称来源于拉丁文 flavus,意思是“黄色”,与黄热病病毒引起的黄疸一致。
黄病毒属由70多种已知的与蚊媒传播相关的病毒(或称虫媒病毒)组成,广泛分布且在血吸虫和无脊椎动物寄主的生态环境下有特定地理分布 [4]。
结构
黄病毒的病毒颗粒呈球形,直径约50纳米,基因组长度约为11千碱基。病毒基因组在5′端部分拥有I型帽结构,同时还具有保守的二核苷酸序列5′-AG-3′-CU。大多数黄病毒,除了少数蜱媒的乙脑病毒(TBEV)株系外,基因组的3′端缺少聚腺苷酸尾巴,以5′-CU-3′结尾。基因组包括一个约11千碱基的大开放阅读框(ORF),编码一个单一的多肽蛋白,后经剪切分为十个蛋白质。在这些蛋白质中,三个结构蛋白包括鳞状(C)、前膜(prM)和包膜(E)组成了病毒颗粒。七个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)需要用于病毒复制、组装和调节宿主细胞反应。
它的RNA被包含在内核蛋白中,形成等距核壳 [5]。核壳进一步被宿主细胞质膜的脂质双层所包围,两个病毒编码的膜蛋白E和PrM锚定在脂质双层上。E蛋白负责受体介导的内吞作用、随后的细胞入侵,以及直接的病毒组装和脱落 [6]。此外,黄病毒的E蛋白还含有诱导中和抗体的抗原决定簇 [7]。PrM可以阻止病毒在细胞外流动期间的过早融合。
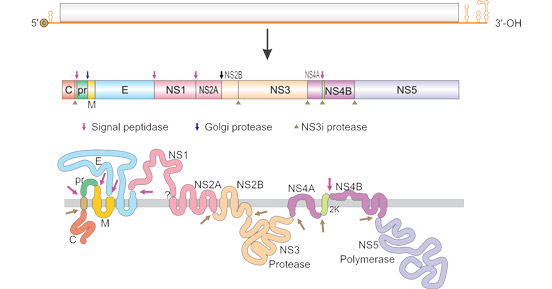
图1. 黄病毒RNA的结构
图片来源:viralzone.expasy.org
复制
黄病毒通过被感染媒介叮咬入侵目标细胞。它们通过受体介导的内吞作用进入宿主细胞并被运送到内泡泡中,在那里,温和酸性条件促使病毒膜与内泡泡膜融合,导致核壳的解组和病毒基因组RNA在宿主细胞质中的释放 [7][8]。在宿主细胞质中,释放的RNA利用宿主细胞机器和功能来编码三个结构蛋白和七个非结构蛋白,最终完成后代病毒的复制和组装 [9]。黄病毒最初被合成为含有M蛋白(prM的前体形式)的不成熟颗粒,它会被细胞蛋白酶furin剪切成熟颗粒 [10]。成熟的感染性病毒颗粒通过胞吐释放到细胞外。
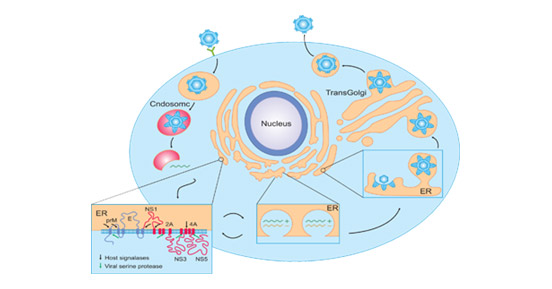
图2. 黄病毒的感染生命周期 [17]
相关蛋白
| 靶点 | 蛋白名 | 涉及的蛋白酶 | 功能 |
|---|---|---|---|
| C | Capsid | NS2B–NS3 protease | 病毒RNA在RNA组装和核衣壳形成过程中的包装。 |
| PrM | Premembrane | Furin | 它充当支架,防止病毒在细胞脱离的过程中过早融合。糖基化形式在E蛋白合成中起分子伴侣的作用,并在不成熟病毒颗粒中与E蛋白形成异二聚体。 |
| M | Membrane | Signalase | 跨膜蛋白,是prM的剪切部分。 |
| E | Envelope | Signalase | 它负责通过受体介导的内吞作用融合并随后进入细胞,以及直接进行病毒组装和分裂。E蛋白由4个域组成:干燥-跨膜域对,以及膜外发现的3个域,被称为外域I、II和III。 |
| NS1 | NS1 | Signalase | RNA复制和免疫入侵。 |
| NS2A | NS2A | Membrane-bound host protease present in ER | 复制复合物形成,病毒组装和对宿主免疫反应的逃逸。 |
| NS2B | NS2B | NS2B–NS3 protease | NS3蛋白酶辅因子。 |
| NS3 | NS3 | NS2B–NS3 protease | 类似胰蛋白酶的丝氨酸蛋白酶,螺旋酶NTPase和RNA三磷酸酶活性。 |
| NS4A | NS4A | NS2B–NS3 protease | 复制复合物形成和RNA复制。 |
| NS4B | NS4B | Signalase | 复制复合物形成和RNA复制。 |
| NS5 | NS5 | NS2B–NS3 protease | 它在病毒RNA复制中起着核心作用,也可能是参与黄病毒致病机制的干扰素(IFN)拮抗剂。 |
分类
黄病毒可分为三种类型:蚊媒传播病毒、蜱媒传播病毒和无媒介传播病毒 [11]。所有感染人类的黄病毒属于前两种类型,而第三组包括一些从老鼠或蝙蝠中分离出的病毒。然而,目前尚未证实这些病毒是否具有节肢动物媒介或自然传播途径。以下列出了一些新兴和再次出现的黄病毒。
| 分类 | 病毒 | 宿主 | 地理分布 |
|---|---|---|---|
| 蚊媒传播的黄病毒 | 黄热病病毒(YFV) | 灵长类动物种群和蚊子媒介(Aedes属、Haemagogus属和Sabethes属)。 | 首次在加纳发现;主要分布在热带非洲和热带南美地区。 |
| 登革热病毒(DENV) | Aedes蚊和白纹伊蚊。 | 热带和亚热带地区。 | |
| 日本脑炎病毒(JEV) | 脊椎动物、三线库蚊。 | 在北温带地区,日本脑炎在夏季流行,而在南热带地区,这种疾病是地方性的,并且全年都有发生。 | |
| 西尼罗河病毒(MNV) | 蚊子、鸟类、哺乳动物和爬行动物、人类。 | 1937年在乌干达首次鉴定,该病毒常见于非洲、西亚和中东地区。 | |
| 圣路易斯脑炎病毒 | 库蚊种蚊子、野生鸟类、人类。 | 大多数病例发生在美国东部和中部,在夏季和初秋时节。 | |
| 默里河谷脑炎病毒(MVEV) | 水鸟和环喙库蚊、Aedes normanensis蚊子、人类。 | 澳大利亚和新几内亚的地方性病毒。 | |
| 寨卡病毒(ZIKV) | Aedes属蚊子、非人类灵长类动物和人类。 | 1947年在乌干达的寨卡森林首次分离;直到2007年才在非洲以外地区爆发,当时该病毒传播到南太平洋。 | |
| 卡萨努尔森林病毒 | 蜱媒脑炎病毒(TBEV) | 蜱虫Ixodideae家族和人类。 | 北欧亚地区地方性的,在整个欧洲普遍可见。 |
| 波瓦桑病毒(POWV) | 蜱虫、小型或中型哺乳动物和人类。 | 1958年首次在加拿大安大略省的Powassan报告;在美国东北部和中西部地区地方性流行,也曾在俄罗斯远东地区报告过病例。它是唯一在西半球地方性流行的蜱媒病毒。 | |
| 卢平病毒(LIV) | 绵羊或欧洲鳖蜱Ixodes ricinus、人类。 | 英国高地地区,特别是苏格兰、坎布里亚、威尔士、德文和爱尔兰。 | |
| 鄂木斯克出血热病毒(OHFV) | 硬蜱属蜱虫和小型哺乳动物、人类。 | 西伯利亚西部的鄂木斯克、新西伯利亚、库尔干和秋明地区的森林草原带。 | |
| 卡萨努尔森林病毒 | Haemaphysalis属蜱虫、人类。 | 印度南部卡纳塔克邦的热带落叶林地区。 |
疾病研究
大多数黄病毒是人畜共患疾病的病原体,可引起各种疾病。下面列出一些由黄病毒引起的常见疾病。
| 病毒 | 疾病 | 症状 | 死亡率 |
|---|---|---|---|
| 黄热病病毒(YFV) | 黄热病(YF)和出血 | 发热、头痛、肌肉疼痛、恶心、食欲不振和黄疸。病情可能突然加重,发展为肝功能衰竭、出血症状、多器官系统功能衰竭和死亡。 | 约 14% |
| 登革病毒(DENV) | 登革出血热(DHF)或登革休克综合症 | 发热和严重的关节疼痛,但更严重的综合症状,如登革出血热或登革休克综合症,有时会在登革病毒感染后发生。发热、肌肉痛、呕吐、头痛、腹痛、出血、低血压、心动过速、抽搐。 | 约 1-5% |
| 日本脑炎病毒(JEV) | 病毒性脑炎 | 发热、头痛、呕吐、神经功能障碍、肌肉无力、抽搐、失去运动功能。 | 约 25-30% |
| 西尼罗河病毒(MNV) | 西尼罗热,脑膜炎或脑炎 | 发热、头痛、恶心、呕吐、肌肉痛、腰背疼痛、失去运动功能。约80%的西尼罗河病毒感染者无症状,20%的人经历轻度发热综合症。 | 约 3-15% |
| 圣路易斯脑炎病毒 | 圣路易斯病毒性脑炎 | 大多数病例无症状或呈现类似流感的症状,如疲劳、头痛、恶心、呕吐和身体酸痛。 | 5-15% |
| 穆雷谷脑炎病毒(MVEV) | 穆雷谷病毒性脑炎 | 大多数感染者无症状。 | 15-30% |
| 寨卡病毒(ZIKV) | 与神经系统后遗症密切相关,最常见的是吉兰-巴雷综合症,还包括脑膜脑炎和脊髓炎。 | 症状通常较轻,包括发热、皮疹、结膜炎、肌肉和关节痛、乏力或头痛。 | 8.3% [12] |
| 蜱传脑炎病毒(TBEV) | 蜱传脑炎和终生的神经系统并发症 | 大多数TBEV感染者无症状,但有症状的病例通常具有神经系统表现,如脑膜炎、脑炎和脑膜脑炎,这些症状合称为蜱媒脑炎(TBE)[13][14]。 | TBEV-Eu 0.5–2% TBEV-Sib 2–3% TBEV-FE高于 40% [13][14] |
| 波瓦松病毒(POWV) | 波瓦松脑炎 | 大多数暴露者无症状或表现为类似流感的疾病,包括发热、头痛和轻度肌肉僵硬。 | 10% |
| 卢平病毒(LIV) | 垂直疾病,脑炎 | 大多数暴露者无症状或表现为类似流感的疾病,包括发热、头痛和轻度肌肉僵硬。 | 低于3% |
| 鄂木斯克出血热病毒(OHFV) | 鄂木斯克出血热,神经精神后遗症 | 它有第一阶段,发热、一般症状和出血为主。然而,在经历第二阶段的患者中,可能出现神经系统症状。 | 低于3% |
| 卡萨努尔森林病毒 | 卡萨努尔森林病 | 发热、头痛、严重肌肉疼痛、咳嗽、脱水和胃肠道不适。 | 2-10% |
传播途径
尽管大多数致病性黄病毒是通过感染的蚊子或蜱虫叮咬传播的,寨卡病毒(ZIKV)可以通过性接触从一个人传播到另一个人,也可以通过母亲传播到胎儿 [15]。此外,通过食用未经巴氏杀菌处理的受污染的乳制品也可以导致TBEV感染 [16]。大多数黄病毒都是人畜共患病毒,依赖非人类动物媒介来维持其生存、复制和传播,但登革病毒(DENV)主要在人类中传播。蚊子在人与人之间的传播仅在登革病毒、黄热病病毒和寨卡病毒这些通常使人类成为终宿主的引起疾病的病毒中有所报道。
参考文献:
[1] Pettersson J.H., Fiz-Palacios O. Dating the origin of the genus Flavivirus in the light of Beringian biogeography [J]. J. Gen. Virol. 2014;95:1969–1982.
[2] Westaway E.G., Brinton M.A., et al. Flaviviridae [J]. Intervirolgy. 1985;24:183–192.
[3] Strauss JH, Strauss EG. Virus evolution: how does an enveloped virus make a regular structure [J] Cell. 2001;105:5–8.
[4] Mukhopadhyay S, Kuhn RJ, et al. A structural perspective of the Flavivirus life cycle [J]. Nat Rev Microbiol2005;3:13–22.
[5] Chinmay G. Patkar, Christopher T. Jones, et al. Functional Requirements of the Yellow Fever Virus Capsid Protein [J]. J Virol. 2007 Jun; 81(12): 6471–6481.
[6] S L Allison, J Schalich, et al. Mutational Evidence for an Internal Fusion Peptide in Flavivirus Envelope Protein E [J]. J Virol. 2001 May;75(9):4268-75.
[7] F.X. Heinz, S.L. Allison. Structures and mechanisms in flavivirus fusion [J]. Adv. Virus Res, 55 (2000), pp. 231-269.
[8] S. Bressanelli, K. Stiasny, et al. Structure of a flavivirus envelope glycoprotein in its low-pH-induced membrane fusion conformation [J]. EMBO J., 23 (2004), pp. 728-738.
[9] Rice C. M., Lenches E. M., et al. Nucleotide sequence of yellow fever virus: implications for flavivirus gene expression and evolution [J]. Science 1985, 229:726–733.
[10] Rice C M. Flaviviridae: the viruses and their replication [J]. In: Fields B N, Knipe D M, Howley P M, Chanock R M, Melnick J L, Monath T P, Roizman B, Straus S E, editors. Virology. Philadelphia, Pa: Lippincott-Raven; 1996. pp. 931–595.
[11]G. Kuno, G.-J.J. Chang, K.R. Tsuchiya, N.Karabatso, C.B. CroppPhylogeny of the genus Flavivirus [J]. J. Virol, 72 (1998), pp. 73-83.
[12] C. Baronti, G. Piorkowski, et al. Complete coding sequence of Zika virus from a French Polynesia outbreak in 2013 [J]. Genome Announc, 2 (3) (2014), pp. e00500-e00514.
[13] Bogovic P., Strle F. Tick-borne encephalitis: A review of epidemiology, clinical characteristics, and management [J]. World J. Clin. Cases. 2015;3:430.
[14] Taba P., Schmutzhard E., Forsberg P., Lutsar I., Ljøstad U., Mygland A., Levchenko I., Strle F.,
[15] Steiner I. EAN consensus review on prevention, diagnosis and management of tick-borne encephalitis [J]. Eur. J. Neurol. 2017;24:1214-e61.
[16] Petersen LR, Jamieson DJ, et al. Zika Virus. N Engl J Med. 2016;374:1552–63.






