SARS-CoV-2感染会发生抗体依赖性增强吗?
日期:2023-12-11 13:46:42
在1964年,Hawkes等人证明了病毒在病毒特异性抗血清(具体是IgG抗体)的亚中和浓度下,包括虫媒病毒、穆雷河谷脑炎病毒、西尼罗河病毒(WNV)、日本脑炎病毒(JEV)和格他病毒等病毒的增强感染能力 [1]。这是首次描述的“抗体依赖性感染增强”(ADE)。ADE最早是由斯科特·哈尔斯特德(Scott Halstead)在1973年首次在登革病毒(DENV)感染中描述的 [2] [3]。此后还发现其他病毒也表现出ADE,包括流感A病毒、科萨奇病毒B、呼吸道合胞病毒、埃博拉病毒和人类免疫缺陷病毒(HIV)。
在本文中,我们将介绍ADE的定义、ADE的机制、ADE研究的意义、ADE是否在SARS-CoV-2感染中发生以及减少ADE风险的解决方案。
1. ADE的定义
病毒感染都是通过与细胞表面黏附开始的。黏附是通过病毒表面蛋白与目标细胞上特定受体之间的相互作用来完成的。病毒特异性抗体通常可以阻止这一步骤,或者“中和”病毒,使病毒失去感染细胞的能力 [4]。然而,在某些情况下,抗体并不是在病毒感染过程中防止病毒入侵人体细胞,而是辅助病毒进入目标细胞,增强病毒在体内的复制,并提高感染率,引发严重的病理反应。这种现象被称为病毒感染的抗体依赖性增强效应(ADE)。
发生ADE的病毒多半在巨噬细胞内增殖,并易导致宿主持续感染。常规疫苗通常难以预防和治疗这类病毒性疾病 [5],在某些情况下已被证明会增加疫苗接种者感染的风险。
2. 抗体依赖性增强的机制
ADE有两种机制,这两种机制都发生在非中和抗体或亚中和浓度的抗体与病毒抗原结合而未防止或清除感染的情况下。抗体-病毒复合物通过IgG抗体的Fc部分与Fcγ受体(FcγR)或补体受体之间的相互作用附着在细胞上,并增加了病毒的内吞作用,导致病毒复制增强和疾病严重性加剧。一种是FcγR介导的ADE(FcγR-ADE),涉及病毒、抗体和细胞表面的FcγR;另一种是补体介导的ADE(C-ADE),与病毒、抗体、补体和补体受体有关。
2.1 FcγR介导的ADE
在1977年,斯科特·哈尔斯特德(Scott Halstead)等人发现,一些感染了一种登革病毒血清型的人,可能在与异源性登革病毒血清型的二次感染时发展出严重疾病,并将登革病的临床严重程度与ADE联系起来 [6] [7]。这是关于片段结晶区受体(FcR)介导的ADE的首次报道。FcR依赖性ADE被认为是ADE的最常见机制。ADE是在抗体结合的病毒通过Fc-FcγR相互作用与携带FcγR的细胞(包括巨噬细胞、单核细胞、树突状细胞、中性粒细胞、白细胞和粒细胞)结合时开始的,通过FcγR介导的内吞作用或吞噬作用促进抗体包被的病毒进入细胞 [8]。FcR介导的ADE在许多病毒中都有发现,包括人类免疫缺陷病毒(HIV)、阿留申貂细小病毒、呼吸道合胞病毒、西尼罗河病毒和流感A病毒。
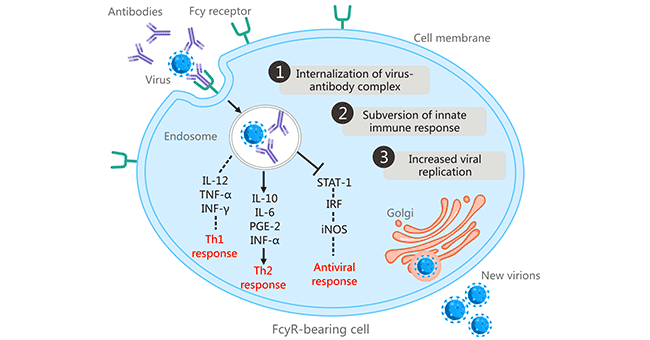
图1. fcr介导的抗体依赖性增强
图片来自https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6290032/
2.2 补体介导的ADE
在补体介导的ADE中,补体包被蛋白C1q结合到与病毒结合的抗体的Fc区域上 [9],这改变了C1s C1r复合物的构象,激活了C1s C1r复合物。激活的C1s裂解补体C2和C4,所产生的裂解产物形成了C3转换酶(C4bC2a)。C3转换酶将C3裂解为C3a和C3b。高反应性的C3b与病毒和携带CR的细胞上的CR结合,通过吞噬作用导致病毒进入细胞,从而增强病毒复制并加重疾病严重性 [10]。C1q受体不仅分布在炎症性单核/巨噬细胞上,还分布在其他不同类型的细胞上,包括B细胞、成纤维细胞、中性粒细胞和内皮细胞。这种机制是西尼罗河病毒和HIV中ADE的基础。
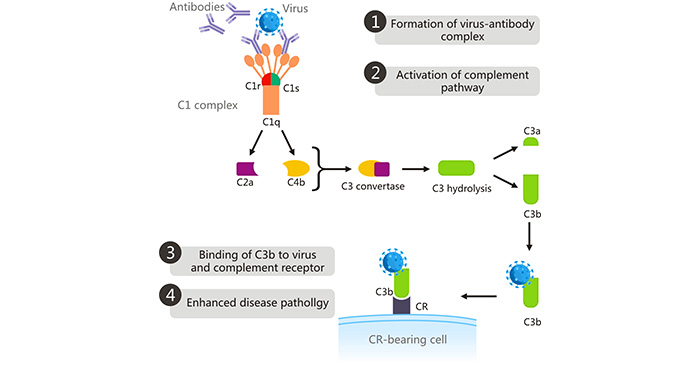
图2. 补体介导的ADE
图片来自https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6290032/
除了常见的FcR介导的ADE外,埃博拉病毒(EBOV)已被发现可利用补体成分C1q引发感染的ADE。这种机制通过交联病毒-抗体-C1q复合物与细胞表面C1q受体结合来介导,从而增强病毒进入细胞。在C1q依赖的ADE中,两个或更多的IgG单体抗体从病毒-抗体复合物突出,与C1q结合形成病毒-抗体-C1q复合物 [11]。病毒-抗体-C1q复合物与靶细胞上的C1q受体结合,触发Wnt/β-catenin、PI3K和一些酪氨酸激酶等信号通路,促进通过内吞作用使抗体包被的病毒进入靶细胞。在某些情况下,C1q在HIV感染背景下直接结合到病毒的外膜糖蛋白gp41上。
3. ADE研究的意义
不同病毒感染的ADE效应与目标细胞类型、目标细胞的分化和成熟程度以及分化程度有关。此外,研究发现ADE效应是否在病毒感染中发生也与病毒感染和被动免疫之间的时间间隔有关。如果特异性抗体与病毒同时注射动物,大多数情况下可以发挥协调的保护作用。在感染病毒后注射抗体,甚至中和抗体也可能增强病毒的毒力。
更好地了解ADE的各种机制在确定与病毒相关的抗原决定因素方面起着关键作用。针对并修改这些抗原决定因素将有助于开发更安全、更有效的疫苗。更重要的是,ADE效应的性质是机体免疫调节效应的一部分。清晰的机制可能为发展针对具有明确病原体感染的传染病的新药提供机会和方向。
然而,我们仍然可以理解,ADE对于未来免疫治疗,尤其是针对病原体感染引起的传染病的疫苗开发具有深远和启发性的意义。在未来,医学领域仍将聚焦于这一热点话题,并为研究和开发新药提供更多信息。
4. SARS-CoV-2感染或COVID-19疫苗接种是否存在抗体依赖增强迹象?
由于COVID-19疫苗引起的ADE效应一直是公众关注的焦点。最新的科学研究发现,在体外,能中和病毒和增强感染的受体结合区(RBD)抗体或感染增强的N端区(NTD)抗体可以在非人灵长类动物和小鼠中保护免受SARS-CoV-2感染 [17]。与引发病毒载量和炎症增加等显著疾病恶化不同,这些抗体展现了部分保护效果。文章的作者认为,SARS-CoV-2在巨噬细胞中无法有效复制(Fc介导的ADE抗体主要进入巨噬细胞),而Fc介导效应带来的保护效果可能有助于这个实验结果。总之,现有的证据不足以支持SARS-CoV-2感染或COVID-19疫苗接种会引发明显的ADE效应。
虽然在MERS-CoV和SARS-CoV感染中已经显示出ADE,但迄今尚未有关于SARS-CoV-2感染或COVID-19疫苗接种引发ADE的确认报告。在人类研究中,之前感染过冠状病毒的人在感染不同类型的冠状病毒后并未出现增强的疾病。在COVID-19疫苗开发过程中,科学家采取了几种方法来避免ADE。例如,在早期疫苗设计中选择最不可能引发ADE的SARS-CoV-2蛋白质作为抗体靶点。对动物进行疫苗接种以观察是否发生ADE。评估临床试验中人类和患者的情况。在实际COVID-19疫苗数据中寻找案例。
5. 减少ADE风险的解决方案
ADE已在40多种病毒中被确认。它对病毒感染的抗体治疗和疫苗开发产生了负面影响。抗体疫苗和疗法的一个潜在障碍是通过ADE加剧疾病的严重性的风险。已经证明ADE参与了许多病毒感染的疾病加重,包括寨卡病毒、埃博拉病毒 [12]、呼吸道合胞病毒(RSV)、麻疹、SARS-CoV和MERS-CoV。呼吸道感染中的ADE被包含在更广泛的类别中,称为增强型呼吸道疾病(ERD),还与细胞因子级联和细胞介导的免疫病理学等非抗体机制有关。
疫苗是针对健康个体的常规医学干预措施,因此在开发新疫苗时必须考虑ADE现象,以确保疫苗具有保护作用且不会对接种者造成伤害。疫苗开发者寻求方法来降低ADE的可能性。
在冠状病毒感染中降低ADE风险的方法有几种。第一种方法是诱导或提供高剂量的强效中和抗体。Wan等人指出,高剂量的抗体可以在MERS-CoV中抑制ADE,而不会干扰其抗病毒能力 [13]。第二种方法是在早期疫苗设计中选择最不可能引发ADE的病毒蛋白作为抗体靶点。对于SARS-CoV-2来说,选择刺突(S)蛋白的受体结合区(RBD)内的特定表位作为中和抗体反应的靶点。令人鼓舞的是,一些早期临床试验展示了强烈的中和抗体反应和强大的Th1反应,而不是与免疫病理相关的Th2反应 [14]。利用一些抑制剂还有助于降低ADE的风险。蛋白酶抑制剂和Fc抑制剂已被证明在MERS-CoV和SARS-CoV中发挥了抑制作用 [13][15][16]。此外,通过修改抗体Fc区域上的FcγR结合位点来降低登革病毒的ADE风险。
参考文献:
[1] Hawkes R. A. Enhancement of the infectivity of arboviruses by specific antisera produced in domestic fowls [J]. Aust. J. Exp. Biol. Med. Sci. 1964, 42, 465–482.
[2] Halstead, S. B., Chow, J. & Marchette, N. J. Immunologic enhancement of dengue virus replication [J]. Nat. New Biol. 243, 24–25 (1973).
[3] Halstead, S. B., Shotwell, H. & Casals, J. Studies on the pathogenesis of dengue infection in monkeys [J]. II. Clinical laboratory responses to heterologous infection. J. Infect. Dis. 128, 15–22 (1973).
[4] Dutta, A, Huang, CT, et al. (2016). Sterilizing immunity to influenza virus infection requires local antigen-specific T cell response in the lungs [J]. Scientific Reports. 6: 32973.
[5] Wang Q., Zhang L., et al. Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates [J]. ACS Infect Dis. 2016; 2: 361-376.
[6] Halstead SB, O'Rourke EJ. Dengue viruses and mononuclear phagocytes. I. Infection enhancement by non-neutralizing antibody [J]. J Exp Med 1977;146(1):201–17.
[7] Halstead SB. Immune enhancement of viral infection [J]. Prog. Allergy31, 301–364 (1982).
[8] Taylor A., Foo S. S., et al. Fc receptors in antibody-dependent enhancement of viral infections [J]. Immunol. Rev. 2015, 268, 340–364.
[9] Diebolder CA, Beurskens FJ, et al. Complement is activated by IgG hexamers assembled at the cell surface [J]. Science. (2014) 343:1260– 3.
[10] Takada A., Kawaoka Y. Antibody-dependent enhancement of viral infection: molecular mechanisms and in vivo implications [J]. Rev. Med. Virol. 2003, 13, 387–398. (complement dependent ADE)
[11] von Kietzell K., Pozzuto T., et al. Antibody-mediated enhancement of parvovirus B19 uptake into endothelial cells mediated by a receptor for complement factor C1q [J]. J Virol. 2014; 88: 8102-8115.
[12] Takada, A., Feldmann, H., et al. Antibody-dependent enhancement of Ebola virus infection [J]. J. Virol. 77, 7539–7544 (2003).
[13] Y. Wan, J. Shang, et al. Molecular mechanism for antibody-dependent enhancement of coronavirus entry [J]. J Virol, 94 (5) (2020).
[14] Anderson EJ, Rouphael NG, Widge AT, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults [J]. N Engl J Med 2020; 383:2427-2438.
[15] L. Liu, Q. Wei, et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection [J]. JCI Insight, 4 (4) (2019).
[16] Jieqi Wen, Yifan Cheng, et al. Antibody-dependent enhancement of coronavirus [J]. International Journal of Infectious Diseases, Volume 100, November 2020, Pages 483-489.
[17] Dapeng Li, Robert J Edwards, et al. The functions of SARS-CoV-2 neutralizing and infection-enhancing antibodies in vitro and in mice and nonhuman primates [J]. Version 2. bioRxiv. Preprint. 2021 Jan 2 [revised 2021 Feb 18].











