NRP1增强SARS-CoV-2感染能力的新机制
日期:2023-12-11 13:08:34
SARS-CoV-2感染的爆发引发了与COVID-19相关的全球大流行。随着对病毒侵入机制的研究深入进行,一些潜在的机制已经被揭示出来。早在二月初,SARS-CoV-2侵入人体细胞的关键被确定:SARS-CoV-2-S与细胞表面的ACE2结合(更多信息);二月中旬,人体细胞中的TMPRSS2可以裂解ACE2和刺突蛋白的细胞表面蛋白酶,在病毒侵入过程中发挥了“协助”作用;三月,发现了第二条入侵途径:细胞表面的CD147。
最近,在2020年10月20日,两篇论文同时发表在《Science》杂志上。两个科研团队发现除了众所周知的ACE2受体外,寄主细胞上另一个受体称为 Neuropilin-1(NRP1)也会与SARS-CoV-2的S蛋白相互作用 [1] [2]。这一突破性的发现不仅有助于我们理解为何SARS-CoV-2比SARS病毒更具传染性并引发更复杂的症状,还指出了新的潜在靶点,对于开发抗SARS-CoV-2药物具有重要意义。
那么 Neuropilin-1是什么?SARS-CoV-2如何通过 Neuropilin-1侵入人体?您可以在以下内容中找到这些信息。
1. Neuropilin-1的定义
Neuropilin-1,又称为血管内皮细胞生长因子165受体(VEGF165R)、CD304,属于神经粘蛋白家族。神经粘蛋白(NRPs)最早由Takagi等人在爪蟾的神经组织冰冻切片中通过免疫荧光染色首次发现,并确认其为一种非酪氨酸激酶跨膜糖蛋白。NRPs家族中首次发现并引起关注的是NRP-1。
NRP-1分为两种形式,膜型 Neuropilin-1(mNRP-1)和可溶性 Neuropilin-1(sNRP-1)。众所周知,NRP-1通常指的是mNRP-1。如图1所示,mNRP-1具有较大的N末端细胞外区域,一个短的跨膜区域,以及一个小的胞内细胞质区域,作为I型单通道跨膜蛋白[3]。
细胞外区域由三个部分组成:一个N末端的互补结合CUB(a1/a2)结构域,b1/b2结构域和meprin或MAM(c)结构域[4]。a1/a2结构域(或CUB结构域)在补体系统中介导蛋白质的相互作用。b1/b2结构域与凝血因子V和VIII的C1/C2结构域具有同源性。c结构域参与受体的二聚化。c结构域对于NRP-1的共受体活性至关重要。
短的跨膜螺旋结构域包含一个保守的GXXXG重复序列,据报道它能够介导NRP-1的二聚化潜力,与c结构域一起。NRP-1的小的胞内片段缺乏酪氨酸激酶活性,但具有与PDZ蛋白相互作用的C末端SEA(Ser-Glu-Ala-COOH)基序,促进细胞内信号转导。
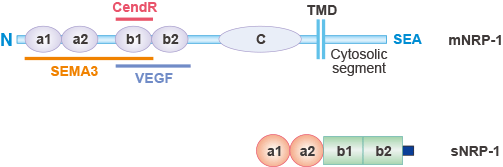
图1. Neuropilin-1 (NRP1)的结构
*该图片来源于Current Pharmaceutical Design的出版物 [3]
sNRP-1是一种相对分子质量约为9x104的蛋白,包含a1/a2和b1/b2结构域,但缺乏c结构域、跨膜区和胞内区。它是由NRP-1基因选择性剪接产生的。它可以分泌到细胞外,进入血液循环,结合并抑制VEGF,从而负调控这些途径介导的功能[5][6]。然而,sNRP-1的作用可能比简单的诱骗作用更为复杂,sNRP-1的全部功能尚未完全了解[7]。
2. Neuropilin-1的功能
神经粘蛋白(NRPs)是一类单通道、非酪氨酸激酶表面糖蛋白,广泛存在于所有脊椎动物中,种类间高度保守。已知存在两种同源的NRP亚型,即NRP1和NRP2。这两种NRPs最初被发现是神经元粘附分子。后来,它们被发现与血管生物学有关。正常的胚胎血管发育需要NRP1和NRP2参与小淋巴管和毛细血管的形成。过去10年的研究表明,NRP是一种多功能蛋白质,除神经和血管发育外,还参与多种生物过程。其中,NRP1在免疫和肿瘤发生中发挥关键作用。
Neuropilin-1之所以成为多功能信号传导跨膜蛋白,是因为神经粘蛋白1作为一种共受体与多种细胞外配体相互作用,包括Sema3(与NRP-1的a1/a2和部分b1/b2结构域结合)、生长因子VEGF-A/B/D/E、胎盘生长因子2、HGF、TGF-B1、bFGF和PDGF(与NRP-1受体的b1/b2结构域结合)以及膜受体(如丝状蛋白、VEGF受体、PDGF受体和TGF受体,与NRP-1受体的b1/b2和c结构域结合)[8] [9]。此外,NRP-1还可以与其他跨膜蛋白相互作用,如整合素αvβ3和β1,从而激活一系列信号传递途径。
3. Neuropilin-1与SARS-CoV-2入侵的关系
与引起普通感冒和轻微呼吸道症状的其他冠状病毒不同,引起COVID-19的SARS-CoV-2具有高度的传染性和传播性,并且临床上COVID-19的非典型症状还包括味觉和嗅觉障碍、中风等。但是,先前的研究结果(ACE2、CD147和TMPRSS2-S蛋白)难以解释为什么SARS-CoV-2容易感染呼吸系统以外的器官,比如大脑和心脏?这个问题促使科学家进一步研究SARS-CoV-2。
与SARS病毒不同,SARS-CoV-2的S蛋白在S1/S2界面上呈现多碱性序列基序RRAR。这个基序提供了一个酶切位点,叫做furin(一种宿主前蛋白酶)[10] [11]。因此,人体内的furin可以将S蛋白切割成两个亚单位,S1和S2。当研究人员观察SARS-CoV-2 S1序列时,他们发现该序列的一个片段与人体蛋白中与NRP1相互作用的蛋白序列非常相似。基于这一发现,研究人员提出了一个简单的假设:SARS-CoV-2 S1能否与NRP1结合,进一步帮助病毒感染人体细胞?然后,两个研究团队通过不同的方法证实了这一假设。
德国慕尼黑工业大学的一个研究团队使用体外培养的细胞证明,在ACE2存在的情况下,NRP-1可以促进病毒感染。一个具有改变酶切位点的SARS-CoV-2突变体不依赖于NRP1的感染能力。此外,对人类COVID-19尸检的病理分析显示,SARS-CoV-2感染的细胞,包括面对鼻腔的嗅神经元,NRP1呈阳性。Simons教授解释说,如果将ACE2视为细胞的入口,那么NRP1可能是将病毒带到细胞门口的因素。
英国布里斯托大学的另一个研究团队也通过一系列结构和生化方法确定了SARS-CoV-2 S1与NRP1直接结合。更重要的是,这两个研究团队在体外培养的人类细胞系中使用针对NRP1的单克隆抗体或选择性NRP1抑制剂阻止了S蛋白与NRP1之间的相互作用。实验结果显示,SARS-CoV-2的感染能力显著降低。
4. Neuropilin-1与癌症
神经粘蛋白1(NRP1)在哺乳动物体内的神经元、血管、免疫细胞和许多其他细胞类型中都有表达。它结合了一系列结构和功能多样的细胞外配体,以调节器官的发育和功能。近年来,已开发了几种类型的小鼠基因敲除模型,为研究NRP1功能提供了有用的工具,并设计了大量以癌症治疗为目的的靶向NRP1的治疗药物,其中大部分是为了探索癌症治疗而设计的[12]。
在小鼠中,NRP1选择性地在胸腺源性T调节细胞上表达,并极大地增强了免疫抑制功能。在人体中,NRP1在浆细胞样树突细胞(pDCs)上表达,有助于启动免疫反应,并在某些调节性T细胞(Tregs)的亚群上表达[13] [14]。初步研究表明,T细胞上的NRP1表达使其具有增强的免疫抑制活性[15]。已在炎症微环境中分离出的激活T细胞和Tregs上鉴定出NRP1的表达。这些研究表明,NRP1可能是一种新的T细胞激活标记。在临床方面,NRP1可能增强Treg肿瘤浸润,NRP1+ Tregs的减少与成功的化疗相关,提示NRP1在癌症病理中具有特定作用。作为一个治疗靶点,NRP1可以同时靶向NRP1表达的肿瘤血管、NRP1+ Tregs和pDCs [16] [17] [18]。
目前已知,靶向NRP1的抗肿瘤治疗可以通过不同的工具实现,包括sNRP-1、单克隆抗体、肽和肽类似物、小干扰RNA或微RNA以及细胞穿透肽[19] [20]。NRP1代表了癌症治疗的一个有前途的新靶点。目前,一种名为Vesencumab的单克隆抗体已由Genentech Inc.开发并进行了临床试验。
参考文献:
[1] James Daly et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection [J]. Science. 2020.
[2] LUDOVICO CANTUTI-CASTELVETRI et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity [J]. Science. 2020.
[3] Lukui Chen, Guilong Zhang, et al. Neuropilin-1 (NRP-1) and Magnetic Nanoparticles, a Potential Combination for Diagnosis and Therapy of Gliomas [J]. Curr. Pharm. Des. 2015, 21(37): 5434-5449.
[4] Gu CH, Limberg BJ, et al. Characterization of neuropilin-1 structural features that confer binding to semaphorin 3A and vascular endothelial growth factor 165 [J]. J Biol Chem 2002, 277(20): 18069-76.
[5] Cackowski FC, Xu L, et al. Identification of two novel alternatively spliced neuropilin-1 isoforms [J]. Genomics 2004; 84(1): 82-94.
[6] Uniewicz KA, Cross MJ, et al. Exogenous recombinant dimeric neuropilin-1 is sufficient to drive angiogenesis [J]. J Biol Chem 2011; 286(1): 12-23.
[7] Belal Chaudhary, Yazan S. Khaled, et al. Neuropilin 1: function and therapeutic potential in cancer [J]. Cancer Immunol. Immunother. 2013.
[8] Graziani G, Lacal PM. Neuropilin-1 as Therapeutic Target for Malignant Melanoma [J]. Front Oncol. 2015, 3;5:125.
[9] Yaqoob U, Cao S, et al. Neuropilin-1 stimulates tumor growth by increasing fibronection fibril assembly in the tumor microenvironment [J]. Cancer Res. 2012, 72(16): 4047-4059.
[10] D. Wrapp, N. Wang, K. S. Corbett, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation [J]. Science. 2020, 367, 1260–1263.
[11] M. Hoffmann, H. Kleine-Weber, et al. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells [J]. Mol. Cell. 2020, 78, 779–784.e5.
[12] Claudio Raimondi, James T. Brash, et al. NRP1 function and targeting in neurovascular development and eye disease [J]. Progress in Retinal and Eye Research. 2016, 1-20.
[13] Romeo PH, Lemarchandel V, et al. Neuropilin-1 in the immune system [J]. Adv Exp Med Biol. 2002, 515:49–54.
[14] Tordjman R, Lepelletier Y, et al. A neuronal receptor, neuropilin-1, is essential for the initiation of the primary immune response. Nat Immunol. 2002, 3(5):477–482.
[15] Yuan Q, Hong S, et al. CD4(+)CD25(−)Nrp1(+) T cells synergize with rapamycin to prevent murine cardiac allorejection in immunocompetent recipients [J]. PLoS ONE. 2013, 8(4):e61151.
[16] Chaudhary B, Elkord E. Novel expression of Neuropilin 1 on human tumor-infiltrating lymphocytes in colorectal cancer liver metastases [J]. Expert Opin Ther Targets. 2015, 19 (2): 147-161.
[17] Bourbie-Vaudaine S, Blanchard N, et al. Dendritic cells can turn CD4+ T lymphocytes into vascular endothelial growth factor-carrying cells by intercellular neuropilin-1 transfer [J]. J Immunol. 2006, 177(3):1460–1469.
[18] Battaglia A, Buzzonetti A, et al. Neuropilin-1 expression identifies a subset of regulatory T cells in human lymph nodes that is modulated by preoperative chemoradiation therapy in cervical cancer [J]. Immunology. 2008, 123(1):129–138.
[19] Teesalu T, Sugahara KN, et al. Tumor-penetrating peptides [J]. Front Oncol. 2013, 3:216.
[20] Teesalu T, Sugahara KN, et al. C-end rule peptides mediate neuropilin-1-dependent cell, vascular, and tissue penetration [J]. Proc Natl Acad Sci USA. 2009, 106(38):16157–16162.











