不可小觑的流感
日期:2023-12-18 09:53:51
流感,也被称为流感或者感冒,是一种影响上呼吸道系统(包括肺部、喉咙和鼻子)的传染性病毒性疾病。流感是一种常见的呼吸道感染,在人类、猪、马以及其他家禽和野鸟中都有发现。它以迅速的发病、快速的传染、广泛的传播以及对人类生命安全的威胁为特点。根据国际疾病分类icd-10,流感的疾病编码为j11-101。
1. 流感病史
流感,又称为流行性感冒或流行性感冒,是一种影响上呼吸道系统,包括肺部、喉咙和鼻子的传染性病毒性疾病。1733年,Gagliarde将其命名为“流感”。术语“流感”首次于1743年出现在英国[1]。
自6世纪以来,几乎每个世纪都有流感流行的记录。1918年的流感(所谓的西班牙流感)是迄今为止世界上最具毁灭性的大流行病,感染了全球超过一半的人口,造成估计2000万到5000万人死亡。流感席卷了欧亚大陆,并侵袭了非洲和大洋洲[2]。此外,20世纪发生了三次流感大流行,分别发生在1946至1947年、1957至1958年(亚洲流感)以及1968至1969年(香港流感)。1957年和1968年的大流行分别导致400多万人死亡和100多万人死亡(38252人)。
2. 流感病毒的分类
流感病毒是Orthomyxoviridae家族的RNA病毒。流感病毒呈球形,新分离的菌株大多呈丝状,直径在80到120纳米之间,丝状流感病毒长度可达400纳米。流感病毒包括人类流感病毒和动物流感病毒。人类流感病毒分为A型、B型和C型,是流感的病原体。
2.1 A型流感病毒
A型流感病毒是一种具有八个基因片段的RNA病毒,属于Orthomyxoviridae家族。所有流感A亚型都已知存在于鸟类中,特别是水禽,该病毒还可以感染其他动物,如猪、马、海豹、鲸鱼和水貂。
● 结构
A型流感病毒基因组由八个基因片段编码10种蛋白质:血凝素(HA)、神经氨酸酶(NA)、基质蛋白M2和M1、非结构蛋白NS1和NS2、核壳蛋白以及三种A聚合酶PB1(聚合酶碱基1)、PB2和PA(聚合酶酸)蛋白质[3]。根据其表面血凝素(HA)和神经氨酸酶(NA)的蛋白质结构,它可以分为许多亚型。到目前为止,A型流感病毒已发现16个血凝素亚型和9个神经氨酸酶亚型。
● A型病毒的例子
禽流感:禽流感(AI)是一种A型流感病毒。禽流感病毒通常只感染鸟类。这种种间传播障碍被认为是由多种病毒遗传决定因子决定的,包括病毒HA和NA基因,以及其他内源性基因,如核蛋白和PB2基因。当病毒在复制过程中发生基因重排,导致结构改变,就有可能获得感染人类的能力。可以直接感染人类的禽流感病毒亚型有:H5N1、H7N1、H7N2、H7N3、H7N7、H9N2和H7N9亚型。
猪流感:猪流感(SI)是由猪流感病毒引起的急性、高度传染性的猪呼吸道疾病,广泛流行于猪群中。猪流感病毒是一种A型流感病毒。主要的病毒类型包括经典猪H1N1型、禽H1N1型和人类H3N2型。
人类流感病毒和禽流感病毒在猪体内建立了稳定的病毒谱系,这可能反映了猪上皮细胞中既有禽流感病毒受体又有人类流感病毒受体的存在[4]。因此,猪被认为是通过重组产生大流行性流感病毒的可能中间宿主(混合容器)。研究[6]表明,H1N1病毒基因组是由禽流感、猪流感和人类流感病毒基因混合而成的。
● 流感A病毒的变异
A型流感病毒常常具有抗原变异,具有高度的传染性和快速的传播能力,容易引发大规模流行。历史上许多流感大流行都是由A型流感病毒引起的。
A型流感病毒的变异体现在通过基因重组生成新的病毒类型。1957年大流行和1968年大流行的流感病毒就是通过基因重组产生的[7] [8] [9]。相比之下,1918年的大流行被认为是由纯粹的禽流感病毒直接适应人类进行有效传播而引起的[10]。
因此,大流行性流感病毒是一种人兽共患病,禽流感病毒在其中发挥了关键作用。
此外,流感病毒RNA在复制过程中没有纠错功能,其突变频率高于其他病毒。这也是流感病毒变异的主要原因。
2.2 B型流感病毒
除感染人类外,尚未发现其他自然宿主。B型流感病毒通常会引发局部爆发,不会引发全球性流感大流行。流感B和C病毒的命名方式与流感A病毒相同,但没有亚型。
2.3 C型流感病毒
它可以感染猪和人类。C型流感病毒主要以分散的形式出现,主要影响婴儿,通常不会引发大流行。
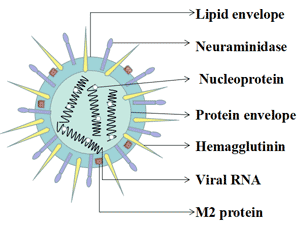
图1. 流感病毒的典型结构特征
3. 流感细菌
流感嗜血杆菌:大多数流感嗜血杆菌是机会性感染,即它们在宿主体内存活而不引发任何疾病,但当出现某些因素(如病毒感染或免疫功能下降)时,它可以引发疾病。流感嗜血杆菌自然产生的疾病仅发生在人类体内。在婴儿和儿童中,B型流感嗜血杆菌可以引发菌血症和急性细菌性脑膜炎。
4. 流感的病因
病理特点:呼吸道纤毛上皮细胞的聚集脱落,上皮细胞的化生,基底层细胞的充血,伴有单核细胞浸润的水肿。
流感传播:流感具有传染性,主要通过空气飞沫传播。它还可以通过口腔、鼻子、眼睛等黏膜直接或间接传播。接触患者的呼吸道分泌物、体液和受污染的物品也可能导致感染。通过气溶胶在呼吸道中的传播尚待确认。
感染源:流感患者和潜伏感染是流感的主要感染源。从潜伏期末到急性发作阶段都具有传染性。
4.1 流感发病机制
一方面,流感病毒颗粒的飞沫被吸入呼吸道时,病毒的神经氨酸酶破坏了唾液酸,使粘蛋白水解,糖蛋白受体暴露。流感A和B病毒的血凝素(HA)结合到含有唾液酸受体的上皮细胞表面,以启动感染。
另一方面,流感病毒通过细胞内内吞作用进入细胞。病毒包膜上的M2多肽离子通道在酸性pH下被激活,使核衣壳蛋白释放到细胞质中(解壳)。核衣壳蛋白被运输到宿主细胞核中,其中病毒基因组被转录和复制。合成的病毒核蛋白进入细胞核,并与病毒RNA结合形成核衣壳,然后被导出到细胞质。在完全加工和修饰后,病毒膜蛋白嵌入细胞膜,并以嵌顶方式释放子病毒颗粒(分裂)。最后,宿主蛋白酶水解HA成HA1和HA2,使病毒颗粒具有传染性。

图2. 流感发病机制
5. 由流感病毒引起的相关疾病
流感的常见症状和体征包括:流感的特点是发病迅速,喉咙痛、咳嗽和流涕,伴随发热、寒战、头痛、虚弱、鼻塞、疲劳和肌肉、关节疼痛。
5.1 临床分型
● 简单型流感。
● 肺炎型流感:本质上是由流感引起的流感病毒肺炎,在老年人、儿童和心肺疾病患者中更为常见。
● 中毒性流感:表现为高热、休克、呼吸衰竭、中枢神经系统损害和弥散性血管内凝血(DIC)等严重症状,病死率高。
● 胃肠道流感:发热、呕吐、腹痛和腹泻是显著特征。
5.2 并发症
感染流感会降低身体的抵抗力,使身体容易受到微生物和病毒感染,导致并发症的发生。
● 流感和肺炎
流感最常见的并发症是肺炎,而流感是肺炎球菌肺炎最严重的形式。肺炎球菌与流感相关死亡之间存在重要的协同致死效应。其他研究已证实,在1918年流感大流行中,约50%的死于肺炎的患者患有肺炎球菌败血症。
其他类型的肺炎:细菌性肺炎、真菌性肺炎;其他病毒性肺炎(鼻病毒、冠状病毒、呼吸道合胞病毒、副流感病毒)
● 流感肌炎
常在儿童流感后发生,特点是小腿或大腿肿胀,肌肉严重疼痛和触痛,症状一周后自行缓解。该疾病与流感A和B病毒的传播有关,散发性感染或副流感病毒感染。
● 流感脑膜炎
流感嗜血杆菌脑膜炎是一种危及儿童健康的严重疾病。流感嗜血杆菌是全球儿童细菌性脑膜炎的主要致病菌之一,其具有高发病率和高致残率的特点。H1型脑膜炎的发病年龄较小,高危年龄段为8月龄至4岁,尤其是2岁以下。这与儿童在此期间的体液免疫特点有关。
6. 易感人群
易于发展流感并发症的高风险人群包括:
孕妇。孕期被确定为严重H1N1病毒相关疾病的危险因素[11]。这些人群更容易患上呼吸道并发症(肺部疾病),与未怀孕的女性相比,住院和死亡率较高[12]。这可能与免疫反应有关,因为孕妇和肥胖患者的免疫功能受损。
以下疾病或情况的患者。慢性呼吸道疾病、心血管疾病(高血压除外)、肾脏疾病、肝脏疾病、血液系统疾病、神经系统和神经肌肉疾病、代谢和内分泌疾病、免疫功能抑制。
肥胖人士。体重指数(BMI)>30(BMI=体重(千克)/身高(米))。流行病学数据确认肥胖是严重流感a(H1N1 pdm09)感染的发病率和死亡率增加的危险因素[13] [14]。
5岁以下的儿童(2岁以下的年龄更容易出现严重并发症)。在流感季节,健康儿童可能表现为轻微的流感。主要症状包括发热、咳嗽、流涕、鼻塞、喉咙痛、头痛,少数病例会出现肌肉疼痛、呕吐和腹泻。
65岁及以上的老年人。由于老年人常患有呼吸系统、心血管系统等原发性疾病,因此老年人感染流感病毒更容易出现严重疾病,疾病进展迅速,肺炎发病率高于年轻成年人。
7. 诊断
流感疾病的诊断通常基于病因、临床表现和实验室检查。
7.1 流感检测
外周血检。白细胞总数通常减少,淋巴细胞数增加。如果合并细菌感染,则白细胞计数和中性粒细胞增加。
血液生化检查。在某些病例中会出现低钾血症,少数情况下会出现肌酸激酶、天门冬氨酸转氨酶、丙氨酸转氨酶、乳酸脱氢酶和肌酐升高。
病原体检查。主要包括病毒分离、病毒抗原、核酸和抗体检测。病毒分离是实验室检测的主要方法;病毒抗原和核酸检测可用于早期诊断;抗体检测可用于回顾性调查,但对于病例的早期诊断意义不大。
影像学检查。部分患者可能出现支气管感染的征象,伴有支气管纹理增加。在重症病例中,可能出现肺浸润性病变或胸腔积液,甚至融合成片。
8. 如何预防流感?
流感能够在人与人之间高效传播,因此积极预防和控制比有限的有效治疗更为重要。
8.1 疫苗接种
疫苗被认为是预防流感的最有效方法。疾病控制和预防中心(CDC)建议所有6个月及以上的人接种流感疫苗。每年的季节性流感疫苗包含对预计在当年流感季节中最常见的三种或四种流感病毒的保护。接种流感疫苗的最佳时间是在年度流感季节开始之前。
流感疫苗的类型。全病毒灭活流感疫苗、裂解灭活流感疫苗、冷适应活减疫苗和基于流感表面糖蛋白分子HA和NA的亚单位疫苗(主要产生针对HA和NA的特异性抗体)。
通用流感疫苗。流感病毒的迅速变异严重限制了疫苗的长期保护。现有的流感疫苗不能在不同亚型之间诱导交叉保护,面临着时效性和有效性的问题。
Corti等人[15]在《科学》上发表了一项流感研究的结果,即一种超级抗体FI6可以中和所有流感A病毒。该抗体是从人体浆细胞中分离出来的,通过动物实验证实可以保护免受整个流感A病毒的侵害。这一结果可能是发展通用流感疫苗的一个转折点。
2018年,美国过敏和传染病研究所启动了通用流感疫苗战略计划。在研究通用流感病毒方面,首要关注的是流感A病毒所有抗原中高度保守的M2和NP蛋白,这是目前通用流感疫苗的主要候选抗原。M2蛋白是跨膜蛋白,NP蛋白是核衣壳蛋白RNP的主要成分。目前,基于M2、M2e和NP开发的疫苗包括融合蛋白亚单位疫苗[16]、DNA疫苗[17] [18]、重组病毒样颗粒(VLP)疫苗[19]和肽疫苗[20] [21]。这些基于M2、M2e和NP的疫苗可以在动物模型中诱导产生对不同类型或亚型病毒的广谱交叉免疫保护。
流感疫苗剂量。至35个月的儿童需要接种两剂,每剂0.25毫升,间隔一个月。36个月以上的儿童和成年人需要接种1剂,每剂0.5毫升。儿童和成年人都在上臂三角肌肉上注射肌肉。永远不要静脉注射。
疫苗接种可能引起一些症状,例如流感荨麻疹,由流感疫苗引起。
禁止接种的人群
对疫苗中的鸡蛋或其他成分过敏(如新霉素)。
格林-巴利综合症患者。
孕妇。然而,针对孕妇疫苗的安全性的最近研究表明,标准的三价灭活流感疫苗(TIV)对孕妇是安全的[22] [23]。在北半球和欧洲部分地区,建议所有孕妇接种三价灭活流感疫苗(TIV)[24]。
急性发热病患者。
严重过敏体质者。
医生认为不适合接种的人。
目前,全球范围内流感疫苗接种率普遍较低。在发达国家,流感疫苗的接种率约为30-40%。除了疫苗外,流感监测网络对于预防流感爆发也很重要。
8.2 流感监测网络
2018年,全球病毒组计划启动,流感流行是该项目的一个重要方向。事实上,早在1952年,世界卫生组织(WHO)就建立了全球流感监测网络。此前,谷歌趋势能够根据用户搜索关键词的指数确定某个地区的流感流行程度。
8.3 控制传播
流感疫苗的效果并不是100%的,因此重要的是采取以下措施来减少感染的传播:
● 注意个人卫生,勤洗手。
● 保持环境清洁通风,尽量减少人群密集和空气污浊的场所。
● 避免与呼吸道感染患者接触。
● 根据温度增减衣物,均衡饮食,加强锻炼,保证睡眠,提高体质和免疫力。
9. 流感治疗
神经氨酸酶抑制剂:其作用机制是防止病毒从感染的细胞释放出来并侵袭相邻的细胞,减少体内病毒的复制,对流感A和B都有效。目前使用的药物主要是奥司他韦和扎那米韦。
M2离子通道阻滞剂:该药物阻止流感病毒M2蛋白的离子通道,从而抑制病毒复制,但只抑制流感A病毒。包括金刚烷和利曼他丁。
参考文献:
[1] Delacy M. The conceptualization of influenza in eighteenth-century Britain: specificity and contagion [J]. Bull Hist Med, 1993, 67(1):74-118.
[2] Fee E, Brown T M, Lazarus J, et al. The influenza pandemic of 1918 [J]. American Journal of Public Health, 2001, 91(12):1953.
[3] Webster R G, Bean W J, Gorman O T, et al. Evolution and ecology of influenza A viruses [J]. Curr Top Microbiol Immunol, 1992, 56(1):359-375.
[4] Ito T, Couceiro J N, Kelm S, et al. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential [J]. Journal of Virology, 1998, 72(9):7367-7373.
[5] Ludwig S, Stitz L, Planz O, et al. European Swine Virus as a Possible Source for the Next Influenza Pandemic? [J]. Virology, 1995, 212(2):555.
[6] Garten R J, Davis C T, Russell C A, et al. Antigenic and Genetic Characteristics of Swine-Origin 2009 A(H1N1) Influenza Viruses Circulating in Humans [J]. Science, 2009, 325(5937):197-201.
[7] Laver W G, Webster R G. Antibodies to human influenzavirus neuraminidase (the A/Asian/57 H2N2 strain) in sera from Australian pelagic birds [J]. Bulletin of the World Health Organization, 1972, 47(4):535-41.
[8] Scholtissek C, Rohde W, Von H V, et al. On the origin of the human influenza virus subtypes H2N2 and H3N2 [J]. Virology, 1978, 87(1):13-20.
[9] Bean W J, Schell M, Katz J, et al. Evolution of the H3 influenza virus hemagglutinin from human and nonhuman hosts [J]. Journal of Virology, 1992, 66(2):1129-1138.
[10] Taubenberger J K, Reid A H, Lourens R M, et al. Characterization of the 1918 influenza virus polymerase genes [J]. Nature, 2005, 437(7060):889-893.
[11] Mangtani P, Mak T K, Pfeifer D. Pandemic H1N1 infection in pregnant women in the USA [J]. Lancet, 2009, 374(9688):429-430.
[12] Dodds L, Mcneil S A, Fell D B, et al. Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women [J]. Canadian Medical Association journal, 2007, 176(4):463.
[13] Louie J K, Acosta M, Samuel M C, et al. A novel risk factor for a novel virus: obesity and 2009 pandemic influenza A (H1N1) [J]. Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America, 2011, 52(3):301.
[14] Jain S, Chaves S S. Obesity and Influenza [J]. Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America, 2011, 53(5):422.
[15] Corti D, Lanzavecchia A. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins [J]. Science, 2011, 333(6044):850-856.
[16] Eliasson D G, El B K, Schön K, et al. CTA1-M2e-DD: a novel mucosal adjuvant targeted influenza vaccine [J]. Vaccine, 2008, 26(9):1243-1252.
[17] Lo C Y, Wu Z, Misplon J A, et al. Comparison of vaccines for induction of heterosubtypic immunity to influenza A virus: cold-adapted vaccine versus DNA prime-adenovirus boost strategies [J]. Vaccine, 2008, 26(17):2062-2072.
[18] Epstein S L, Kong W J, Lo C Y, et al. Protection against multiple influenza A subtypes by vaccination with highly conserved nucleoprotein [J]. Vaccine, 2005, 23(46):5404-5410.
[19] Filette M D, Ramne A, Birkett A, et al. The universal influenza vaccine M2e-HBc administered intranasally in combination with the adjuvant CTA1-DD provides complete protection [J]. Vaccine, 2006, 24(5):544-551.
[20] Zou P, Liu W, Chen Y H. The epitope recognized by a monoclonal antibody in influenza A virus M2 protein is immunogenic and confers immune protection [J]. International Immunopharmacology, 2005, 5(4):631-635.
[21] Wu F, Huang J H, Yuan X Y, et al. Characterization of immunity induced by M2e of influenza virus [J]. Vaccine, 2007, 25(52):8868-8873.
[22] Black S B, Shinefield H R, France E K, et al. Effectiveness of influenza vaccine during pregnancy in preventing hospitalizations and outpatient visits for respiratory illness in pregnant women and their infants [J]. Am J Perinatol, 2004, 21(06):333-339.
[23] Munoz FM, Greisinger AJ, Wehmanen OA, et al. Safety of influenza vaccination during pregnancy [J]. American Journal of Obstetrics and Gynecology, 2005, 201(6):547-552.
[24] Mereckiene J, Cotter S, Nicoll A, et al. National seasonal influenza vaccination survey in Europe, 2008 [J]. 2008, 13(43):3661-3670.
下一篇: 常见病毒汇总盘点











