结核病--卷土重来的“白色瘟疫”
日期:2022-10-09 16:57:16
谈到结核病,大家首先想到的或许是《红楼梦》里弱柳扶风的“林妹妹”,又或许是才貌双全的民国女神林徽因?那个年代的“谈痨色变”仿佛已成历史,结核病似乎已逐渐走出人们的视野,可事实真是如此吗?
2021年10月14日,世界卫生组织(WHO)发布了《2021年全球结核病报告》,报告显示 2020年全球新发结核病患者987万,150万人死于结核病。其中,我国2020年估算的结核病新发患者数为84.2万(2019年为83.3万),估算结核病发病率为59/10万(2019年58/10万)。在30个结核病高负担国家中,我国估算结核病发病数排第2位,因结核死亡超3万。可见,直至今天,结核病仍然是我国最主要的传染病。那么结核病是一种什么病?它是如何肆虐于历史的长河中?
1. 什么是结核病?
结核病(Tuberculosis,简称TB)是由结核分枝杆菌(Mycobacterium tuberculosis) 引起的一种常见并可致命的慢性传染病。由于结核分枝杆菌非常小,它能侵染人体的几乎所有组织和器官,而80%以上的结核菌侵袭的是肺部,造成肺结核。在有记载的历史中,肺结核似乎被认为是围绕诗人和浪漫主义者的疾病 [1],其实不然。因为肺结核主要通过呼吸道传播,这就意味着无论你身居何位,不管你是诗人、歌手亦或是建筑师,只要你还需要呼吸,就有被感染的风险,这就是它号称全球头号传染病“杀手”的原因所在。
耐药结核病的出现更是让人类对抗这一疾病的战争又添挫折。所谓耐药结核病是指病人感染的结核分枝杆菌对一种或一种以上的抗结核药物产生了耐药性,普通的药物不再能将其杀灭,医学界也将耐药性结核病视为“能传染的癌症”。
因此,研发新型抗结核药物尤其是抗耐药结核病药物成为全人类迫在眉睫的任务。
2. 结核病的类型?
按照病变部位可将其分为肺结核和肺外结核两大类,其中肺结核最为常见,主要包括四种类型:原发型肺结核(I型)、血行播散型肺结核(Ⅱ型)、继发型肺结核(Ⅲ型)以及结核性胸膜炎(Ⅳ型)。按照耐药情况则可将其分为非耐药结核病和耐药结核病,耐药结核病包括5种类型:单耐药结核病、多耐药结核病、耐多药结核病、广泛耐药结核病、利福平耐药结核病。
3. 什么是结核分枝杆菌?
结核分枝杆菌又叫做结核杆菌,因涂片染色呈抗酸性,所以也叫做抗酸杆菌。结核杆菌属于需氧菌,生长缓慢,对外界具有很强的抵抗力,在阴凉处干燥的结核杆菌能在1-2年保持毒力,但容易被直接日晒或者紫外线杀死。结核分枝杆菌分为人型、牛型、鸟型、鼠型,但是引起人致病的主要是人型。
4. 结核分枝杆菌的结构
结核分枝杆菌为细长略带弯曲的杆菌,大小1 ~ 4×0.4μm,无芽孢、无鞭毛。牛分枝杆菌则比较粗短。分枝杆菌属的细菌细胞壁脂质含量较高,约占干重的60%,大量分枝菌酸(mycolic acid)包围在肽聚糖层的外面,可影响染料的穿入。
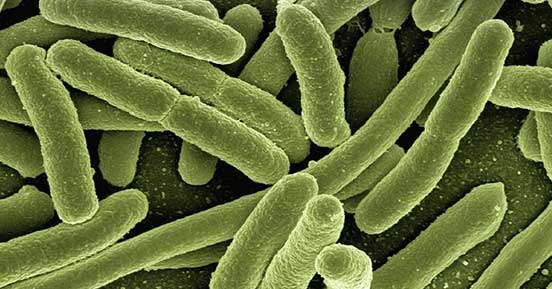
图1. 结核分枝杆菌的形貌结构
结核分枝杆菌的致病力来源于结核杆菌的细胞膜成分,包括脂质、蛋白、多糖。脂质主要包括磷脂、硫酸脑苷脂、索状因子和蜡质D,其中蜡质D能引起超敏反应;蛋白主要包括结核菌素(与蜡质D结合引起超敏反应)和分枝菌生长素;多糖能与CR3结合,有助于细菌的黏附与入侵抑制吞噬体与溶酶体融合,引起局部灶细胞浸润,抑制巨噬细胞MHCII类分子表达。
5. 结核病的致病机制
结核分枝杆菌感染宿主后引发一系列固有及适应性免疫反应,其与宿主间复杂多样的相互作用以及宿主自身免相关基因及易感性成为结核病发病的基础。下图展示了结核分枝杆菌的致病机制。
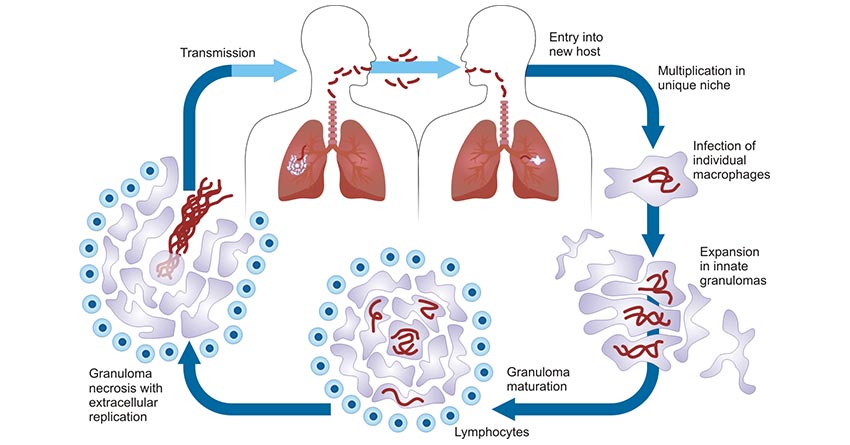
图2. 结核分枝杆菌的致病生命周期 [4]
呼吸道感染最为多见。首先,结核病患者从呼吸道排出大量带菌的“微滴核”,正常人吸入即可造成感染,直径小于5μm的带菌微滴能超越呼吸道的粘液纤毛防御进入肺泡,因此具有较强的致病性。然后,到达肺泡的结核杆菌趋化和吸引巨噬细胞,并被其吞噬。在有效细胞免疫建立以前,由于巨噬细胞将其杀灭的能力有限,结核杆菌在细胞内繁殖,引起局部炎症的同时还可发生全身性血源性播散,成为以后肺外结核病发生的根源。宿主对结核杆菌产生特异的细胞免疫一般需4-7周时间,形成一种使细菌消灭的肉芽肿性炎症反应,具体在临床上表现为皮肤结核菌素试验阳性。
事实上,结核病的免疫反应和变态反应常同时发生并伴随出现。出现变态反应则表示机体已获得免疫力,对病原菌产生抵抗力。然而,变态反应的出现往往伴随干酪样坏死,试图破坏和杀灭结核杆菌。已致敏的个体动员机体防御反应的速度虽然比未致敏的个体快,但组织坏死也更为明显。
因此,不同的反应决定了机体在感染结核杆菌后所呈现的不同临床表现:(1)若保护性反应为主,则病灶局限,结核杆菌被杀灭;(2)若主要表现为组织破坏性反应,则机体呈现有结构和功能损害的结核病。
6. 结核病的治疗方法
目前针对结核病的治疗手段主要分为药物治疗和手术治疗。药物治疗能够缩短传染期、降低死亡率、感染率及患病率。合理的抗结核化学药物治疗(简称化疗)需要遵循早期、 应用、适量、规律和全程使用敏感药物的原则。药物治疗在控制结核病方面起着决定性的作用,接下来我们将主要介绍。
根据抗结核药的抗菌效力和不良反应将其分为一线抗结核药物和二线抗结核药物(详见表1)。一线抗结核药是初治肺结核的首选药物,主要包括异烟肼、利福平、吡嗪酰胺、乙胺丁醇和链霉素,该类药物的特点是:副作用少且半衰期较长、能有效杀灭结核分枝杆菌、抗菌活性强、治疗效果相对较好。常用的二线抗结核药物包括卡那霉素、对氨基苯甲酸、阿米卡星等,这类药物通常抗菌作用小且毒副作用大。目前药物敏感结核病的治疗往往需要4种以上的药物联用,当一线药物疗效不明显时辅以二线药物。但是,当前结核病临床治疗方案缺点较多,如疗程长易产生耐药性、不良反应严重、品种少等,因此,开发高效低毒、价格更便宜、疗程更短的抗结核病药物,是奋斗在结核病临床治疗领域的科学工作者一直追求的目标,而药物作用靶点的发现将为抗结核新药的开发奠定理论基础。
表1 常见的抗结核治疗药物
| 药物类别 | 药名 | 靶点 | 药物类型 | 首次获批日期 |
|---|---|---|---|---|
| 一线抗结核药物 | 异烟肼(Isoniazid) | KatG、inhA、ahpC | 小分子化药 | 1952.01(美国) |
| 利福平(Rifampicin) | rpoB | 小分子化药 | 1971.05(美国) | |
| 吡嗪酰胺(Pyrazinamide) | pncA、pZase | 小分子化药 | 1956.09(日本) | |
| 乙胺丁醇(Ethambutol) | embB | 小分子化药 | 1967.11(美国) | |
| 链霉素(Streptomycin) | rpsL、gidB、rrs | 小分子化药 | 1946.01 | |
| 二线抗结核药物 | 卡那霉素(Kanamycin) | rrs、eis | 小分子化药 | 1955.01(中国) |
| 对氨基苯甲酸(Para-aminosalicylicacid) | thyA | 小分子化药 | 1999.06(德国) | |
| 阿米卡星(Amikacin) | rrs | 小分子化药 | 1981.01(中国) | |
| 卷曲霉素(Capreomycin) | rrs、tylA | 小分子化药 | 1966(美国) | |
| 乙硫异烟胺(Ethionamide) | inhA | 小分子化药 | 1965.04(美国) | |
| 氟喹诺酮(Fluoroquinolone) | gyrA、gyrB | 小分子化药 | 1950.03(美国) |
7. 抗结核新药研发进展
很多具有新颖作用机制的抗结核候选药物正处于不同的临床前或临床研究阶段,下表总结了部分在研新药的最新临床状态和作用靶点 [2]。
表2 在研抗结核新药
| 药名 | 靶点 | 在研阶段 | 在研机构 |
|---|---|---|---|
| SQ109 | MmpL3 | 临床III期 | Infectex LLC; Sequella, Inc. |
| PNU-100480 | 50s ribosomal subunit | 临床II期 | Sequella, Inc.; Pfizer Inc. |
| AZD5847 | 50s ribosomal subunit | 临床II期(已终止) | / |
| BTZ-043 | DprE1 | 临床II期 | German Center For Infection Research; Hans Knöll Institute; German Federal Ministry Of Education And Research |
| Q-203 | Respiratory cytochrome bc1 complex |
临床II期 | Qurient Co., Ltd.; Infectex LLC |
| DC-159a | GyrA rv0006 |
临床I期(已终止) | / |
| TBA-354 | DprE1 | 临床I期 | / |
| CPZEN-45 | WecA | 临床前 | / |
近几年新型抗结核病药物的研发已经取得了较大的进展,这些新药因作用于不同的新靶点而表现出良好的抗结核活性,提高了耐多药以及广泛耐药结核病患者的治愈率,并显著降低了总死亡率。然而,一些新药比现有的抗结核药物毒性更大。显然,合理且高效实施新药物方案将克服耐药结核病的“障碍”,并为全球消灭结核病的目标提供有力支持 [3]。
8. 结核病相关的CUSABIO特色产品
参考文献:
[1] Clark-Curtiss J E and Haydel S E. Molecular genetics of mycobacterium tuberculosis pathogenesis[J]. Annual Review of Microbiology, 2003, 57(1).
[2] Mi J, Gong W P, Wu X Q. Advances in Key Drug Target Identification and New Drug Development for Tuberculosis[J]. BioMed Research International, 2022.
[3] Sha W, Xiao H P. Rational Use of Anti-Tuberculosis Drugs in the Chemotherapy Era of Drug-Resistant Tuberculosis[J]. Mycobacterial Diseases, 2014, 4(4).
[4] Cambier C J, Falkow S, Ramakrishnan L. Host Evasion and Exploitation Schemes of Mycobacterium tuberculosis[J]. Cell, 2014, 159(7).











