神经炎症
神经炎症是中枢神经系统(CNS)稳态被破坏时发生的炎症反应。它是当代神经科学中的一个热门话题 [1]。这种炎症反应可能由不同的病因引起,如颅内创伤和感染。及时识别CNS疾病中的促炎因子是治疗这些疾病的关键突破点。神经炎症涉及许多信号通路蛋白、受体和各种细胞。CUSABIO收集并列出与血脑屏障通透性相关的分子/靶标,点击查看所有相关分子/靶标及其研究试剂。
神经炎症研究的热门靶标
- CCL2
- CCL21
- CCL3
- CCL5
- CCL14
- CCR2
- CCR5
- CD2
- CD200
- PTGS2
- CX3CL1
- CXCL1
- CXCL10
- CXCL12
- CXCL2
- CXCR1
- CXCR2
- CXCR3
- CXCR4
- GFAP
- ICAM1
- IFNG
- IL10
- IL10RA
- IL10RB
- IL17A
- IL18
- IL18R1
- IL1A
- IL1B
- IL1R1
- IL1R2
- IL1RAP
- IL2
- IL23A
- IL23R
- IL2RA
- IL2RB
- IL6
- IL6R
- CXCL8
- ITGAM
- LTA
- NFE2L2
- PTGES2
- TLR1
- TLR2
- TLR3
- TLR4
- TLR5
- TLR6
- TLR7
- TLR8
- TLR9
- TNF
- TNFRSF1A
- TNFRSF1B
什么是神经炎症?
神经炎症,也称为神经性炎症,是一种由多种诱因(包括感染、创伤性脑损伤、有毒代谢产物或自身免疫反应)引发的脑部炎症状态。它是多种急性和慢性脑部疾病的共同病理基础,包括帕金森病、阿尔茨海默病、肌萎缩侧索硬化症和亨廷顿病 [2]。
与外周炎症不同,神经炎症是用来描述中枢神经系统广泛的免疫反应的术语。外周炎症触发涉及血脑屏障、胶质细胞和神经元的神经炎症反应 [3]。如果血脑屏障受损,有害物质可以进入大脑脆弱的环境。这个过程被称为“漏脑综合症”,一旦这些物质进入大脑环境,它们就会激活导致炎症的小胶质细胞。神经炎症的症状多种多样。主要症状包括新陈代谢减缓/体重增加、认知障碍、糖尿病、情绪障碍和低能量/疲劳。
神经炎症的机制是什么?
在过去的几十年中,越来越多的研究推进了神经炎症的机制及其在神经退行性变中的作用。来自流行病学、临床和动物模型的研究也有助于揭示神经炎症的各种新机制。图1显示了影响神经炎症过程的各种因素,这些因素随后导致神经退行性变。其中,越来越清楚的是,小胶质细胞和星形胶质细胞的激活以及伴随的促炎细胞因子和趋化因子的表达通常与疾病、创伤和毒素引起的CNS损伤有关。
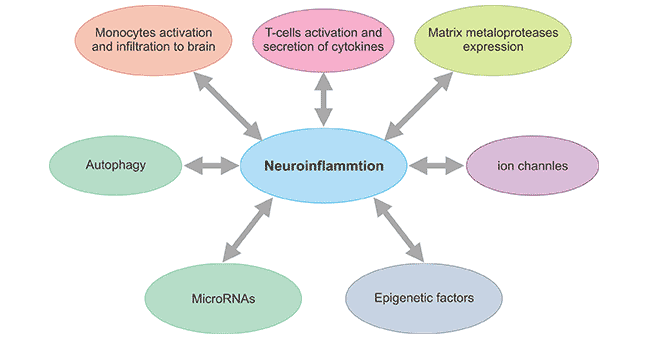
图1. 影响神经炎症的新兴概念
*此图取自参考文献2
普遍认为,大脑中的炎症是由激活的小胶质细胞和反应性星形胶质细胞引起的。小胶质细胞作为中枢神经系统的驻留免疫细胞,在正常情况下对维持组织稳态和促进大脑发育起着重要作用 [4]。它们负责大脑的免疫监视。星形胶质细胞控制血流和细胞外神经递质水平,以确保它们所在微环境对神经功能是最佳的。在没有刺激或损伤的情况下,神经递质、神经营养因子、抗炎细胞因子和细胞间接触通过CD200/CD200受体相互作用免疫抑制神经胶质细胞 [5] [6]。然而,当细胞外钾离子、ATP或腺苷浓度增加时,小胶质细胞和星形胶质细胞被刺激释放更多的促炎因子/细胞因子,如肿瘤坏死因子(TNF-α)、白介素-1(IL-1)、一氧化氮(NO)和超氧化物。
在正常情况下,大脑被认为是一个免疫特权部位。事实上,抗原呈递被积极抑制,胶质细胞保持在静止状态,免疫成分被血脑屏障排除在大脑之外。然而,一旦发生神经元损伤,如脑外伤和缺血,胶质细胞的激活产生促炎因子和静止胶质细胞向反应性胶质细胞的转变变得突出,以诱导神经炎症反应。然而,越来越多的证据表明,适当激活机体免疫可以在不同类型的神经元中表现出神经保护作用 [7] [8]。小胶质细胞对神经元产生有害还是有益的影响可能取决于小胶质细胞的激活状态。
小胶质细胞的激活状态可以分为三类:静止状态、半激活状态和完全激活状态。如前所述,静止的小胶质细胞可以像安全警卫一样进行免疫监视。半激活的小胶质细胞可以产生营养因子而不产生自由基,并作为警察防止任何对神经炎症不利的情况,保护公民神经元,避免误伤旁观者神经元。完全激活的小胶质细胞可以产生包括超氧化物和一氧化氮在内的自由基以及不同的促炎细胞因子,并作为军队负责战斗。然而,旁观者神经元将不可避免地受到损害。
参考文献:
[1] O'Callaghan JP, Sriram K, Miller DB. Defining "neuroinflammation" [J]. Ann N Y Acad Sci. 2008. 1139: 318-30.
[2] Niranjan R. Recent advances in the mechanisms of neuroinflammation and their roles in neurodegeneration [J]. Neurochem Int. 2018. 120: 13-20.
[3] Lyman, Monty, Lloyd, Dafydd G., Ji, Xunming, et al. Neuroinflammation: The role and consequences [J]. Neuroscience Research. 2014, 79(), 1–12.
[4] Subhramanyam CS, Wang C, Hu Q, Dheen ST. Microglia-mediated neuroinflammation in neurodegenerative diseases [J]. Semin Cell Dev Biol. 2019. 94: 112-120.
[5] Chang RC, Chiu K, Ho YS, So KF. Modulation of neuroimmune responses on glia in the central nervous system: implication in therapeutic intervention against neuroinflammation [J]. Cell Mol Immunol. 2009, 6(5):317-26.
[6] Anthony Lyons; Keith McQuillan; Brian F. Deighan; et al. Decreased neuronal CD200 expression in IL-4-deficient mice results in increased neuroinflammation in response to lipopolysaccharide [J]. Brain, Behavior, and Immunity. 2009, 23: 1020–1027.
[7] Schwartz M, Kipnis J. A common vaccine for fighting neurodegenerative disorders: recharging immunity for homeostasis [J]. Trends Pharmacol Sci. 2004. 25: 407-412.
[8] Shaked I, Porat Z, Gersner R, Kipnis J, Schwartz M. Early activation of microglia as antigen-presenting cells correlates with T cell-mediated protection and repair of the injured central nervous system [J]. J Neuroimmunol. 2004. 146: 84-93.






