记忆窃贼 - 阿尔茨海默病
在1906年,阿洛伊斯·阿尔茨海默博士在一位女性患者的大脑组织中观察到了独特的斑块和神经纤维缠结,这位女性在生前遭受了记忆丧失、语言问题和不可预测的行为,直至去世。这是首次对阿尔茨海默病的描述。1910年,克雷佩林在《精神病学》第八版中将这种神经状况命名为“阿尔茨海默病”。自那以后,阿尔茨海默病便在全球范围内广为人知。
1. 什么是阿尔茨海默病?
阿尔茨海默病(AD)是全球最常见的痴呆类型,占全球痴呆病例的60%至70% [1]。它是一种进行性的神经退行性疾病,损害记忆、思考、学习和组织能力,最终严重影响社会、职业和生活功能。它通常发生在老年和早老性痴呆中。
从神经病理学角度来看,AD的特征是显著的皮层萎缩和脑室扩大。病理标志是老年斑,由异常积累的β-淀粉样蛋白(Aβ)形成,以及超磷酸化tau蛋白的神经纤维缠结。
2. 阿尔茨海默病的症状有哪些?
阿尔茨海默病起初隐匿,病程为慢性进展性。阿尔茨海默病的症状因人而异。然而,在早期阶段,它有一些共同的症状,包括进行性记忆损害、认知功能障碍、语言障碍、运动障碍以及人格和行为变化,以及精神障碍 [2]。
这些症状会随着时间的推移逐渐恶化。在疾病的晚期,患者会出现严重的并发症,如脱水、营养不良或感染,最终可能导致死亡 [3]。
3. 阿尔茨海默病的原因是什么?
阿尔茨海默病的确切原因尚不完全清楚,它可能受到遗传、环境和生活方式因素的共同影响。
3.1 遗传因素
大多数阿尔茨海默病的病例并非直接遗传,但某些遗传因素可以增加风险。特定基因的突变,如APP(淀粉前体蛋白)[4]、PSEN1(早老素1)和PSEN2(早老素2),与家族性阿尔茨海默病相关,并出现在早发型AD(EOAD)中。携带这些突变的个体在较早年龄发展为阿尔茨海默病的可能性更高。
APOE基因是晚发型AD(LOAD)最成熟的遗传风险因素。LOAD的大多数病例是散发性的,没有报告家族病史。通过全基因组关联研究(GWAS)确定的大量基因可能与Aβ级联反应或tau病理有关,并倾向于聚集在三个独特的通路中。
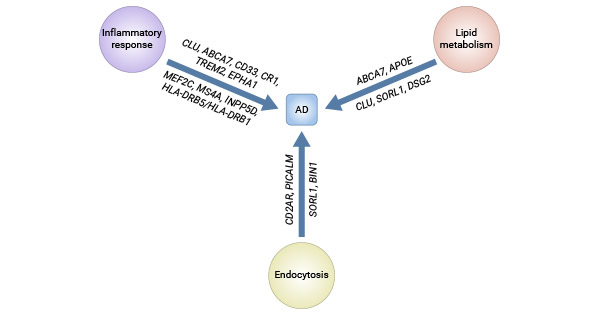
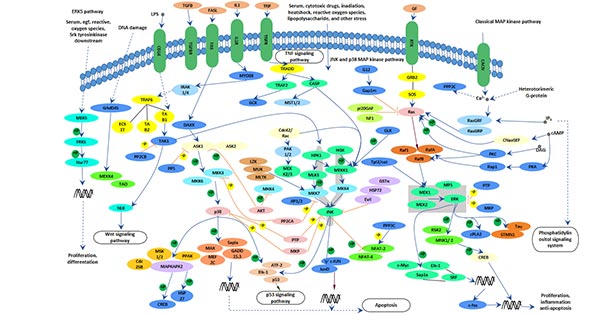
图1. 阿尔茨海默病(AD)中涉及的主要通路和相关基因
这张图片引用自: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4876682/
| 与阿尔茨海默病相关的基因 | 功能 | |
|---|---|---|
| 早发型AD (EOAD) 基因 | APP | 早发型AD (EOAD) 基因 |
| PSEN1 | γ-分泌酶活性、细胞内信号传导、APP处理、β-淀粉样蛋白产生 | |
| PSEN2 | γ-分泌酶活性、APP处理、β-淀粉样蛋白产生、突触可塑性 | |
| amyloid-β(Aβ) | 斑块形成 | |
| tau | 神经纤维缠结形成 | |
| BACE1 (beta-secretase) | 在淀粉样蛋白生成途径的第一步中切割APP,释放sAPPβ并产生C99 | |
| gamma-secretase | 在淀粉样蛋白生成途径的第二步中切割C99,释放β-淀粉样肽 | |
| 晚发型AD (LOAD) 基因 | Apolipoprotein E (ApoE) | 携带一个APOEε4等位基因的个体风险增加,携带两个拷贝的风险更高 |
| CLU | 突触转换 补体调节 分子伴侣蛋白 |
|
| ABCA7 | 吞噬作用 脂质稳态 |
|
| SORL1 | 内吞作用 载脂蛋白E受体 APP运输 |
|
| CR1 | 淀粉样蛋白β清除 补体激活 |
|
| CD33 | 依赖于clathrin的内吞作用 细胞信号传导 |
|
| MS4A | 细胞信号传导 免疫功能 |
|
| TREM2 | 炎症反应 | |
| BIN1 | 突触囊泡内吞作用 APP运输 细胞骨架动力学 |
|
| CD2AP | 受体介导的内吞作用 细胞分裂 细胞骨架动力学 |
|
| PICALM | 依赖于clathrin的内吞作用 | |
| EPHA1 | 突触发育 免疫功能 神经发育 |
|
| HLA-DRB5/HLA-DRB1 | 免疫功能 组织相容性 |
|
| INPP5D | 细胞因子信号传导 免疫功能 |
|
| MEF2C | 肌生成 突触形成 |
|
| CASS4 | 细胞迁移 细胞迁移 |
|
| PTK2B | 钙稳态 MAP激酶信号传导 |
|
| NME8 | 纤毛功能 神经细胞增殖 |
|
| ZCWPW1 | 表观遗传调控 神经发育 |
|
| CELF1 | mRNA编辑 前mRNA剪接 |
|
| FERMT2 | 细胞-细胞粘附 血管生成 |
|
| SLC24A4/RIN3 | 细胞信号传导 神经发育 |
|
| DSG2 | 细胞-细胞粘附 | |
| PLD3 | 信号传导 表观遗传修饰 |
|
| UNC5C | 神经发育 | |
| AKAP9 | 信号传导 | |
| ADAM10 | 海马神经发生 细胞粘附 |
|
表信息引用自:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4876682/
阿尔茨海默病的生物学特征:
阿尔茨海默病的特征性表现为细胞外淀粉样β-蛋白(Aβ)斑块的积累和含有高磷酸化tau蛋白的细胞内神经纤维缠结(NFTs)的存在 [5]。β-淀粉样蛋白的聚集可能扰乱神经元间的通讯,并促成神经损伤。Tau蛋白对维持神经元结构至关重要,其异常聚集导致缠结形成,破坏神经功能。
这些变化对神经元具有毒性,导致神经功能障碍、连接丧失和死亡。由此产生的病变最初出现在大脑负责记忆的区域,包括内嗅皮层和海马体,引起语言、行为和逻辑问题,然后扩散到阿尔茨海默病晚期的大脑几乎全域,导致显著的脑萎缩。

图2. 阿尔茨海默病的发病机制
这张图片引用自: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4588032/
3.2 生活方式和环境因素
在2017年阿尔茨海默病协会国际会议上(AAIC),柳叶刀委员会 [6]的一份报告引起了广泛讨论。题为《痴呆症的预防、干预和护理》的报告提出了九个痴呆症的风险因素。根据人群归因分数(PAF),确定了以下主要风险因素:
- 教育程度低:教育水平低导致的认知能力下降被认为是认知能力下降的一个原因。
- 听力:听力丧失可能增加脆弱大脑的认知负荷,引起大脑变化,或导致社会脱节或抑郁,并加速萎缩,可能导致认知能力下降。
- 运动:观察性实验发现运动与痴呆风险之间存在负相关性。体育运动可以使老年人远离痴呆。
- 糖尿病、高血压和肥胖:在血管风险因素中,高血压是最重要的。肥胖引起的外周血胰岛素异常导致大脑胰岛素分泌减少,影响淀粉样蛋白的清除。
- 抑郁症状:研究表明抑郁症状与痴呆风险之间存在联系。
- 缺乏社会接触:社会孤立是痴呆的风险因素,它增加了高血压、冠心病和抑郁的风险。社会孤立还可能导致认知活动减少,这与认知能力下降和情绪低落有关。
- 吸烟:吸烟与心血管疾病之间的联系可能导致认知障碍。
- 其他:免疫系统的逐渐衰竭、身体解毒功能的减弱、慢病毒的感染,以及丧偶、孤独、经济困难和生活挫折等社会心理因素可能是疾病的原因。

图3. 可修改和不可修改的风险因素对阿尔茨海默病的影响
截至2020年,大量研究揭示了阿尔茨海默病和痴呆症的额外风险因素,包括过量饮酒、脑损伤和空气污染 [7]。
4. 关于阿尔茨海默病的数据
阿尔茨海默病在2019年被正式确认为美国第六大死亡原因。在2020年和2021年,当COVID-19成为十大死亡原因之一时,它降至第七位。2023年,约有670万65岁及以上的美国人患有阿尔茨海默病。预计到2050年,这一数字将上升到1300万。据估计,全球约有5500万痴呆患者中有60%至70%患有阿尔茨海默病。
早发型(65岁之前)阿尔茨海默病大约占所有阿尔茨海默病患者的5%。阿尔茨海默病患者大多是晚发型(65岁以后),在70岁以上的人群中更常见。人口流行病学统计数据显示,40岁以下患有阿尔茨海默病的人数非常少 [8]。早在2011年,全球痴呆症的发病率就达到了约2400万,这一数字仍在以高速增长。预计到2040年,每20年翻一番 [9,10]。
流行病学数据显示,在美国,每三个85岁以上的个体中就有一个人预计会发展为阿尔茨海默病。此外,到2050年,85岁以上的美国人口预计将增加两倍。根据全球疾病负担研究,2019年全球约有5740万人患有痴呆症。预计到2050年,这一数字将达到1.528亿人,是目前的三倍。
5. 与阿尔茨海默病相关的信号通路
阿尔茨海默病是一种复杂的神经退行性疾病,具有多种潜在的分子机制。几种信号通路涉及阿尔茨海默病的发病机制。
5.1 MAPK信号通路
近期研究发现,在转基因阿尔茨海默病动物模型的大脑和阿尔茨海默病患者的大脑中,c-jun N-末端激酶信号转导通路被激活,认为这条通路与Aβ的沉积有关 [11,12]。JNK信号转导通路也与阿尔茨海默病的另一个病理变化密切相关 - Tau蛋白的异常磷酸化和双螺旋丝的形成 [13]。MAPK的三条通路 - ERK、JNK和p38,都参与了tau过度磷酸化的诱导,并与Aβ、氧化应激、炎症因子和蛋白磷酸酶等因素有关。
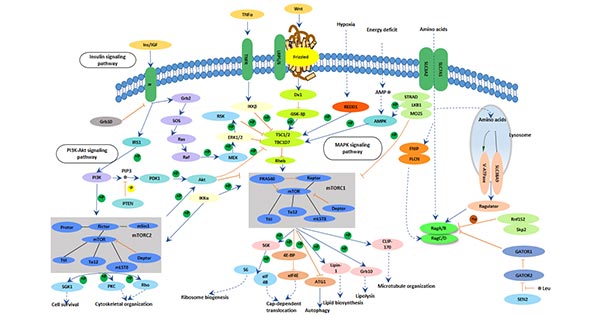
5.2 mTOR信号通路
mTOR通路是神经发育的重要调节通路。其功能包括以下方面:
阿尔茨海默病的一个特点是大脑某些区域大量神经元丧失,这可能与mTOR通路的异常有关。有充分证据表明mTOR可以通过不同的分子机制影响学习和记忆的形成。mTOR通路的激活直接上调参与突触可塑性调节的蛋白,影响学习和记忆。阿尔茨海默病患者中异常的mTOR通路也表明mTOR信号的调节是神经系统疾病的一个重要因素 [14]。
5.3 胰岛素受体(IR)信号转导通路
胰岛素受体在大脑中广泛分布,包括海马、嗅球和下丘脑。大脑中有三条主要的胰岛素信号通路:胰岛素PI3K/AKT-GSK3信号通路、胰岛素PI3K/AKT-BAD信号通路和胰岛素PI3K/AKT-mTOR信号通路。神经元细胞中的胰岛素通过MAPK和PI3K/AKT加速神经元的产生。当胰岛素信号通路失败时,PI3K/AKT和MAPK信号通路被抑制,导致细胞凋亡。胰岛素还可以调节N-甲基-D-天冬氨酸(NMDA)的表达和长时程增强(LTP)的兴奋性,进而影响记忆和学习能力。大量研究表明,阿尔茨海默病的病理变化与神经元胰岛素受体(IR)信号转导通路障碍有关 [15]。
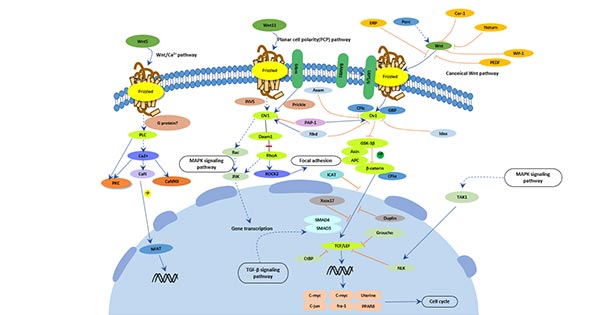
5.4 Wnt信号通路
- Wnt信号通路与淀粉样β蛋白:信号功能的持续丧失与阿尔茨海默病患者淀粉样β蛋白诱导的神经退行性变化有关。淀粉样β蛋白可以通过抑制Wnt信号通路的功能来影响目标基因的表达,从而产生神经毒性,最终导致大量神经元的丧失。
- Wnt信号通路与tau蛋白:糖原合成酶激酶3β,作为Wnt信号通路的负向调节因子,可以通过过度磷酸化tau蛋白破坏神经元,导致认知功能障碍。
- Wnt信号通路与神经干细胞:Wnt信号通路的激活调节各种干细胞和神经前体细胞的增殖和分化,Wnt信号功能的丧失直接导致与阿尔茨海默病直接相关的神经形成能力下降。
Wnt信号通路参与了大多数功能完整的神经元过程,并且众多研究表明Wnt信号通路在阿尔茨海默病的发展中发挥重要作用 [16]。
6. 当前阿尔茨海默病的热门研究领域
尽管目前还没有治疗阿尔茨海默病的方法,但是许多有前景的研究领域正在被探索,以期找到新的治疗方法和预防策略。免疫疗法和生物标志物开发在这些当前热门研究领域中脱颖而出。
6.1 阿尔茨海默病的免疫疗法
针对阿尔茨海默病的免疫疗法主要集中于靶向β-淀粉样蛋白。错误折叠的β-淀粉样蛋白在细胞外的毒性沉积是阿尔茨海默病的标志。基于Aβ的免疫疗法主要旨在减少Aβ聚集体的形成、传播和在人脑中的沉积。两种主要的抗Aβ疗法概念是主动免疫和被动免疫。被动疫苗直接引入外源性单克隆抗体(mAbs),而主动疫苗指导免疫系统使用抗Aβ剂产生免疫反应。到目前为止,抗Aβ剂主要集中在降低Aβ的产生、抑制Aβ聚集和加速Aβ清除。
6.2 阿尔茨海默病的生物标志物开发
传统的阿尔茨海默病(AD)生物标志物在帮助临床医生诊断阿尔茨海默病、评估疾病进展和监测潜在治疗干预的效果方面发挥着至关重要的作用。
以下是一些常用的生物标志物:
| 生物标志物 | 作用 | |
|---|---|---|
| Beta-Amyloid (Aβ) Peptides | CSF Aβ42 | 脑脊液中Aβ42水平的降低与大脑中淀粉样斑块沉积有关 |
| Amyloid PET Imaging | 使用放射性示踪剂的正电子发射断层扫描(PET)可以可视化并量化大脑中的淀粉样斑块 | |
| Tau Proteins | CSF Tau | 脑脊液中总tau(t-tau)和磷酸化tau(p-tau)水平的升高表明神经纤维缠结形成和神经退行性变 |
| Tau PET Imaging | 使用tau示踪剂的PET成像可以可视化大脑中的tau病理 | |
| Neurodegeneration Biomarkers | CSF Neurofilament Light (NfL) | 脑脊液中NfL水平的升高表明神经退行性变和轴突损伤 |
| Structural Brain Imaging | 磁共振成像(MRI)可以揭示与神经退行性变相关的大脑结构变化 | |
| Imaging Biomarkers | Functional Brain Imaging (FDG-PET) | 氟脱氧葡萄糖PET测量大脑中的葡萄糖代谢,提供有关神经元活动的信息 |
| MRI-Based Volumetric Measures | 大脑体积的变化,特别是在海马区等区域,与AD进展有关 | |
| Cognitive Biomarkers | Cognitive Testing | 对记忆、执行功能和其他认知领域的评估有助于评估认知障碍的严重程度 |
| Neurofilament Light Chain (NfL) in Blood | 血液中NfL水平的升高可能反映神经退行性变 | |
然而,基于脑脊液的测量侵入性和PET成像的高成本使这些测试的吸引力降低且耗时。因此,探索非侵入性和精确的生物标志物以指示发展为AD的风险和分类其各个阶段至关重要。
利用近期的技术进步,科学界已经探索/提出在血液、血浆、血清、尿液和唾液中使用各种生物标志物来早期检测AD [17, 18]。组学技术能够同时分析多种分子,这可以避免患者间异质性的劣势。分子模式与计算能力,包括人工智能(AI)和机器学习(ML)工具的结合,有望应对这些挑战 [19]。
研究人员正在研究基于AI的方法,使用生物流体生物标志物、视网膜和虹膜读数、脑电图(EEG)脑波测量 [20],以及在线语言技能和记忆测试[21,22]来诊断AD。这些进步有可能促进AD的大规模筛查,前提是它们在真实的临床环境中展示出高准确性。
miRNAs也已在血浆、血清和脑脊液中作为包括心血管疾病、癌症和神经退行性疾病在内的各种疾病的标记物被检测到 [23]。研究表明,几乎50%已知的miRNAs在神经系统中表达,在调节正常大脑生理学、衰老和心理健康方面发挥重要作用。在阿尔茨海默病中,miRNAs靶向关键疾病相关基因,表现出神经退行性或神经保护性效应 [24]。
这些解决方案代表了重大进步,但关于它们的有效性、长期结果和潜在副作用仍在进行辩论和探索。
参考文献:
[1] Oh, E. S., and Rabins, P. V. (2019). Dementia [J]. Ann. Intern. Med. 171, ITC33–ITC48.
[2] Lyketsos, C. G., Carrillo, et al. (2011). Neuropsychiatric symptoms in Alzheimer's disease [J]. Alzheimer's Dement. 7, 532–539.
[3] Bird, T. D. Alzheimer disease overview. GeneReviews®[Internet] (2018).
[4] Thinakaran G, Koo EH. Amyloid precursor protein trafficking, processing and function [J]. J Biol Chem. 2008;283(44):29615–29619.
[5] Querfurth H W, Laferla F M. Alzheimer's disease [J]. N Engl J Med, 2010, 362(4):329-344.
[6] Livingston G, Sommerlad A, Orgeta V,et al. Dementia prevention, intervention, and care [J]. Lancet, 2017, 390(10113).
[7] Livingston, G., Huntley, J., et al. (2020). Dementia prevention, intervention, and care: 2020 report of the Lancet Commission [J]. Lancet 396, 413–446.
[8] Harvey R, Skelton-Robinson M, Rossor M. The prevalence and causes of dementia in people under the age of 65 years [J]. Journal of Neurology Neurosurgery & Psychiatry, 2003, 74(9):1206.
[9] Reitz C, Brayne C, Mayeux R. Epidemiology of Alzheimer disease [J]. Nature Reviews Neurology, 2011, 7(3):137-152.
[10] Chan K Y, Wang W, Wu J J, et al. Epidemiology of Alzheimer's disease and other forms of dementia in China, 1990–2010: a systematic review and analysis [J]. The Lancet,2013, 381(9882): 2016-2023.
[11] Savage M J, Lin Y G, Ciallella J R, et al. Activation of c-Jun N-terminal kinase and p38 in an Alzheimer's disease model is associated with amyloid deposition [J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2002, 22(9):3376.
[12] Shoji M, Iwakami N, Takeuchi S, et al. JNK activation is associated with intracellular beta-amyloid accumulation [J]. Molecular Brain Research, 2000, 85(1-2):221-233.
[13] CristianaAtzori, BernardinoGhetti, RobertoPiva, et al. Activation of the JNK/p38 Pathway Occurs in Diseases Characterized by Tau Protein Pathology and Is Related to Tau Phosphorylation But Not to Apoptosis [J]. J Neuropathol Exp Neurol, 2001, 60(12):1190-1197.
[14] Lafay-Chebassier C, Paccalin M, Page G, et al. mTOR/p70S6k signalling alteration by A-beta exposure as well as in APP-PS1 transgenic models and in patients with Alzheimer's disease [J]. Journal of Neurochemistry, 2005, 94(1):215-225.
[15] Grimm MO1, Hundsdörfer B, Grösgen S, et al. PS dependent APP cleavage regulates glucosylceramide synthase and is affected in Alzheimer's disease [J] . Cell Physiol Biochem, 2014, 34: 92-110.
[16] Boonen R A, Van T P, Zivkovic D. Wnt signaling in Alzheimer's disease: up or down, that is the question [J]. Ageing Research Reviews, 2009, 8(2):71-82.
[17] Cheng S., Banerjee S., et al. Novel blood test for early biomarkers of preeclampsia and Alzheimer's disease [J]. Sci. Rep. 2021;11:15934.
[18] Goldoni R., Dolci C., et all. Salivary biomarkers of neurodegenerative and demyelinating diseases and biosensors for their detection. Ageing Res. Rev. 2022;76:101587.
[19] Borhani N., Ghaisari J., Abedi M., Kamali M., Gheisari Y. A deep learning approach to predict inter-omics interactions in multi-layer networks [J]. BMC Bioinform. 2022;23:53.
[20] Meghdadi A.H., Stevanović Karić M., et al. Resting state EEG biomarkers of cognitive decline associated with Alzheimer's disease and mild cognitive impairment [J]. PLoS ONE. 2021;16:e0244180.
[21] Eyigoz E., Mathur S., et al. Linguistic markers predict onset of Alzheimer's disease [J]. EClinicalMedicine. 2020;28:100583.
[22] Gunes S, Aizawa Y, et al. Biomarkers for Alzheimer's Disease in the Current State: A Narrative Review [J]. Int J Mol Sci. 2022 Apr 29;23(9):4962.
[23] Silvestro S, Bramanti P, Mazzon E. Role of miRNAs in Alzheimer's disease and possible fields of application [J]. Int J Mol Sci. 2019;20(16):3979.
[24] Reddy PH, Tonk S, et al. A critical evaluation of neuroprotective and neurodegenerative MicroRNAs in Alzheimer's disease [J]. Biochem Biophys Res Commun. 2017;483(4):1156–65.