细胞因子和自身免疫性疾病
自身免疫性疾病由不同类型的免疫细胞(包括T、B淋巴细胞和抗原呈递细胞)之间相互作用而导致。细胞因子作为关键因素,在自身免疫中参与自身反应性淋巴细胞的招募、生存、扩增、效应器功能[1]。大量研究表明,细胞因子在自身免疫疾病中的作用是多方面的。不同的细胞因子参与不同的自身免疫性疾病过程,同一细胞因子在不同的自身免疫性疾病中也有不同的作用。
在人类自身免疫性疾病的实验模型中,对患者进行的研究表明,促炎细胞因子有助于自身免疫性炎症的启动和传播,而抗炎细胞因子则有利于炎症的消退和疾病急性期的恢复[2]。许多学者将自身免疫性疾病分为T细胞介导的、自身抗体介导的、及联合介导的自身免疫性疾病三种。本文主要介绍细胞因子和T细胞介导的自身免疫性疾病。
1、自身免疫性疾病有关的T细胞亚群
在介绍细胞因子和T细胞介导的自身免疫性疾病之前,我们先简单了解一下T细胞的亚型及其分泌的细胞因子。如图1所示,它显示了不同T细胞亚群及其产生的细胞因子参与自身免疫性疾病的发病过程。效应性和调节性T细胞有不同的亚群,它们的活性平衡对有效的免疫反应至关重要,而这种免疫反应与刺激信号密切相关。细胞因子反应的过度、减少或异常是导致自身免疫性炎症的重要原因,而这种炎症是自身免疫性疾病的基础。
Th1、Th17、Th22和Th9亚群通常驱动致病效应器反应,而Th2、Treg、Tr1和Th3亚群介导调节反应。Tfh是最近发现的一种T细胞亚群,作用于淋巴组织中,B细胞的活化。图中显示了由各种T细胞亚集分泌的主要细胞因子,还包括各种T细胞亚集或细胞因子在自身免疫性疾病的不同阶段发挥的作用。
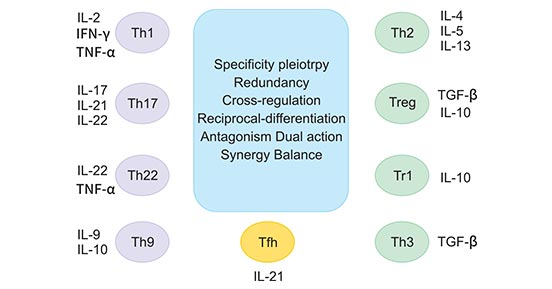
图1. 不同T细胞亚群及其产生的细胞因子
*图片来源于J Interferon Cytokine Res 的出版物
2、T细胞分泌的细胞因子与自身免疫性疾病
如图1所示,在自身免疫性疾病的发病过程中,不同的T细胞亚群分泌不同作用的细胞因子,本文主要介绍以下细胞因子,包括IL2、IL4、IFNγ、TNFα、IL17、IL10和TGFβ。
IL2与自身免疫性疾病
尽管IL-2具有促进增殖、抑制细胞凋亡和诱导细胞因子的能力,但IL-2的主要,非冗余体内功能是限制淋巴细胞扩增并促进外周耐受 [3]。在首次发现IL-2基因缺陷小鼠后的这些年,IL-2作为T细胞生长因子的冗余性已被广泛接受,研究的重点集中在缺乏IL-2/IL-2R的小鼠中,器官的自身免疫和炎症 [4]。IL-2和IL-2R缺失的小鼠会出现以溶血性贫血和溃疡性肠病为特征的自身免疫综合征。IL-2对自身免疫现象的作用可能是间接的,因为它在T细胞稳态中发挥了作用 [5]。
CD4+Tregs不产生IL-2,但其生存和功能依赖于高亲和力异源IL-2受体复合物对IL-2的摄取。当CD4+和CD8+T细胞被激活时,lL-2能促进Th1和Th2的生长,同时还能主动抑制Th17和Tfh细胞的生长。在自身免疫性疾病中,IL-2的耐受和免疫中的双重作用表明它具有多效性[6]。
IL4与自身免疫性疾病
IL-4是一种Th2型细胞因子,可激活抗原呈递细胞、巨噬细胞和树突状细胞(DC)。经典的炎症途径产生IL-1、TNF和自由基,可被巨噬细胞产生的IFN-γ诱导,被IL-4抑制;然而非经典炎症细胞因子如IL-4,能诱导巨噬细胞激活的替代途径,增强其吞噬功能和组织相容性复合物Ⅱ类分子的表达水平。IL-4还能与粒细胞单核细胞集落刺激因子(GM-CSF)协同促进DCs成熟。因此,在BDC2.5-IL-4转基因非肥胖性糖尿病小鼠的胰岛中,IL-4能促进巨噬细胞和DCs递呈自身抗原,激活DBC2.5-T细胞克隆。
IFNγ与自身免疫性疾病
IFN-γ主要由活化的T细胞和NK细胞产生,也称为II型干扰素。IFN-γ能促进Th1细胞分化,在小鼠和人身上都有广泛的研究。IFN-γ通过上调转录因子T-bet,激活APC,促进Th1分化 [7]。IFN-γ诱导自身免疫的机制尚不清楚,但IFN-γ能诱导多种抗原提呈细胞表达MHC-I/II分子,促进抗原在靶细胞中的呈现(如肝细胞和异常的甲状腺细胞),激活自身反应性T细胞,诱发自身免疫性疾病,如自身免疫性肝炎和自身免疫性甲状腺炎。
TNFα和自身免疫性疾病
TNFα可以促进自身反应性T细胞的免疫耐受。在自身免疫性脱髓鞘疾病中,TNFα作为一种抗炎细胞因子抑制疾病的发展,但具体机制尚不清楚。当自身反应性T细胞的细胞因子向Th2型转变,可能是由于TNFα对Th1型细胞的选择性抑制作用。TNF可诱导T细胞凋亡,阻断免疫。
但TNF具有双重作用,TNF在免疫反应早期有促炎作用,而晚期注射TNF可防止非肥胖糖尿病小鼠发生胰岛素依赖性糖尿病。在前4周,为非肥胖糖尿病小鼠注射TNF或通过胰岛转基因表达TNF,可使胰岛素依赖性糖尿病恶化,因为TNF促进了抗原呈递细胞的自身识别和呈递,激活了自身反应性T细胞,而没有直接损伤胰岛细胞。在NOD小鼠晚期胰岛中转基因表达TNF,可下调自身反应性T细胞受体,缓解病情。
IL17与自身免疫性疾病
IL-17又称IL-17A,是一种促炎性细胞因子,主要由Th17细胞在一系列细胞因子和其他细胞的作用下产生。许多研究发现,高表达IL-17可导致自身免疫和组织损伤[8]。近年来,IL-17受到了研究者和临床医生的更多关注,在炎症和自身免疫性疾病中的作用得到了证实。IL-17能动员、招募和激活不同的细胞,增加炎症。
尽管IL-17具有抗感染作用,但IL-17的过度产生会诱导多发性硬化症、类风湿关节炎和银屑病等自身免疫性疾病的炎症。通过使用IL-17阻断抗体或IL-17R拮抗剂来调节IL-17的表达水平,可以减轻自身免疫性疾病。目前除IL-17特异性转录因子RORγt外,还有其他一些转录因子和微RNA(miRNA)调节IL-17[9]。
IL10与自身免疫性疾病
L-10是一种多功能细胞因子,最初发现由Th2细胞产生 [10]。在移除感染性病原体的Th1反应过程中,IL-10是防止免疫组织损伤所必需的。调节性T细胞被认为是IL-10的主要来源。那么,哪种细胞因子能调节Th1细胞反应过程中的IL-10?有研究发现,IL-27是诱导IL-10调节Th1反应的关键因素[11]。
越来越多的证据表明,IL-10在系统性红斑狼疮(SLE)和多发性硬化症(MS)等自身免疫性疾病的发生和发展中都起着重要作用。通过IL-10拮抗剂可以抑制IL-10过度产生,干扰IL-10功能。在系统性红斑狼疮中,使用抗IL-10 mAbs可以减少B细胞的扩增和活化,产生抗dsDNA抗体 [12]。
TGFβ与自身免疫性疾病
TGFβ1对多种免疫功能有抑制作用,能影响多种促炎细胞因子的功能,包括IFN-γ、IL-1、IL6、IL12和TNFα。TGF-β1缺乏的小鼠会出现多灶性炎症性自身免疫病。炎症性肠病IBD中,局部组织的TGFβ高表达 [13]。
CD4 + CD25 +调节性T细胞介导免疫抑制,限制慢性炎症、感染和自身免疫性疾病相关的免疫机制。抑制模式是接触依赖性,非特异性的抗原,并涉及细胞因子TGF-β的非冗余性。TGF-β可以介导调节性T细胞与CD4+ CD25或CD8+ T细胞之间的抑制机制。此外,在CD4+ CD25-T细胞中,TGF-β与TCR抗原作用,获得调节表型[14]。
3、其他细胞因子和自身免疫性疾病
除这些由T细胞分泌的细胞因子外,许多其他调节T细胞分化的细胞因子也在T细胞介导的自身免疫性疾病中起着关键作用,如IL12、IL6和IL27等。
以IL12为例,IL12由IL-12p35和IL-12p40亚基组成,主要由DC和巨噬细胞等抗原呈递细胞(APC)分泌。IL-12可诱导幼稚的CD4+T细胞分化为Th1细胞,Th1细胞为T-helper亚群,与多种人类自身免疫性疾病有关。多发性硬化症(MS)是慢性中枢神经系统自身免疫性疾病之一,与IL-12诱导的Th1细胞的扩增密切相关。类风湿关节炎是一种病因未明的慢性、以炎性滑膜炎为主的免疫系统性疾病,在患者的血清和滑膜液中,IL-12水平、Th1细胞水平明显上升,并与疾病活动相关 [15]。
参考文献:
[1] Kamal D. Moudgil, and Divaker Choubey. Cytokines in Autoimmunity: Role in Induction, Regulation, and Treatment [J]. J Interferon Cytokine Res.2011, 31(10):695-703.
[2] O'Shea JJ, Ma A, et al. Cytokines and autoimmunity [J]. Nat Rev Immunol. 2002, 2(1):37-45.
[3] Todd, J. A. & Wicker, L. S. Genetic protection from the inflammatory disease type 1 diabetes in humans and animal models [J]. Immunity.2001, 15:387–395.
[4] Anneliese Schimpl, Ingolf Berberich, et al. IL-2 and autoimmune disease [J]. Cytokine & Growth Factor Reviews. 2002, 13: 369–378.
[5] Chen Y, Chen Y. Cytokines, lymphocyte homeostasis and self-tolerance In: Santamaria P, ed. Cytokines and Chemokines in Autoimmune Disease Austin: RG Landes Co.,2001.
[6] John Koreth, Jerome Ritz, et al. Low-dose interleukin-2 in the treatment of autoimmune disease [J]. Oncology & Hematology Review. 2014, 10(2):157–63.
[7] Lighvani, A. A. et al. T-bet is rapidly induced by interferon-γ in lymphoid and myeloid cells. Proc. Natl Acad. Sci. USA.
[8] ChristineKonya, ZivPaz, et al. Update on the role of Interleukin 17 in rheumatologic autoimmune diseases [J]. Cytokine. 2015, 2 (75): 207-215.
[9] Deena Khan and S. Ansar Ahmed. Regulation of IL-17 in autoimmune diseases by transcriptional factors and microRNAs [J]. Front Genet. 2015, 6: 236.
[10] Fiorentino DF, Bond MW, Mosmann TR. Two types of mouse T helper cell. IV. Th2 clones secrete a factor that inhibits cytokine production by Th1 clones [J]. J Exp Med. 1989, 170:2081-2095.
[11] Caroline Diveu, Mandy J McGeachy, et al. Cytokines that regulate autoimmunity [J]. Current Opinion in Immunology. 2008, 20:663–668.
[12] Amy M. Beebe, Daniel J. Cua, et al. The role of interleukin-10 in autoimmune disease: systemic lupus erythematosus (SLE) and multiple sclerosis (MS) [J]. Cytokine & Growth Factor Reviews. 2002, 13: 403–412.
[13] Christopher A.Aoki, Andrea T.Borchersa, et al. Transforming growth factor β (TGF-β) and autoimmunity [J]. Autoimmunity Reviews. 2005, 7(4):450-459.
[14] Sharon M Wahl and Wanjun Chen. Transforming growth factor-β β-induced regulatory T cells referee inflammatory and autoimmune diseases [J]. Arthritis Res Ther. 2005, 7(2):62-8.
[15] Lin Sun, Chang He, et al. Interleukin 12 (IL-12) Family Cytokines: Role in Immune Pathogenesis and Treatment of CNS Autoimmune Disease [J]. Cytokine. 2015, 75(2): 249–255.






