细胞因子治疗
随着分子生物学、细胞生物学和医学生物技术的不断发展,生物治疗学作为一门新的学科,在现代医学中应运而生。在生物治疗中,包括细胞因子、单克隆抗体、干细胞移植、免疫细胞、肿瘤疫苗等生物技术药物产品,其中细胞因子的应用最为广泛。
细胞因子在先天性和适应性免疫系统中介导增殖和信号激活,在机体免疫应答过程中起着十分重要的作用。控制免疫反应的细胞因子是免疫调节的重要组成部分(图1)。
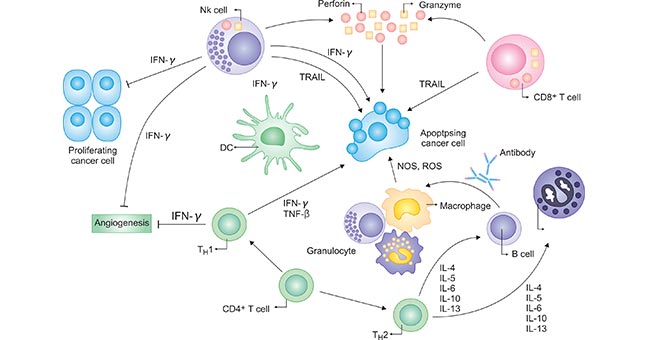
图1. 细胞因子对多种类型的免疫细胞产生刺激和抑制信号
*图片来源于Hematol Oncol Clin N Am 上的出版物 [1]
细胞因子在疾病治疗中得以应用,但可能会受到毒性的限制。因为细胞因子能触发下游分子,包括其他炎症细胞因子,或因产生的反调节物质使得某些重要的分子丧失活性,比如对正常生理保护很重要的抑制分子,这些抑制分子可以防止对病原体的过度反应和细胞损伤,避免自体免疫反应。目前,世界上已批准上市的细胞因子产品有20多种,用于多种疾病的预防和治疗。本文主要介绍治疗癌症所涉及的细胞因子,包括IL-2、IL-4、IL-6、IL-12、IL-15、IL-21、TGFβ和GM-CSF。
IL-2
IL-2能促进T细胞和NK细胞的活化和增殖。IL-2能刺激NK细胞分泌各种细胞因子。IL-2是唯一一个从激活T细胞的纯化产物用于商业化的重组分子,其获取方便,在临床已得到应用。目前仍有许多关于IL-2在不同肿瘤免疫治疗中的研究[2]。
重组人白介-素2(rhIL-2)是基因重组产品,于1992年被FDA批准用于治疗黑色素瘤,1998年被批准用于治疗肾癌。早期对其作用机制的研究使人们对恶性和非恶性状态下细胞和细胞因子的相互作用有了更高的认识,而最近的研究则集中在提高IL-2的治疗指数,改善其在抗原特异性和非特异性治疗中的应用策略。
IL2能激活T细胞,但不好的方面是,IL2也能激活Treg调节细胞,Treg细胞能抑制T细胞的激活和肿瘤杀伤性。此外,IL2还可以诱导活化T细胞的凋亡,引起T细胞过度分化,形成杀伤能力较弱的老化T细胞。目前,普遍观点认为IL2是T细胞的调节剂而不是激活剂。因此,IL2很有可能被其他白细胞介素如IL7、IL15、IL21等取代的趋势。
IL-4
IL-4的功能包括刺激活化的B细胞和T细胞增殖、CD4+T细胞分化为Ⅱ型辅助T细胞、刺激Th2分泌IL-4、IL-5、IL-6、IL-10和IL-13等。IL-4在调节体液免疫和适应性免疫中起着关键作用,可诱导B细胞抗体类转换为IgE,上调MHCⅡ的产生。IL-4可抑制巨噬细胞的生长,诱导单核细胞向DC细胞分化。
IL-4用于胶质瘤治疗的策略是使用胶质瘤细胞和IL-4基因转染的成纤维细胞进行疫苗接种[3]。复发的胶质母细胞瘤(GBM)或无细胞星形细胞瘤的成年参与者进行了复发肿瘤的大面积全切除术,然后用经IL-4和胸苷激酶基因逆转录的成纤维细胞与X线辐照的胶质瘤细胞混合接种2次。接种2次的患者均有良好的临床反应[4]。
IL-6
IL-6又称B细胞刺激因子2(BSF-2)、B细胞分化因子(BCDF)或肝细胞刺激因子(HSF),具有复杂的生物学效应,包括促进T细胞表面IL-2r的表达、在感染或创伤引起的急性炎症时诱导急性期反应性蛋白的合成、促进B细胞增殖、分化和抗体的产生。
最开始,IL-6在许多动物模型中显示出抗肿瘤活性,所以它被应用于临床试验,采用最初的研究设计,包括评估静脉和皮下给药途径。但是,与其他细胞因子类似,IL-6引起非特异性炎症毒性,如发热、寒战和疲劳。此外,IL-6的剂量限制导致血小板增多、室上性心律失常和中枢神经系统毒性,治疗效果不足以作为单药进一步用于癌症[5][6]。近来,研究者发现IL-6可能具有促肿瘤、免疫抑制和促血管生成的作用,目前正在进行针对多种肿瘤的IL-6阻断抗体的临床试验[7]。
IL-12
在目前发现的细胞因子中,IL-12对体内免疫活性细胞的诱导和调节作用最强、最广泛。一方面,IL-12参与了机体的抗肿瘤、抗过敏和抗感染过程;另一方面,IL-12的过量产生会导致机体免疫调节失衡,导致自身免疫性疾病。
IL-12作为一种抗肿瘤药物在临床前模型中的评估已很广泛。针对各种恶性肿瘤,利用IL-12免疫刺激特性,例如IL-12对抗原呈递细胞的强效刺激而产生的疫苗佐剂活性[8][9]。在免疫检查点阻断方法出现之前,rhIL-12在众多动物模型中被认为是很有前景的抗癌细胞因子,包括参与细胞毒性化疗治疗[10]。
IL-15
IL-15与IL-2共享γc受体亚基,刺激T细胞的活化和增殖。在免疫细胞治疗中,IL-15的优势是不会引起活化T细胞的凋亡,另一个特点是维持记忆T细胞,在抗肿瘤活性中起着重要作用。IL-15的抗肿瘤特性源于其对CD8+效应T细胞的刺激活性,同时IL-15可以激活NK细胞、NKT细胞和γδT细胞。IL-15对成熟NK细胞存活方面作用,可能由白血病-2抗凋亡蛋白(bcl-2)的表达所介导[11],这也提示IL-15在癌症免疫治疗中潜在的价值。
IL-21
与IL-2家族的其他成员相似,IL-21通过复合物受体(特异性受体亚基和IL-2受体γc亚基组成)来发挥其生物学功能。IL-21的功能包括,促进CD4+和CD8+T细胞的增殖,增强CD8+T细胞和NK细胞的细胞毒性,而不引起的细胞凋亡。
与IL-2相比,IL-21的关键特征为CD8+T细胞与CD27+/CD28+的选择性扩增。这类细胞被认为是“年轻”的T细胞,具有较强的细胞毒性作用。同时,IL-21不会引起Treg细胞的扩增。IL-21能刺激体外抗原特异性T细胞的产生,提高其对抗原的亲和力,在免疫细胞治疗中的应用越来越广泛。目前,IL-21已进入临床试验,用于特定恶性肿瘤。和许多细胞因子一样,IL-2最初用于肾癌和黑色素瘤的研究[12][13]。
TGFβ
TGF-β是一种细胞因子,能够被调节性T细胞(Treg)当作免疫抑制信号。TGF-β也是被广泛研究的癌症细胞因子,恶性肿瘤会释放大量的TGF-β,使癌细胞快速分裂,同时借助Treg抑制免疫细胞对它们的杀伤,可以说TGF-β兼具肿瘤免疫抑制和治癌活性。
在哺乳动物中,TGF-β有三种异构体,包括TGF-β1、TGF-β2和TGF-β3。在正常的人体组织中,TGF-β1是最主要的同工型,而TGF-β2和TGF-β3的表达很少。TGF-β2同工型在恶性胶质瘤中特异性过度表达。TGF-β2水平的升高与疾病阶段有关,能引起患者的免疫缺陷[14]。Trabedersen是一种合成的反义寡核苷酸,旨在阻断TGF-β2的产生。在一项IIb期试验中,与接受标准化疗的患者相比,脑肿瘤患者在腔内使用曲贝德生(trabedersen)后,生存率有所提高[15]。
GM-CSF
GM-CSF为最早发现,能作用于树突状细胞(DCs)的细胞因子之一。在DCs的培养过程中,GM-CSF能促进单核细胞分化为巨噬细胞,促进细胞表面MHC Ⅱ类分子的表达。GM-CSF还可以招募和激活抗原呈递细胞,对肿瘤衍生抗原进行处理和呈递,促进效应T细胞反应。此外,GM-CSF还可以促进DCs的存活。研究表明,GM-CSF在各种肿瘤模型中激活免疫反应。GM-CSF的抗肿瘤活性,来自其激活巨噬细胞和DC的生物学功能。
GM-CSF还能促进DC细胞的成熟,促进共刺激分子的上调和CD1d受体的表达,从而参与抗原呈递功能。早期研究表明,CD4+和CD8+T细胞参与GM-CSF激活的抗肿瘤免疫。最近的研究表明,NKT在GM-CSF的抗肿瘤活性中起着重要作用。
参考文献:
[1] Ann W. Silk and Kim Margolin. Cytokine Therapy [J]. Hematol. Oncol. Clin. North Am. 2019.
[2] Kim Margolin. Cytokine therapy in cancer [J]. Expert Opin Biol Ther 2008. 8(10): 1471-2598.
[3] Okada H,Lieberman FS, et al. Autologous glioma cell vaccine admixed with interleukin-4 gene transfected fibroblasts in the treatment of recurrent glioblastoma: preliminary observations in a patient with a favorable response to therapy [J]. J Neurooncol. 2003, 64:13-20.
[4] Masasuke Ohno, Atsushi Natsume, et al. Cytokine Therapy [J]. Adv. Exp.Med.Biol. 2012.86-94.
[5] Sosman JA, Aronson FR, et al. Concurrent phase I trials of intravenous interleukin 6 in solid tumor patients:reversible dos-limiting neurological toxicity [J]. Clin Cancer Res. 1997, 3: 39-46.
[6] Weiss GR, Margolin KA, et al. A phase II study of the continuous intravenous infusion of Interleukin-6 for metastatic renal cell carcinoma [J]. J Immunother Emphasis Tumor Immunol. 1995, 18:52 -6.
[7] Trikha M, Corringham R, et al. Targeted anti-interleukin-6 monoclonal antibody therapy for cancer: a review of the rationale and clinical evidence [J]. Clin Cancer Res 2003, 9.4653-65.
[8] Portielje, JE, Gratama JW, et al. IL-12: a promising adjuvant for cancer vaccination [J]. Cancer Immunol Immunother.2003, 52:133-44.
[9] Colombo MP and Trinchieri G. Interleukin-12 in antitumor immunity and immunotherapy [J]. Cytokine Growth Factor Rev.2002, 13: 155-68.
[10] Nars MS, Kaneno R. Immunomodulatory effects of low dose chemotherapy and perspectives of its combination with immunotherapy [J]. Int J Cancer. 2013, 132(11): 2471–8.
[11] Cooper MA, Bush JF, et al. In vivo evidence for a dependence on Interleukin 15 for survival of natural killer cells [J]. Blood. 2002, 100:3633-8.
[12] Davis ID, Skrumsager BK, et al. An open-label, two-arm, Phase I trial of recombinant human interleukin-21 in patients with metastatic melanoma [J]. Clin Cancer Res. 2007, 13: 3630-6.
[13] Thompson JA, Curti BD, et al. Phase I study of recombinant interleukin-21 in patients with metastatic melanoma and renal cell carcinoma [J]. J Clin Oncol. 2008, 26:2034-9.
[14] Kjellman C, Olofsson SP, et al. Expression of TGF-beta isoforms, TGF-beta receptors and SMAD molecules at different stages of human glioma [J]. Int J Cancer. 2000, 89:251-258.
[15] Vallieres L. Trabedersen, a TGFbeta2-specific antisense oligonucleotide for the treatment of malignant gliomas and other tumors overexpressing TGFbeta2 [J]. IDrugs. 2009, 12:445-453.






