细胞因子和神经炎症
细胞因子介导细胞之间的沟通,参与细胞复杂行为的活动。在脑部神经系统疾病,阿尔茨海默病(AD)、肌萎缩侧索硬化症(ALS)、帕金森病和亨廷顿氏舞蹈症中,神经炎症为常见症状。神经炎症反应在脑损伤的发病机制中起重要作用,并常伴有促炎细胞因子和趋化因子的释放。本文主要介绍神经炎症产生的促炎细胞因子的作用。
神经炎症的来源是什么?
在介绍神经炎症产生的促炎细胞因子之前,先了解一下神经炎症的来源。神经炎症包括神经系统对损伤、感染或神经退行性疾病的生化和细胞反应。衰老、代谢性疾病和病毒感染是炎症的主要来源,可影响血管和神经元,导致神经退行性疾病,如SVD,小血管病[1] (图1)。
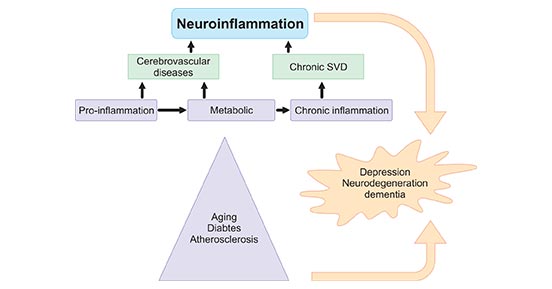
图1. 神经炎症的来源
*图片来源于Mol Med Rep 出版物[1]
有研究表明,在高血压、糖尿病、抑郁症、痴呆症或脑损伤等衰老和代谢性疾病中,神经炎症的分子机制很可能相同 [2]。以老年人为例,炎症机制与痴呆和功能障碍的发病机制有关。全身和局部中枢神经系统炎症能导致小血管病(SVD)引起的血管性痴呆 [3][4],推测微血管改变导致慢性低灌注状态,促使少突胶质细胞持续死亡和髓鞘纤维连续变性,使得低级炎症导致脑卒中风险增大[5]。
神经炎症中的促炎细胞因子
神经炎症,往往在炎症性脱髓鞘疾病(例如,多发性硬化症)和感染(细菌性和病毒性脑炎)中发生,其特征是白细胞侵入中枢神经系统和血脑屏障(BBB)完整性破坏。淋巴细胞和骨髓细胞是组织损伤的主要介质,向组织输送细胞因子,促进炎症级联。研究显示,许多促炎细胞因子是入侵白细胞介导的神经炎症中的关键因子,包括IL-23、IL-6、IL-1β、IFNγ、TNF和GM-CSF[6][7][8] (图2)。IL-1β和IL-6是炎症中枢神经系统中两种重要的细胞因子。IL-23诱导幼稚CD4+T细胞分化为高致病性的Thl7细胞。粒细胞-巨噬细胞集落刺激因子(GM-CSF)诱导组织损伤[9]。
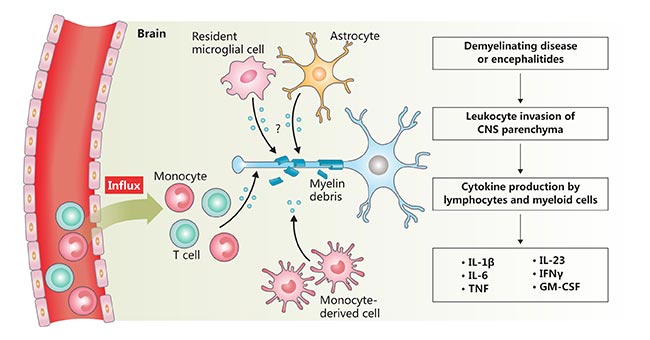
图2. 神经炎症的示意图
*图片来源于Nat Rev Immunol 出版物
IL-23和神经炎症
IL-23是一种异源性细胞因子,由IL-23特有的p19亚基和与IL-12共有的p40亚基组成。IL-23主要由次级淋巴组织中的抗原呈递细胞(APCs)产生,比如巨噬细胞、树突状细胞和小胶质细胞等。IL-23使T细胞向不同的功能表型分化,如产生IL-17的T辅助细胞(Th17)等[10]。研究表明,IL-23/Th17在神经炎症中起着关键作用[11]。
阻断IL-23可改善实验性自身免疫性脑脊髓炎,这是一种多发性硬化症(MS)的动物模型,为中枢神经系统的炎症性脱髓鞘疾病[12]。一般认为,MS发生于急性炎症病变,由于血脑屏障(BBB)的破坏,急性炎症病变由自主反应性T细胞和B细胞介导。这种神经炎症反应导致了由T细胞,B细胞和巨噬细胞组成的炎性细胞的浸润以及脱髓鞘的局灶斑块的形成。YuhongYang等报道,IL-23驱动的Th-17细胞在MS和EAE发病机制中起主要作用[13]。此外,Li等报道,在活动性和慢性活动性多发性硬化病变中,活化的巨噬细胞/小胶质细胞产生IL-23 p19[14]。
IL-6和神经炎症
如前所述,AD患者死后脑内普遍存在神经炎症[15]。β-淀粉样蛋白(Aβ)沉积是AD病理的标志。许多研究证实,Aβ在培养中可诱导星形胶质细胞和小胶质细胞的IL-6表达[16]。在海马神经元中,Aβ和IL-6均能诱导突触功能障碍[17]。
AD能伴随着IL-6水平的上升而上升,但它不能作为生物标志物,因为它也会随着年龄增长而增加。星形胶质细胞和小胶质细胞都可以产生IL-6,IL-6诱导它们增殖和激活,并增强炎症介质的产生和释放,包括前列腺素、细胞因子、趋化因子和急性期蛋白,如APP。此外,IL-6还能上调cdk5/p35复合物,该复合物参与Tau蛋白的过度磷酸化。
IL-1β与神经炎症
IL-1β属于IL-1家族的成员,是最早发现的白细胞介素,通过IL-1R1信号传导发挥促炎反应[18]。神经炎症被定义为大脑对损伤的先天性免疫反应。神经炎症反应的标志是表型胶质激活和免疫信号分子的产生。
IL-1β与体内急性神经炎症形成的过程密切相关。啮齿动物的大脑中的IL-1β,会引起星形胶质细胞和小胶质细胞的快速激活。通过在人体中给药L-1β或在脑中表达IL-1β的小鼠中,证明了IL-1β能够引发自身表达的增强[19]。此外,反哺行为导致IL-1局部的升高就能驱动大脑中的神经炎症变化。
IFNγ与神经炎症
IFNγ是一种促炎细胞因子,由外周细胞,如T淋巴细胞、自然杀伤细胞(NK)和NKT细胞产生。此外,中枢神经系统(CNS)细胞在特定的刺激下也能产生。在健康脑实质中T淋巴细胞、NK和NKT细胞中,IFNγ稀少。IFNγ被认为仅在中枢神经系统感染、炎症性疾病、外伤和脑卒中等病理条件下对脑功能起作用[20]。Sun L等报道抗IFN-γ抗体可加重神经炎症的急性病程,导致体内神经细胞凋亡。促炎细胞因子IFN-γ通过诱导星形胶质细胞分泌的IL-6在急性神经炎症期间提供神经保护[21]。
TNF和神经炎症
TNF又称TNF-α,炎症中的一种关键介质,具有抗菌免疫等多种正常生理功能。神经炎症通常是与大脑相关的炎症,它能激活小胶质细胞和炎症介质的表达,但没有水肿和中性粒细胞浸润等外周炎症的典型特征[22]。
NFκB是激活许多促炎症基因转录的最重要转录因子之一TNF-α诱导NFκB激活,这使TNF-α成为神经炎症关键细胞因子础。有研究表明,TNF-α至少诱导5种不同类型的信号,包括NFκB的激活、细胞凋亡途径、细胞外信号调节激酶(ERK)、p38丝裂原激活蛋白激酶(p38MAPK)和c-Jun N端激酶(JNK)[23][24]。
GM-CSF和神经炎症
多发性硬化症是典型的中枢神经系统(CNS)炎症性疾病。MS病变中包含不同的免疫细胞,但个别细胞类型与疾病病因密切相关。在实验性自身免疫性脑脊髓炎(EAE)中,自身反应性辅助性T(Th)细胞通过产生粒细胞-巨噬细胞集落刺激因子(GM-CSF)作用于髓细胞,诱发中枢神经系统炎症[25]。此外,GMCSF参与T H细胞和骨髓细胞之间的沟通。GM-CSF是病原性T H细胞在IL-23R参与下产生的细胞因子。虽然GM-CSF缺乏会导致EAE的抗原特异性耐受IL7的研究先于有关IL-17在神经炎症中的作用,但直到最近,研究发现了T细胞分泌的GM-CSF与疾病进展之间的联系。
参考文献:
[1] WEI-WEI CHEN, XIA ZHANG, et al. Role of neuroinflammation in neurodegenerative diseases (Review) [J]. Mol Med Rep. 2016, 13(4): 3391–3396.
[2] Allison DJ, Ditor DS. The common inflammatory etiology of depression and cognitive impairment: A therapeutic target [J]. J Neuroinflammation. 2014, 11:151.
[3] de Leeuw FE, de Groot JC, et al. Hypertension and cerebral white matter lesions in a prospective cohort study [J]. Brain. 2002, 125:765–772.
[4] Schiffrin EL. Inflammation, immunity and development of essential hypertension [J]. J Hypertens. 2014, 32:228–229.
[5] Shimizu M, Ishikawa J, et al. The relationship between the morning blood pressure surge and low-grade inflammation on silent cerebral infarct and clinical stroke events [J]. Atherosclerosis. 2011, 219:316–321.
[6] Candice M. Brown, Tara A. Mulcahey, et al. Production of Proinflammatory Cytokines and Chemokines During Neuroinflammation: Novel Roles for Estrogen Receptors α and β [J]. Endocrinology. 2010, 151(10): 4916–4925.
[7] Hu, W. T. et al. Plasma multianalyte profiling in mild cognitive impairment and Alzheimer disease [J]. Neurology. 2012, 79, 897–905.
[8] Patel, N. S. et al. Inflammatory cytokine levels correlate with amyloid load in transgenic mouse models of Alzheimer’s disease [J]. J. Neuroinflamm. 2005, 2, 9.
[9] Burkhard Becher, Sabine Spath, et al. Cytokine networks in neuroinflammation [J]. Nat Rev Immunol. 2017, 17(1):49-59.
[10] Aggarwal, S., Ghilardi, N., et al. Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17 [J]. J. Biol. Chem. 2003, 278, 1910–1914.
[11] Hirokazu Hara, Dai Kimoto, et al. Apomorphine prevents LPS-induced IL-23 p19 mRNA expression via inhibition of JNK and ATF4 in HAPI cells [J]. European Journal of Pharmacology. 2017, 795: 108–114.
[12] Cua, D.J., Sherlock, J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain [J]. Nature. 2003, 421, 744–748.
[13] YuhongYang, Amy E.Lovett-Racke, et al. Role of IL-12/IL-23 in the Pathogenesis of Multiple Sclerosis [J]. Neuroinflammation. 2011, 6: 107-136.
[14] Li, Y., Chu, N., et al. Increased IL-23p19 expression in multiple sclerosis lesions and its induction in microglia [J]. Brain, 2007, 130, 490–501.
[15] Ya-Ying Wu, Jung-Lung Hsu, et al. Alterations of the Neuroinflammatory Markers IL-6 and TRAIL in Alzheimer's Disease [J]. Dement Geriatr Cogn Dis Extra. 2015, 5(3): 424–434.
[16] Lee KS, et al. Peripheral cytokines and chemokines in Alzheimer's disease [J]. Dement Geriatr Cogn Disord. 200, 28:281–287.
[17] Walsh KP, et al. Amyloid-beta and proinflammatory cytokines utilize a prion protein-dependent pathway to activate NADPH oxidase and induce cofilin-actin rods in hippocampal neurons [J]. PLoS One. 2014, 9:e95995.
[18] Andrew S. Mendiola and Astrid E. Cardona. The IL-1β phenomena in neuroinflammatory diseases [J]. J Neural Transm (Vienna). 2018, 125(5): 781–795.
[19] Shaftel SS, Kyrkanides S, et al. Sustained hippocampal IL-1 beta overexpression mediates chronic neuroinflammation and ameliorates Alzheimer plaque pathology [J]. J Clin Invest. 2007, 117 (6): 1595-1604.
[20] S. Monteiro, S. Roque, et al. Brain interference: Revisiting the role of IFNg in the central nervous system [J]. Progress in Neurobiology. 2017.
[21] Sun L, Li Y, et al. Neuroprotection by IFN-γ via astrocyte-secreted IL-6 in acute neuroinflammation [J]. Oncotarget. 2017, 8(25):40065-40078.
[22] Song JH, Lee JW, et al. Glycyrrhizin alleviates neuroinflammation and memory deficit induced by systemic lipopolysaccharide treatment in mice [J]. Molecules. 2013, 18:15788-15803.
[23] Aggarwal BB, Gupta SC, et al. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey [J]. Blood. 2012, 119(3):651-665.
[24] Mubarak Muhammad. Tumor Necrosis Factor Alpha: A Major Cytokine of Brain Neuroinflammation. 2019.
[25] Andrew L. Croxford, Sabine Spath, et al. GM-CSF in Neuroinflammation: Licensing Myeloid Cells for Tissue Damage [J]. Trends in Immunology. 2015, 36(10): 651-662.






