细胞自噬
自噬是指细胞内受损、变性或者衰老的蛋白质和细胞器被运输到溶酶体,溶酶体对其进行消化降解。自噬是一种自我降解并普遍存在于体内的过程,其在清除代谢废物进而会搜能量为细胞正常运转提供能量的过程中发挥重要作用[1]。
1、自噬的过程
自噬形成要经过吞噬泡-自噬小体-自噬溶酶体的过程。首先,当自噬诱导信号被细胞接受后,胞浆某处会形成小膜结构。该膜结构为非球形、扁平状双层膜的碗状结构,并不断扩张,称为自噬前体。其次,不断延伸的自噬前体,将胞浆中的若干成分(包括细胞器)收口包入,成为密闭的球状自噬体。自噬体通常有两个特征:双层膜,内含诸如线粒体、内质网碎片等胞浆成分。最后,自噬体形成后会与溶酶体发生融合,形成自噬溶酶体。期间溶酶体酶降解自噬体的内膜,使两者的内含物合为一体,自噬体中的包含物被降解,将产物例如氨基酸、脂肪酸之类的输送到胞浆中,重新利用供能,而残渣则被排出细胞外或滞留于胞浆 [2]。
2、自噬的分类
根据细胞内底物运送到溶酶体腔的方式不同,哺乳动物的自噬可分为三种,分别是巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导自噬(chaperone-mediated autophagy,CMA)。其中巨自噬是最主要的自噬形式。在巨自噬中由内质网来源的膜性结构通过扩展包裹待降解物形成自噬小体,然后与溶酶体融合并降解其内容物。在微自噬中,溶酶体的膜内陷直接包裹细胞内容物并在溶酶体内降解。在分子伴侣介导自噬中,胞质内蛋白需与分子伴侣结合,然后转运到溶酶体腔中被溶酶体酶消化。CMA的底物是可溶蛋白分子,与前面两种自噬相比,CMA降解途径在清除蛋白质时有选择性[3]。
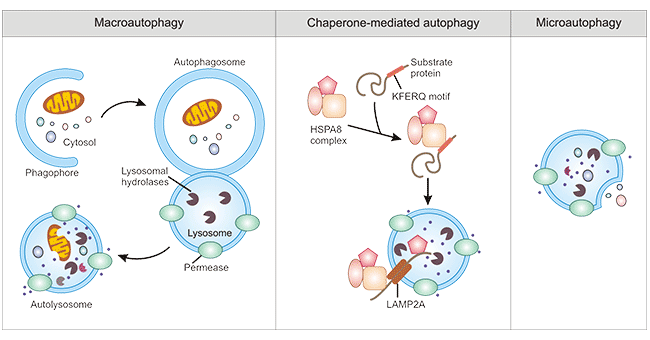
图1. Three types of autophagy in mammalian
此外,根据自噬对待降解底物的选择性不同,自噬可进一步分为线粒体自噬(mitophagy)、内质网自噬(reticulophagy)、核糖体自噬(ribophagy)和过氧化物酶体自噬(pexophagy)等。其中,线粒体自噬是目前的一个研究热点。
3、介导细胞自噬的重要因子
自噬是细胞自我降解的过程,涉及蛋白质降解、细胞器更新和细胞质成分的非选择性分解,这些过程涉及多个基因的调控。自噬启动始于ULK1(也称为Atg1)复合物的激活(包括ULK1、ULK2、Atg13、FIP200/RB1CC1和Atg101),它激活由核心组分Beclin-1、VPS34/PIK3C3和其他被招募的可变组分(如Atg14L、UVRAG、AMBRA1等)组成的III类PI3K复合物,不同的III类PI3K复合物发挥不同功能[4][5]。与Atg16结合的Atg5-Atg12复合物介导自噬体膜的扩展,LC3和GABARAP家族成员与脂质磷脂酰乙醇胺(PE)结合后并被招募到膜上。Atg4与Atg7结合后,将LC3-I和PE偶联并形成脂质结合形式LC3-II[6]。更多详情,请点击此处查看>>
j9九游会登录入口首页生物罗列了部分自噬相关靶点,点击对应靶点可查看该靶点相关的所有试剂。
● ULK1激酶复合体组分
● Beclin-1核心复合体组分
● Beclin-1复合体活性调节蛋白
● 自噬泡延伸相关蛋白
● LC3家族
● LC3加工相关蛋白
● 自噬泡底物转运蛋白
参考文献:
[1] Danielle Glick, Sandra Barth, and Kay F. Macleod. Autophagy: cellular and molecular mechanisms [J]. J Pathol. 2010 May; 221(1): 3-12.
[2] Mizushima N. Autophagy: process and function [J]. Genes Dev. 2007, 21 (22): 2861-73.
[3] Parzych KR, Klionsky DJ. An overview ofautophagy: morphology, mechanism, and regulation [J]. Antioxid Redox Signal. 2014Jan 20;20(3):460-73.
[4] Zhiping Xie, Daniel J Klionsky. Autophagosome formation: core machinery and adaptations [J]. Nature Cell Biology. 2007, 9: 1102-1109.
[5] Jean M Mulcahy Levy, Christina G Towers, Andrew Thorburn. Targeting autophagy in cancer [J]. Nat Rev Cancer. 2017, 17(9): 528-542.
[6] Elena Shvets & Zvulun Elazar. Autophagy-independent incorporation of GFPLC3 into protein aggregates is dependent on its interaction with p62/SQSTM1 [J]. Autophagy. 2007, 3(4):323-8.






