研究火热的“铜死亡”
2022年3月17日,美国哈佛大学和麻省理工学院布罗德研究所的TODD R. GOLUB团队合作,在顶级学术期刊Science发表题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”的研究性论文,作者发现:细胞体内依赖于铜离子且受到调控的新的细胞死亡方式--“铜死亡”(Cuprotosis)。
在过去约30年中,细胞死亡研究已经走了很长一段路,除了揭示基本生物学过程的机制外,它还带来了针对癌症和其他疾病(例如某些自身免疫性病理学或传染病)的新疗法,其中细胞凋亡、细胞焦亡、细胞坏死和铁死亡,是近年来研究得最为广泛的几种形式。(点击查看相关“细胞生物学”专题文章),这里我们了解下最新报道的“铜死亡”。
1. “铜死亡”
TODD R研究团队揭示的“铜死亡”是一种全新的、受调控的细胞死亡方式。铜离子直接结合三羧酸(TCA)循环中的硫辛酰化组分,导致硫辛酰化蛋白的异常聚集,Fe-S簇蛋白表达下降,从而引起蛋白毒性应激反应并导致细胞死亡。
这意味着可以针对相关分子,制定出一套更有效的铜离子载体治疗方案,特别是针对FDX1、硫辛酰化水平高,依赖线粒体呼吸的肿瘤类型。因此,“铜死亡”作为最新提出的一种细胞死亡机制,引起学术界的振奋!
2.“铜死亡”调节机制
通过TODD R团队的研究结果部分,我们可以了解到铜离子载体导致细胞死亡的机制,具体结果分析过程如下:
1)铜离子载体诱导的细胞死亡是新型的细胞死亡
首先研究团队发现,铜离子载体均能杀伤细胞,且使用铜离子载体Elesclomol,可调控铜介导的细胞死亡。那这种死亡方式,是否区别于已知的死亡方式(细胞凋亡、细胞坏死、铁死亡)?为了进一步验证,团队通过敲除凋亡关键效应因子Bax和BAK1,结果发现未能阻止铜离子载体诱导的细胞死亡,说明其细胞死亡机制明显不同于已知的细胞死亡途径。这些数据证实,铜离子载体诱导的细胞死亡是一种全新的细胞死亡形式。
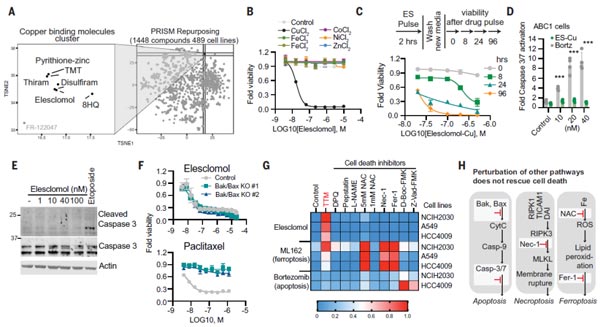
图1. 铜离子载体诱导的细胞死亡是新型的细胞死亡 [1]
2)线粒体呼吸调节铜离子载体诱导的细胞死亡
紧接着,TODD R团队发现线粒体呼吸在这种死亡机制中发挥关键作用。实验数据表明,当细胞依赖于线粒体呼吸时,其对铜离子载体的敏感性比进行糖酵解细胞高近1千倍;使用线粒体抗氧化剂、脂肪酸以及线粒体功能抑制剂处理细胞,会显著影响细胞对铜离子载体的敏感性。
此外,线粒体解聚物FCCP对铜离子载体诱导的细胞死亡没有影响;随后团队检测了细胞不同类型的缺氧刺激,与铜离子载体处理对细胞耗氧率(OCR)的影响,数据表明,铜不会直接针对电子传递链(ETC),而是只在三羧酸(TCA)循环中发挥作用。这些论证表明,铜诱导细胞死亡所必需的是线粒体呼吸。
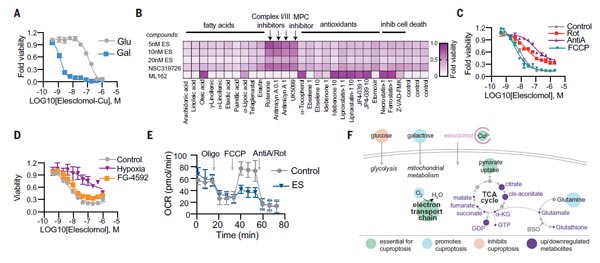
图2. 线粒体呼吸调节铜离子载体诱导的细胞死亡 [1]
3)FDX1与蛋白硫辛酰化是铜离子载体诱导细胞死亡的关键介质
为进一步明确细胞死亡的代谢路径,研究团队使用了全基因组CRISPR-Cas9功能缺失筛选,并采用不同结构的铜离子载体进行处理,以提高筛选的普遍性。团队对3千种代谢酶进行独立的敲除筛选。
从以上的筛选中,他们找到了七个正调控基因(FDX1、LIAS、LIPT1、DLD、DLAT、PDHA1和PDHB)以及三个负调控基因(MTF1、GLS和CDKN2A),其中铁氧还蛋白 1基因(ferredoxin 1,FDX1)和蛋白质硫辛酰化(Protein lipoylation)是铜离子载体诱导细胞死亡的关键调控因子。通过个别基因敲除研究,缺失FDX1和硫辛酸合酶基因(lipoic acid synthase,LIAS)可增强对铜诱导的细胞死亡的抵抗力,进一步说明FDX1和蛋白硫辛酰化与铜离子载体诱导的细胞死亡之间的功能联系。这些研究表明,FDX1与蛋白硫辛酰化是铜离子载体诱导细胞死亡的关键介质。
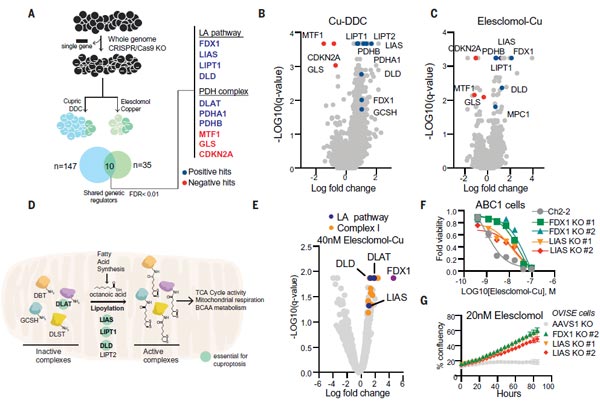
图3. FDX1与蛋白硫辛酰化是铜离子载体诱导细胞死亡的关键介质 [1]
4)FDX1是蛋白硫辛酰化的上游调控因子
进一步的,研究团队发现,敲除FDX1或硫辛酰化相关酶均可以保护细胞免遭铜毒性,因此,他们提出猜想,FDX1可否为蛋白质硫辛酰化的上游调节因子?通过癌症依赖性图谱(Cancer Dependency Map)等公共数据库,他们发现FDX1和硫辛酰化相关酶与细胞存活高度相关。
随后,他们对208例人类肿瘤标本进行FDX1和硫辛酸途径蛋白的免疫组化(IHC)染色分析,结果显示FDX1和硫辛酰化蛋白的表达高度相关;WB实验又进一步确认了FDX1的敲除会导致二氢硫辛酰胺转乙酰基酶基因(Dihydrolipoamide S-Acetyltransferase,DLAT)和二氢硫辛酰胺S-琥珀酰转移酶(DLST,Dihydrolipoamide S-Succinyltransferase)的蛋白硫辛酰化缺失;通过代谢物分析发现,FDX1的缺失会导致丙酮酸和α-酮戊二酸的积累,琥珀酸的消耗,以及LIAS的关键底物S-腺苷甲硫氨酸(SAM)的积累。以上数据证实,FDX1参与调节蛋白的硫辛酰化过程。
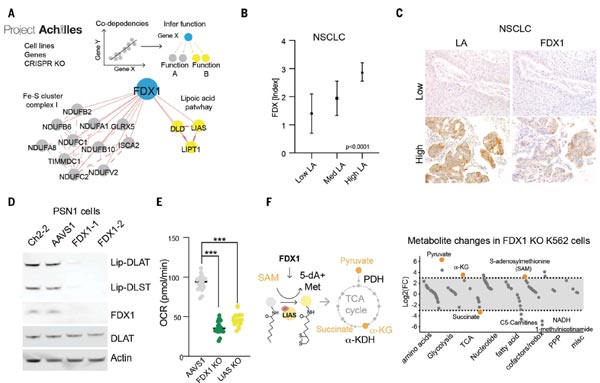
图4. FDX1是蛋白硫辛酰化的上游调控因子 [1]
5)铜直接结合硫辛酰化DLAT并诱导其寡聚化
通过前面的实验,作者建立了铜死亡和蛋白质脂酰化之间的联系,但只是间接证实FDX1和硫辛酰化的蛋白在铜死亡中的重要性,没有建立直接的机制联系。那么,铜是否直接与脂酰化蛋白质结合呢?
为此,研究团队在FDX1敲除细胞与正常细胞的裂解液中纯化出DLAT和DLST两种蛋白,结果发现正常细胞中的DLAT和Lip-DLST(硫辛酰化状态),会直接与铜离子结合,但不与钴或镍树脂结合。而FDX1敲除细胞中的DLAT和DLST(去硫辛酰化状态)则不与铜结合,表明蛋白的硫辛酰化修饰,是直接结合铜的必要条件。
此外,对Elesclomol敏感细胞的处理会增加DLAT寡聚体的水平,而对Elesclomol不敏感细胞系或FDX1敲除处理,只有在Elesclomol高浓度下才能导致DLAT寡聚。通过质谱分析进一步发现,铜离子载体处理还可导致Fe-S簇蛋白的水平降低。以上数据表明,铜直接结合硫辛酰化DLAT并诱导其寡聚化。
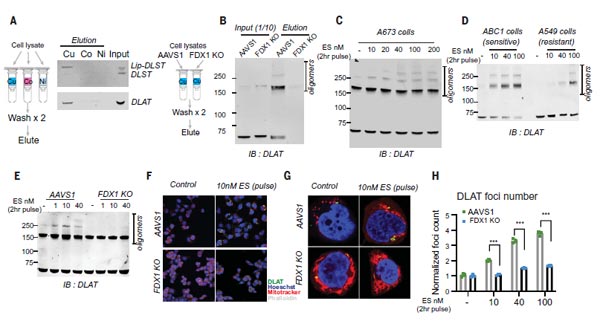
图5. 铜直接结合硫辛酰化DLAT并诱导其寡聚化 [1]
6)铜过量导致的细胞死亡机制与铜离子载体诱导的细胞死亡机制是同一种机制
研究到这儿,通过以上1-5的验证,铜死亡的机制已揭晓:铜离子载体诱导细胞内铜离子水平上升至超过阈值,过量的铜促进硫辛酰化蛋白聚集,并使Fe-S簇蛋白不稳定,导致细胞蛋白毒性应激增高,最后诱导细胞死亡。但是,团队再次提出疑问:铜离子载体诱导的细胞死亡与自然发生的铜稳态功能障碍是否是同一种分子机制导致?
为探索其潜在联系,研究者首先在人胚胎肾HEK 293T和ABC1细胞中过表达铜运载体SLC31A1(铜稳态的关键靶点),数据表明,铜输入显著增强了细胞对线粒体呼吸相关蛋白的总消耗,导致蛋白硫辛酰化减少,Fe-S簇蛋白水平降低,HSP70应激蛋白水平升高。
更值得关注的是,过表达SLC31A1的细胞中,铁死亡、坏死性凋亡、凋亡抑制剂和抗氧化剂,均都不能阻止铜诱导的细胞死亡,但铜螯合剂、FDX1 Knockdown和LIAS Knockdown却可以减轻细胞死亡现象。
最后,研究者采用Wilson's disease小鼠模型发现,老年Atp7b缺陷小鼠的肝脏中,蛋白的硫辛酰化水平和Fe-S簇蛋白的含量,均显著降低,Hsp70蛋白则升高。通过多种模型分析,基因诱导下的铜过量导致的细胞死亡机制与铜离子载体诱导的细胞死亡机制是同一种机制。

图6. 铜过量导致的细胞死亡机制与铜离子载体诱导的细胞死亡机制是同一种机制 [1]
3.“铜死亡”相关热门靶点
目前该研究中,作者主要发现了多个与“铜死亡”代谢途径特异性相关的调节基因。这些关键调节因子在“铜死亡”过程中的具体作用,以及铜毒性治疗癌症的有效性将是未来的研究热点。
j9九游会登录入口首页生物汇总了当前与“铜死亡”相关信号通路中,大部分热门靶点抗体产品,点击靶点对应货号可查看相关试剂(具体详情见下表)。
“铜死亡”热门靶点抗体产品汇总:
| 信号通路 | 调控方式 | 关键靶点 | 货号 | 宿主 | 反应种属 | 适用应用 |
|---|---|---|---|---|---|---|
| 硫辛酰途径 | 正调控 | DLD | CSB-PA006928LA01HU | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC |
| CSB-PA783949 | Rabbit | Human, Mouse, Rat | ELISA, IHC | |||
| DLAT | CSB-PA006926LA01HU | Rabbit | Human | ELISA, WB, IP | ||
| CSB-PA445587 | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC | |||
| 丙酮酸脱氢酶(PDH)复合物体途径 | LIAS | CSB-PA012927LA01HU | Rabbit | Human | ELISA, WB, IHC | |
| PDHA1 | CSB-PA017715LA01HU | Rabbit | Human | ELISA, IHC, IF | ||
| CSB-PA247984 | Rabbit | Human | ELISA, WB, IHC | |||
| PDHB | CSB-PA017717ESR2HU | Rabbit | Human | ELISA, IHC | ||
| CSB-PA017717GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| 负调控 | GLS(GAM/GAC/KGA) | CSB-PA009528DA01HU | Human, Mouse | Rabbit | ELISA, WB, IHC | |
| CSB-PA969762 | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| CSB-PA177709 | Human, Mouse, Rat | Rabbit | ELISA, IHC | |||
| MTF1 | CSB-PA013754LA01HU | Human | Rabbit | ELISA, WB, IHC, IF | ||
| P16-INK4A(CDKN2A) | CSB-PA005089LA01HU | Human | Rabbit | ELISA, IHC | ||
| CSB-PA003618 | Human, Mouse | Rabbit | WB, ELISA | |||
| 甘氨酸裂解酶系统(GCS)系统途径 | / | GCSH | CSB-PA009335GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC, IF |
参考文献:
1. Tsvetkov, Peter, et al. "Copper induces cell death by targeting lipoylated TCA cycle proteins." Science 375.6586 (2022): 1254-1261.






