死亡受体主导的细胞凋亡
日期:2018-01-18 16:38:40
在上两章中我们综合阐述了细胞凋亡的概念,以及详细探讨了细胞凋亡的内部线粒体途径和内部内质网途径,本篇文章将带来死亡受体主导的细胞凋亡机理,希望有助于科学探讨。
1.细胞凋亡的概念
2.细胞凋亡的分类
2.1细胞凋亡的内部线粒体途径
2.2细胞凋亡的内部内质网途径
2.3细胞凋亡的外部死亡受体途径
死亡受体(DR)属肿瘤坏死因子受体(TNFR)超家族,共同拥有富含Cys的胞外结构域和胞内死亡结构域(DD)。当死亡受体与特定的死亡配体结合后,其接收胞外的死亡信号,激活细胞内的凋亡机制,诱导细胞凋亡。目前所知的死亡受体—配体主要有Fas(APO-1、CD95)—FasL(CD95L),TNFR1(DR1)—TNF,TRAILR1(DR4)—TRAIL(APO-2L),TRAILR2(DR5)—TRAIL(APO-2L),DR3(APO-3、TRAMP)—TL1A等。目前凋亡的死亡受体信号通路主要有3条:Fas、TNFR1、TRAIL。
2.3.1Fas信号通路径
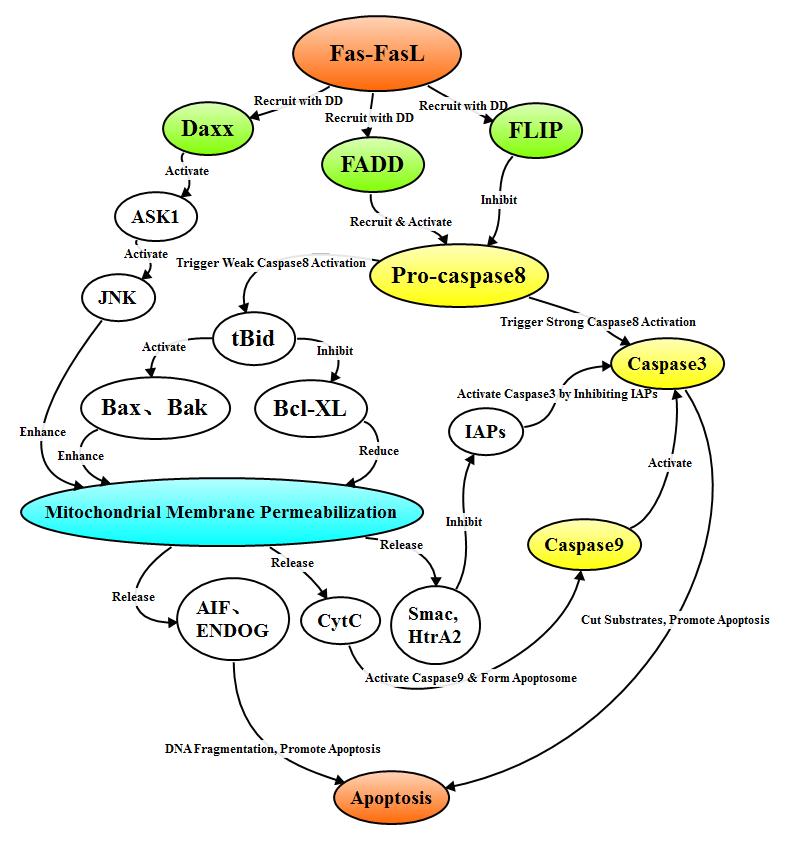
当FasL同源三聚体复合物与Fas结合时启动Fas—FasL介导的外部死亡受体途径的细胞凋亡。在信号传导的过程中,与配体结合的3个Fas受体分子形成三聚体,细胞内的DD聚集成簇募集FADD、Daxx、FAP-1、FLIP等相关蛋白。FADD通过死亡效应结构域DED募集pro-caspase8形成死亡诱导信号传导复合物(DISC),DISC中的pro-caspase8自我剪切成具有活性的Caspase8。FLIP包含DED,能够整合到死亡受体的DISC中,FLIP通过竞争性结合FADD上的DED或Caspase8上的DED从而抑制pro-caspase8的激活。
在不同类型的细胞中Caspase8激活Caspase3的途径也有很大差异。在I型细胞中DISC复合物激活大量的Caspase8,Caspase8激活Caspase3,Caspase3作用于各种可以引起细胞凋亡的底物,从而导致细胞凋亡;在II型细胞中只有少量的Caspase8被激活,活化的Caspase8可以激活Bid转化成tBid,tBid转移至线粒体膜,激活Bcl-2家族促凋亡因子抑制Bcl-2家族抗凋亡因子,通过线粒体途径接到细胞凋亡。此外,Fas的DD结构域募集的Daxx还可以激活JNK信号通路,通过线粒体途径和增强促凋亡基因例如p53、Fas、FasL的转录表达介导细胞凋亡。
2.3.2TNFR1信号通路
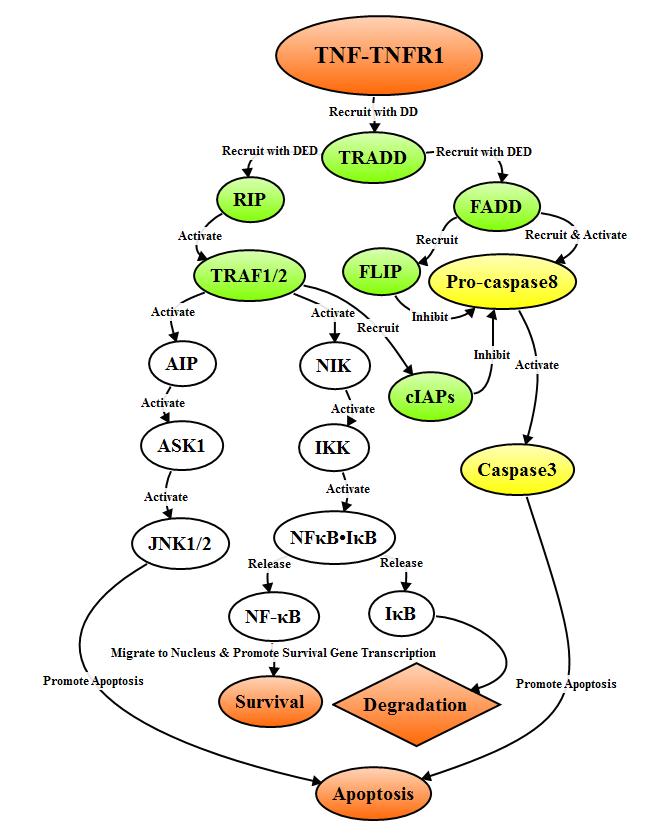
TNF三聚体与TNFR1结合后诱导TNFR1的DD聚集募集衔接蛋白TRADD,TRADD可募集TRAF2、RIP和FADD等信号分子。TRAF2和RIP可激活NF-κB和JNK/AP信号通路,而FADD可以激活Caspase级联反应,衔接蛋白TRADD募集信号分子的差异,决定了细胞的生存或死亡。
衔接蛋白TRADD与FADD结合后,FADD通过DED募集并激活pro-caspase8,形成具有活性的Caspase8,Caspase8引发Caspase级联反应介导细胞凋亡;FADD同时可募集FLIP,抑制释放活性Caspase8。当衔接蛋白TRADD通过DD与RIP结合时,激活TNFR相关因子(TRAF-2),TRAF-2可以结合TRAF-1,募集cIAPs,形成的复合物抑制Caspase8的活性和释放,从而抑制细胞凋亡;此外TRAF-2可以激活NF-κB诱导激酶(NIK),继而通过磷酸化作用激活IκB激酶(IKK),IKK磷酸化IκB,释放NF-κB,然后转位至胞核,激活抗凋亡基因例如cIAP、FLIP、Bcl-XL的表达,促进细胞生存。
2.3.3TRAIL信号通路
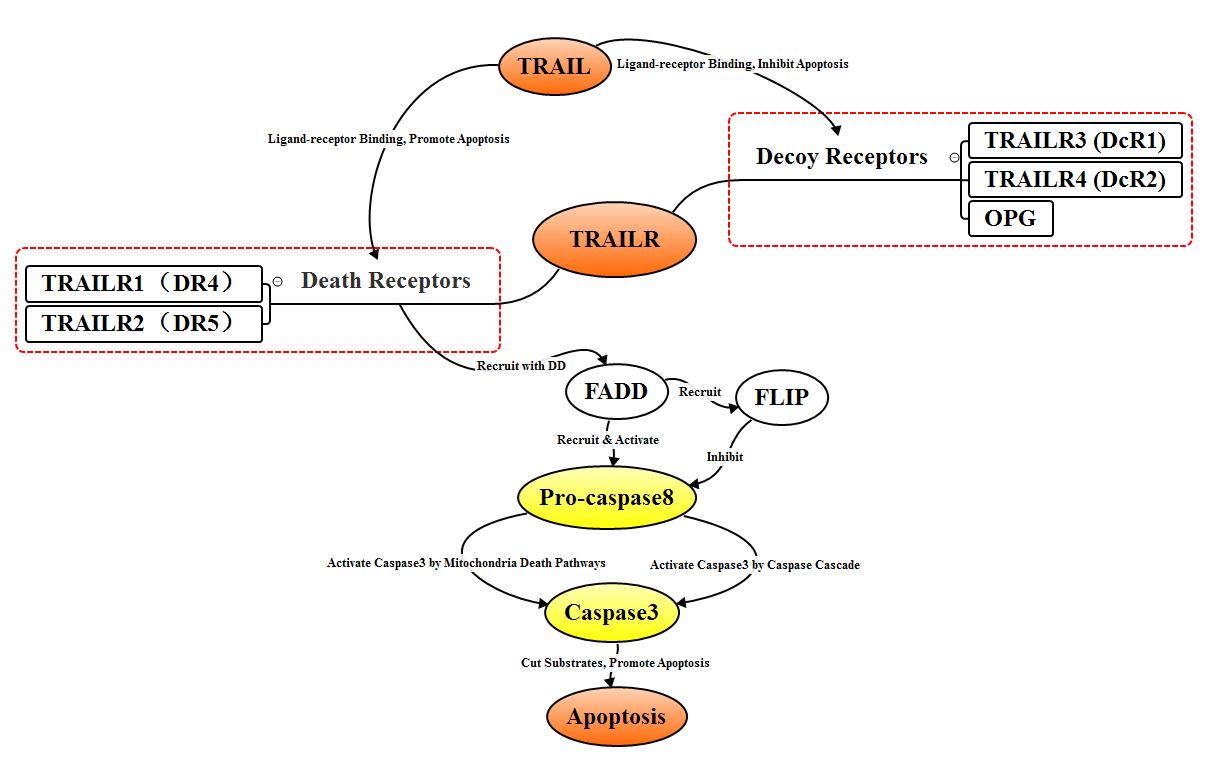
TNF相关的凋亡诱导配体(TRAIL)属于II型跨膜蛋白。目前为止,发现至少5种TRAIL受体TRAILR1(DR4)、TRAILR2(DR5)、TRAILR3(DcR1)、TRAILR4(DcR2)、OPG。TRAIL受体可分为两类,一类为诱骗受体TRAILR3、TRAILR4、OPG,另一类为死亡受体TRAILR1、TRAILR2。诱导受体主要存在于正常细胞中,当与配体TRAILR结合后,可形成无功能的复合物,阻碍细胞凋亡。TRAILR1、TRAILR2在癌细胞中的表达量明显增高,与配体TRAIL结合后,通过DD与FADD结合,募集pro-caspase8,形成DISC,DISC中的pro-caspase8自我剪切成具有活性的Caspase8,Caspase8通过与Fas相似的Caspase途径和线粒体依赖途径激活Caspase3,从而介导细胞凋亡。
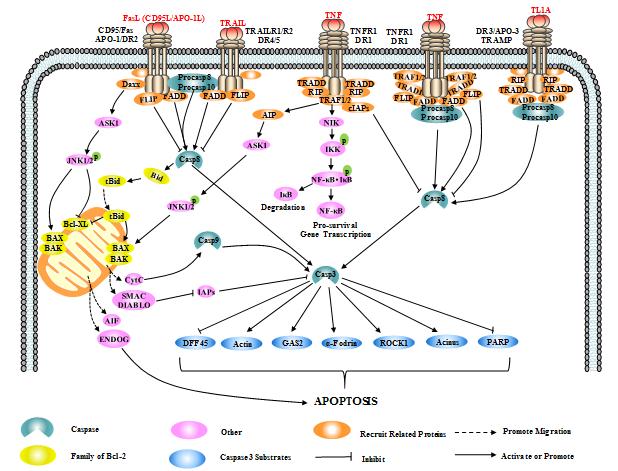
▲死亡受体介导细胞凋亡的信号通路
往期回顾:线粒体主导的细胞凋亡
内质网主导的细胞凋亡
下期预告:美图鉴赏
3.参考文献
[1] Declercq W, Vanden B T, Vandenabeele P. RIP kinases at the crossroads of cell death and survival [J]. Cell, 2009, 138(2): 229.
[2] Kantari C, Walczak H. Caspase-8 and bid: caught in the act between death receptors and mitochondria [J]. Biochimica et Biophysica Acta, 2011, 1813(4): 558-563.
[3] Kaufmann T, Strasser A, Jost P J. Fas death receptor signalling: roles of Bid and XIAP [J]. Cell Death & Differentiation, 2012, 19(1): 42-50.
[4] Lavrik I N, Krammer P H. Regulation of CD95/Fas signaling at the DISC [J]. Cell Death & Differentiation, 2012, 19(1): 36-41.
[5] Van H F, Festjens N, Declercq W, et al. Tumor necrosis factor-mediated cell death: to break or to burst, thats the question [J]. Cellular and Molecular Life Sciences, 2010, 67(10): 1567-1579.
[6] Wajant H, Scheurich P. TNFR1-induced activation of the classical NF-κB pathway [J]. The FEBS Journal, 2015, 278(6): 862-876.
[7] Yoon J H, Gores G J. Death receptor-mediated apoptosis and the liver [J]. Journal of Hepatology, 2002, 37(3): 400-410.
[8] Wajant H. Death receptors [J]. Essays in Biochemistry, 2003, 39: 53-71.
[9] Lavrik I, Golks A, Krammer P H. Death receptor signaling [J]. Journal of Cell Science, 2005, 118(2): 265-267.
[10] Sartorius U, Schmitz I, Krammer P H. Molecular mechanisms of death-receptor-mediated apoptosis [J]. Chembiochem: A European Journal of Chemical Biology, 2001, 2(1): 20-29.
[11] Schmitz I, Kirchhoff S, Krammer P H. Regulation of death receptor-mediated apoptosis pathways [J]. International Journal of Biochemistry & Cell Biology, 2000, 32(11-12): 1123-1136.
上一篇: 内质网主导的细胞凋亡
下一篇: 流感爆发,你中了吗?











