线粒体主导的细胞凋亡
日期:2018-01-03 17:55:41
1.细胞凋亡的概念
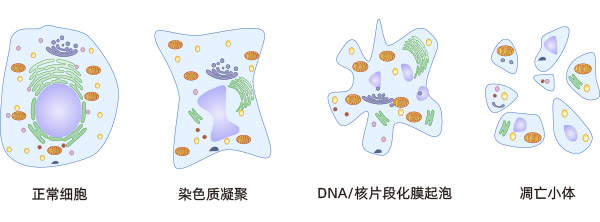
细胞凋亡是指机体在生理或病理条件下,为了维持自身内环境的稳态,通过基因调控使细胞产生主动、有序的死亡;同时伴随着一系列形态和生化方面的变化,包括核固缩、DNA片段化、细胞膜重塑和起泡、细胞皱缩、形成凋亡小体等,最后凋亡的细胞被巨噬细胞吞噬而消亡。细胞凋亡是细胞为了更好地适应其内外环境而引发的死亡过程,它是一种正常的细胞死亡,涉及一系列基因的激活、表达及调控等。在细胞凋亡整个过程中,质膜保持完整,细胞无内容物外溢,不引起炎症反应。
2.细胞凋亡的分类
凋亡发生的途径分为内源性线粒体途径、内源性内质网途径、外源性死亡受体途径;或者某些条件下的granzyme B介导的凋亡过程。
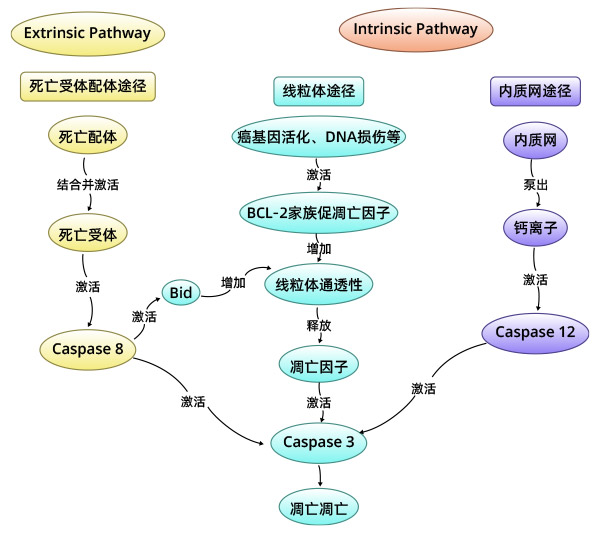
2.1 细胞凋亡的内部线粒体途径
细胞凋亡的内部线粒体途径:当细胞受到内部凋亡刺激因子作用,如癌基因的活化DNA损伤、细胞缺氧、细胞生长因子缺失等,可激活细胞内部线粒体凋亡途径,引起细胞凋亡;内部线粒体凋亡途径也可以被死亡配体所激活。在该途径中,Bcl-2家族蛋白通过调节膜电位从而控制线粒体外膜通透性。
2.1.1Bcl-2家族
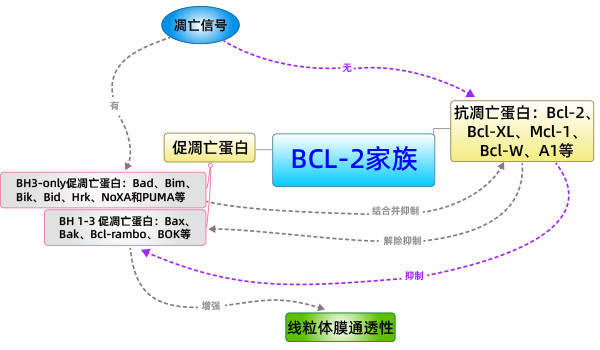
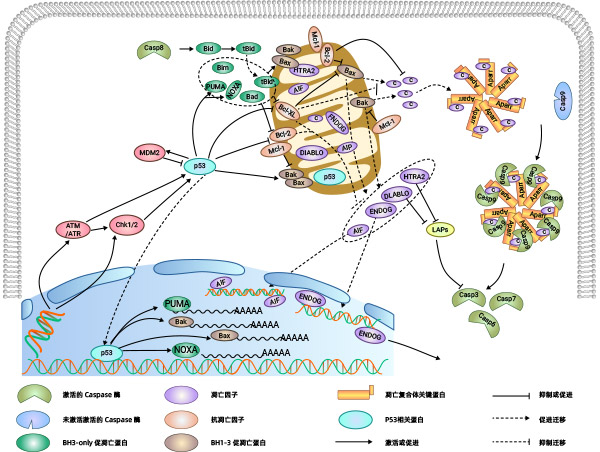
Bcl-2家族蛋白是控制线粒体相关的凋亡因子释放的主要调节因子。根据它们在细胞凋亡中的作用可分为两类:促凋亡蛋白和抗凋亡蛋白,其中促凋亡蛋白还可以分为具有BH1-3结构域的蛋白和只具有BH3结构域的蛋白。促凋亡蛋白成员中的Bak以及抗凋亡蛋白成员如Bcl-2,Bcl-xL等主要存在于线粒体膜上;其他成员如Bid、Bad主要存在于胞质中。Bax一般存在于胞质中,当接收到凋亡信号时,Bax重新定位于线粒体表面,在线粒体表面构成跨线粒体膜的孔,导致膜电位降低,膜通透性增加,从而释放凋亡因子。
目前关于Bax、Bak的激活方式,存在两种假说:直接激活模式和间接激活模式。间接激活模式:在一般情况下,Bax、Bak的活性是被抗凋亡蛋白所抑制的。当BH3-only的家族成员接收到凋亡信号后,抑制抗凋亡蛋白的活性,从而间接激活Bax、Bak的活性。
直接激活模式:BH3-only蛋白分为激活蛋白和激敏蛋白。未接受凋亡信号的激活蛋白和抗凋亡蛋白结合抑制激活蛋白激活Bax、Bak,当接收到凋亡信号时,激敏蛋白与抗凋亡蛋白相结合释放出激活蛋白,激活蛋白直接激活Bax、Bak的活性。
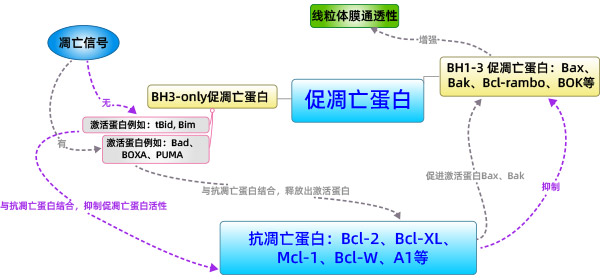
总之,Bcl-2家族蛋白在细胞凋亡过程中由其促凋亡成员和抗凋亡成员之间的协同作用,通过线粒体途径共同决定细胞是否进入凋亡程序。
2.1.2线粒体介导的凋亡过程
当线粒体的膜电位下降,线粒体膜通透性增加,线粒体内促凋亡因子(例如:Cyt C、AIF、SMAC/DIABLO、HTRA2/OMI、ENDOG)释放到胞质中。Cyt C释放到胞内以后,与Apaf-1相互作用,在ATP和dATP的协助下形成凋亡复合体,凋亡复合体通过招募并激活Pro-Caspase9,形成Caspase9全酶。Caspase9全酶进一步激活效应Caspase3和Caspase7,启动Caspase级联反应,切割细胞中如α-tubulin、Actin、PARPA、Lamin等超过100种的底物,最终导致细胞凋亡。
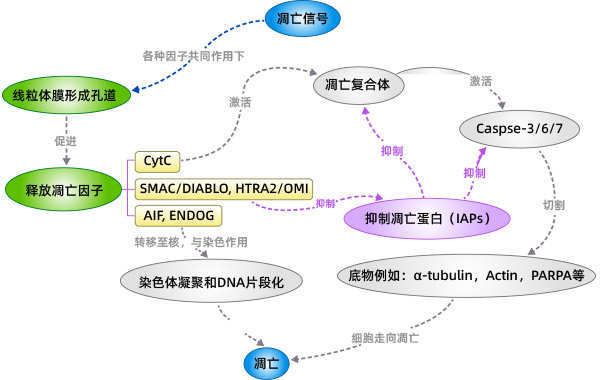
凋亡抑制蛋白(IAPs)可以抑制Caspase3、Caspase7激活,从而抑制细胞凋亡。SMAC/DIABLO、HTRA2/OMI从线粒体释放到胞内后与IAPs结合后,解除IAPs的抑制作用从而间接促进凋亡。
随着线粒体膜电位的改变,释放到胞内的还有AIF、ENDOG。随后AIF、ENDOG会被转运至细胞核。AIF、ENDOG引起细胞核中的染色体凝聚和DNA片段化,从而导致细胞凋亡。
线粒体介导的凋亡
下期预告:
内质网主导的细胞凋亡
3.参考文献
[1] Brenner D, Mak T W. Mitochondrial cell death effectors [J]. Current Opinion in Cell Biology, 2009, 21: 871-877.
[2] Chalah A, Khosravi-Far R. The mitochondrial death pathway [J]. Advances in Experimental Medicine and Biology, 2008, 615: 25-45.
[3] Lindsay J, Esposti M D, Gilmore A P. Bcl-2 proteins and mitochondria—Specificity in membrane targeting for death [J]. Biochimica et Biophysica Acta, 2011, 1813: 532-539.
[4] Ola M S, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis.[J]. Molecular and Cellular Biochemistry, 2011, 351: 41-58.
[5] Pradelli L A, Bénéteau M, Ricci J E. Mitochondrial control of caspase-dependent and -independent cell death [J]. Cellular and Molecular Life Sciences, 2010, 67: 1589-1597.
[6] Rong Y, Distelhorst C W. Bcl-2 protein family members: versatile regulators of calcium signaling in cell survival and apoptosis [J]. Annual Review of Physiology, 2008, 70: 73-91.
[7] Speidel D. Transcription-independent p53 apoptosis: an alternative route to death [J]. Trends in Cell Biology, 2010, 20: 14-24.
[8] Suen D F, Norris K L, Youle R J. Mitochondrial dynamics and apoptosis [J]. Genes & Development, 2008, 22: 1577-1590.
[9] Danial N N, Korsmeyer S J. Cell Death: Critical Control Points [J]. Cell, 2004, 116: 205-219.
[10] Green D R, Kroemer G. The pathophysiology of mitochondrial cell death [J]. Science, 2004, 305: 626-629.











