我的后半生——自噬
日期:2017-07-27 13:24:53
长达一个多月的追剧后,引起无数议论热潮的“我的前半生”于前天剧终。小编顿时陷入剧荒的境地,在看了几十篇各种论小三上位、婚姻危机、职场潜规则的剧评后,犹觉不足,又找出亦舒的原作来看。
最终得出一个结论,我的前半生——凋亡,我的后半生——自噬。
凋亡和自噬,相爱相杀。活着是为了死去,死去是为了活着。
凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。在原作中,子君是一个有品位的女人,家庭生活、孩子,打理的井井有条,这何尝不是一种稳定?但是,她为此牺牲了自己的职场生涯,丧失了本应有的自我。
自噬是指细胞应对各种生存压力的一种自我保护机制,是细胞应对恶劣环境的一种主动反应。当子君丧失了保护伞后,她开始自强自立,开始工作,为养活自己。
在原著中,子君的前半生是婚姻,后半生是工作;而唐晶的前半生是工作,后半生是婚姻。从这一点看,原作倒是很符合小编的论点。
好了,子君的前半生已经结束,今天,就和小编一起,来了解下我的后半生——自噬。
毕竟,偶们是搞科研滴~~
什么是自噬
细胞自噬(Autophagy)是真核生物中一种由溶酶体介导的高度保守的降解过程。在能量匮乏,活性氧累积等各种胁迫条件下时,细胞通过形成双层膜结构的自噬小体,包裹一部分胞内物质并将其运送到溶酶体进行降解和重新利用,从而维持细胞的存活。
“自噬”(autophagy)一词源于希腊语前缀“auto-”,意为“自我”,以及另一个希腊语单词“phagein”,意为“吞食”。因此,自噬作用的意思非常明确,那就是“自我吞噬”。好吧,简单的说,自噬是细胞内自我消化、自我降解的过程,它广泛存在于真核细胞生物和哺乳动物之间。
严格意义上讲,你身体里的细胞正在吃自己。Oh my gosh,是不是想想都觉得很恐怖?
在生理条件下,自噬可以清除受损的细胞器如线粒体以及蛋白质聚合体,起到细胞内“清道夫”的功能,从而维持细胞的稳态平衡。可以说,自噬参与着组织、器官和个体的生长、发育、衰老、死亡的各个阶段,而自噬异常则常常与人类神经退行性疾病、糖尿病、肿瘤等疾病的发生发展密切相关,自噬通路是很多疾病潜在的靶向通路。
现在我们总结一下:
1、自噬,就是细胞自己吃掉自己,废物再利用的代谢过程;
2、在正常情况下,自噬维持细胞内稳态;
3、在外界压力、饥饿、缺氧和内质网应激等特殊情况下,细胞可以通过降解自身非必要成分来提供营养和能量,自噬是一种自我生存机制;
4、自噬机制受损与肿瘤、神经退行性疾病、代谢相关疾病等发病过程密切相关。
自噬的发现
上世纪50年代,比利时科学家Christian de Duve在通过电镜观察到自噬体(autophagosome)结构,并且在 1963 年溶酶体国际会议(CIBA Foundation Symposium on Lysosomes)上首先提出了“自噬”这种说法。因此Christian de Duve被公认为自噬研究的鼻祖。Christian de Duve 也因发现溶酶体,并于1974年获得诺贝尔奖。
自噬的分类和步骤
根据胞内底物运送到溶酶体的方式不同,哺乳动物细胞自噬可分为三种主要方式:
巨自噬(Macroautophagy)
微自噬(Microautophagy)
分子伴侣介导的自噬(Chaperone-mediatedautophagy)。
通常我们所研究的是巨自噬,又称之为大自噬,它是指细胞在受到外界刺激信号的情况下,在细胞内形成双层膜结构,这些膜包被细胞质和部分待降解的细胞器和蛋白质,该过程包含四大步骤:自噬泡(phagophore)的发生、自噬体(autophagosome)的形成、自噬的运输融合(fusion)、自噬的降解(degradation)。
步骤1:
细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似“脂质体”样的膜结构,然后不断扩张,但它并不呈球形,而是扁平的,就像一个由2层脂双层组成的碗,可在电镜下观察到,被称为Phagophore。
步骤2:
Phagophore不断延伸,将胞浆中的任何成分,包括细胞器,全部揽入“碗”中,然后“收口”,成为密闭的球状的autophagosome,即“自噬体”。电镜下观察到自噬体是自噬发生的铁证之二。有2个特征:一是双层膜,二是内含胞浆成分,如线粒体、内质网碎片等。
步骤3:
自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合。
步骤4:
自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,2者的内容物合为一体,自噬体中的“货物”也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
自噬信号通路解析
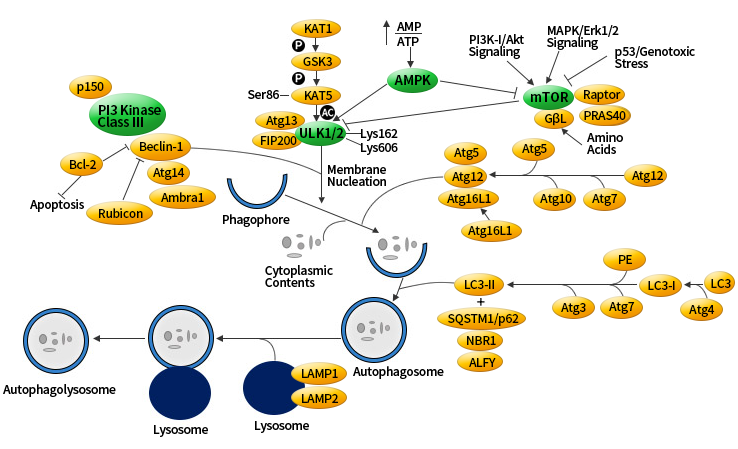
看到这个通路图的时候,是不是头都是大的?没关系,跟着小编,一步一步来。
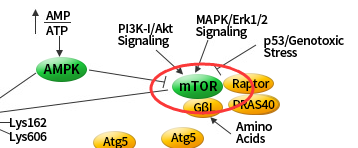
mTOR 激酶是自体吞噬诱导过程中关键的分子, PI3K-I/Akt 和 MAPK 信号通路可以激活mTOR,抑制自体吞噬;AMPK 和 p53 信号通路负调控 mTOR ,促进自体吞噬。
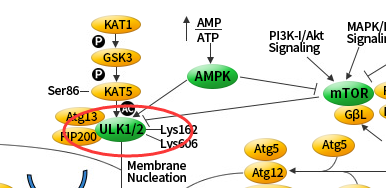
ULK 是自噬信号通路唯一一个具有丝氨酸/苏氨酸激酶活性的核心蛋白。在自噬溶酶体组装前自噬信号是通过由 ULK1/2、FIP200 和 Atg13 组成的 ULK 复合物的活化介导的。
ULK1 复合物在体内是连接上游营养或能量感受器 mTOR 和 AMPK 与下游自噬体形成的桥梁。磷酸化的 ULK1 一直以来都被认为是自噬的一个关键调控因子,目前发现 AMPK 和 mTOR 这两个激酶可催化 ULK1 的磷酸化,这在自噬中起着十分重要的作用。
在饥饿条件下 AMPK 活化,mTOR 失活,活化的 AMPK 催化 ULK1 第 317、467、555、574、637 和 777 位丝氨酸发生磷酸化从而促进自噬。
在营养充足的情况下 AMPK 失活,mTOR 可与 ULK1 第 757 位丝氨酸结合抑制 ULK1-AMPK 的相互作用,导致 ULK1 的失活,最终关闭自噬信号。
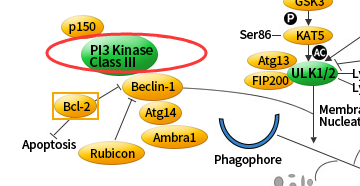
III 级 PI3K 复合体,包括了 Beclin-1、p150和 Atg14,都是自体吞噬诱导所需要的。
Bcl-2 能抑制 Beclin-1 依赖的自噬,所以它既具有促生存的功能又具有抑制自噬的功能。
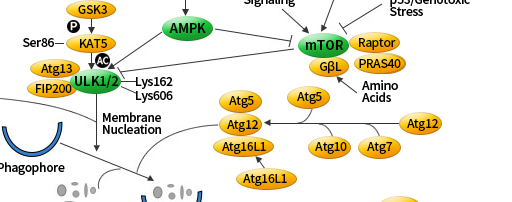
Atg 基因通过 Atg12-Atg5 和 LC3-II (Atg8-II) 复合物控制自噬体的形成。
Atg12 以需要 Atg7 和 Atg10(分别为 E1 和 E2 样酶) 的泛素样反应与 Atg5 偶联。然后,Atg12–Atg5 连接物与 Atg16 非共价反应形成更大的复合物。
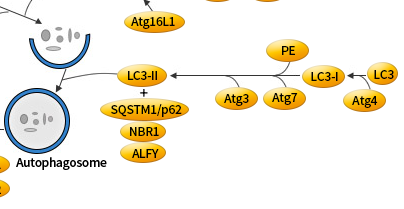
LC3/Atg8 的 C 端被 Atg4 蛋白酶酶切后生成细胞质 LC3-I。LC3-I 与磷脂酰乙醇胺 (PE) 也以泛素样反应的方式连接,这个反应需要 Atg7 和 Atg3 (分别为 E1 和 E2 样酶)。 LC3 的脂质形式,即 LC3-II,吸附在自噬体膜上。从而将 LC3 与自噬小泡联系起来。自噬体中 LC3 的存在,及其向低迁移形式的 LC3-II 的转化被作为自噬发生的「指示器」。
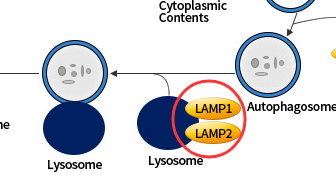
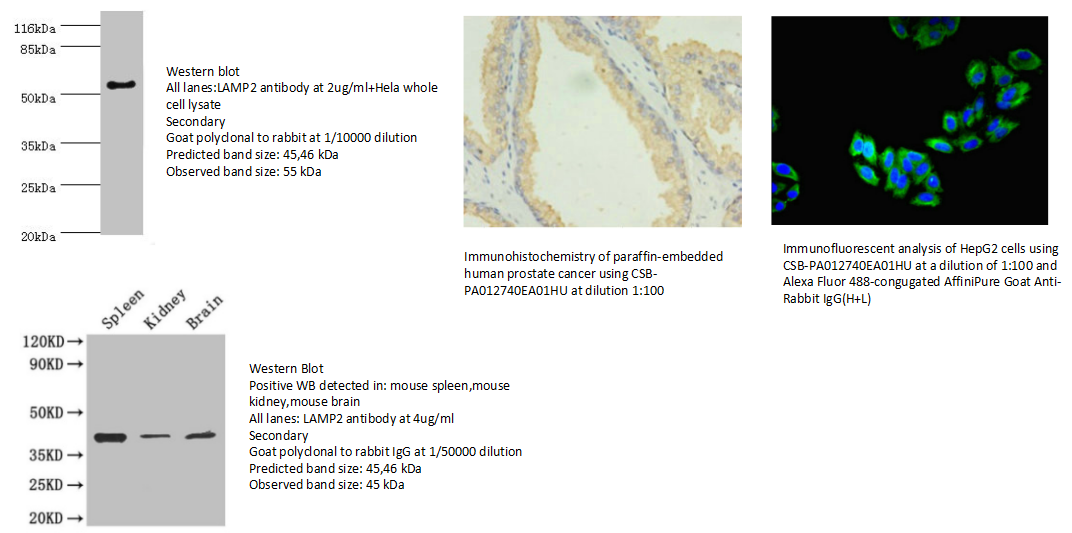
LAMP1/2是溶酶体相关膜蛋白,相关抗体可用于标记溶酶体。
自噬信号通路的研究
自噬在细胞存活与死亡中是把双刃剑,既能促进细胞存活也会导致细胞凋亡,但其具体机制还有待研究,阐明自噬在细胞存活和死亡方面的作用机制,深入了解自噬信号通路有助于我们更好的理解自噬在维持细胞内稳态的作用,并了解其在肿瘤、糖尿病和神经退行性疾病中是如何错误调控的。
为配合科学家们的研究,武汉j9九游会登录入口首页也在积极努力,不断开发和提供优质自噬抗体,目前已拥有500多种修饰型和非修饰型的自噬抗体,助力您的自噬通路研究,点击查看原文,可查看所有自噬抗体。
有图有真相~~~
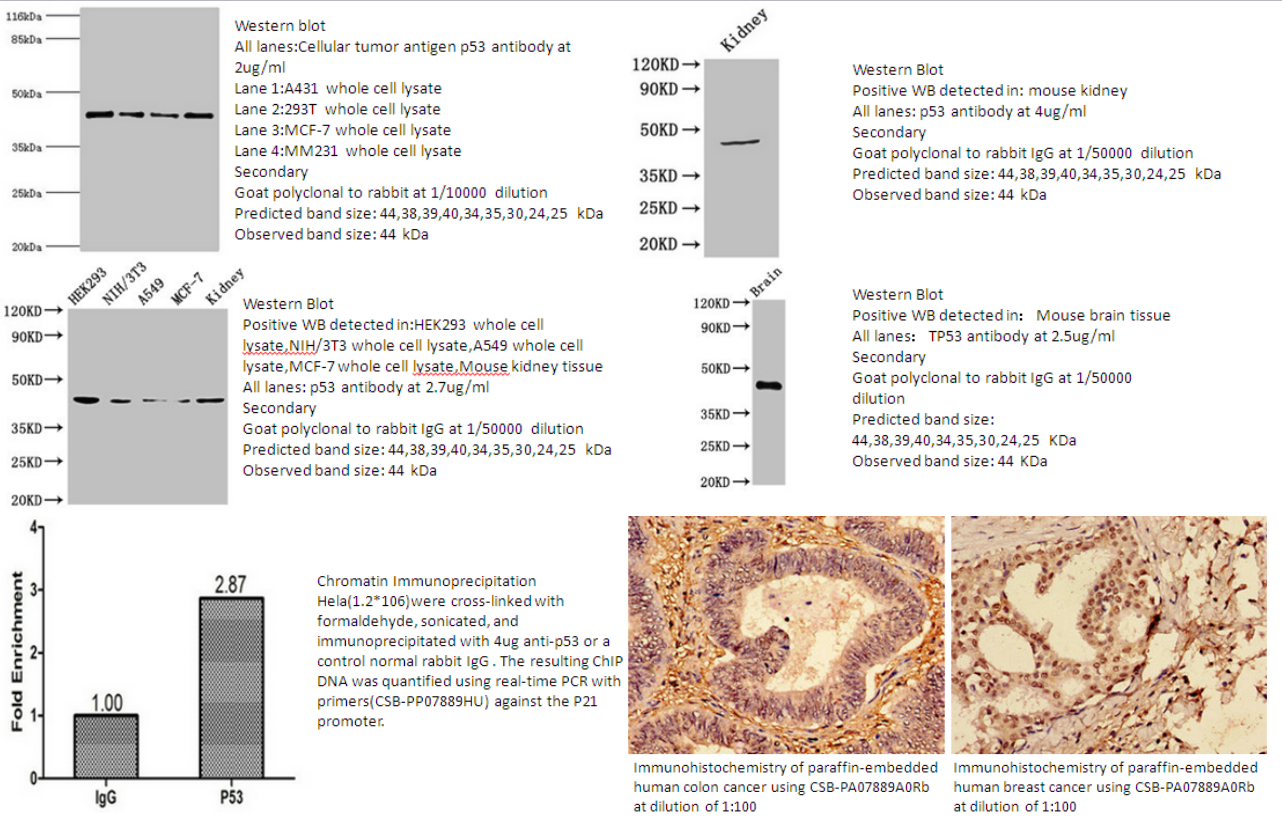
1.TP53 Antibody (CSB-PA07889A0Rb)
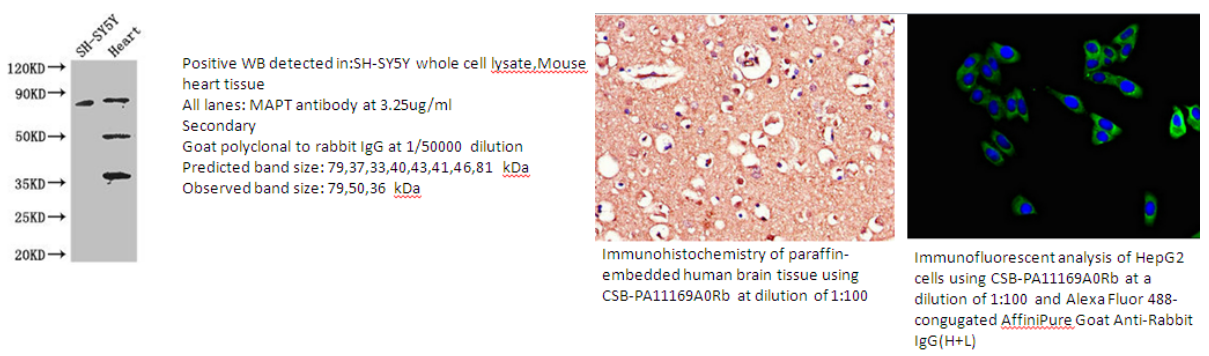
2.MAPT Antibody(CSB-PA11169A0Rb)
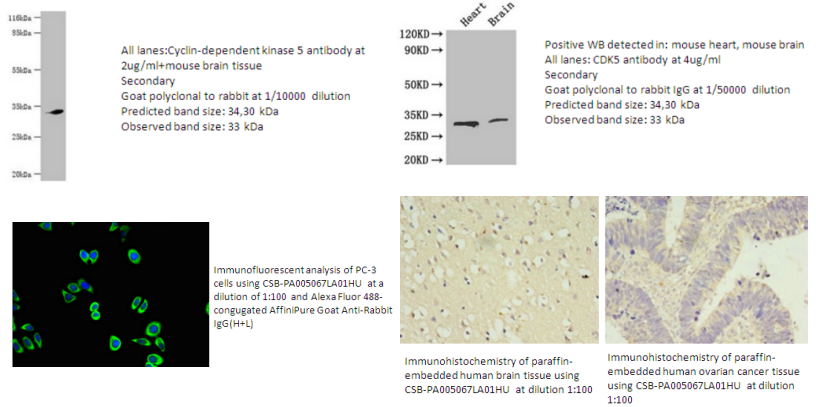
3.CDK5 Antibody(CSB-PA005067LA01HU)
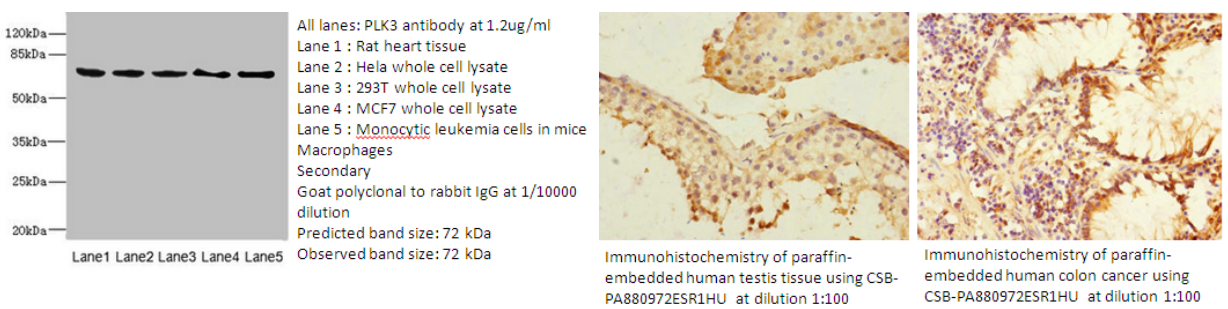
4.PLK3 Antibody (CSB-PA880972ESR1HU)
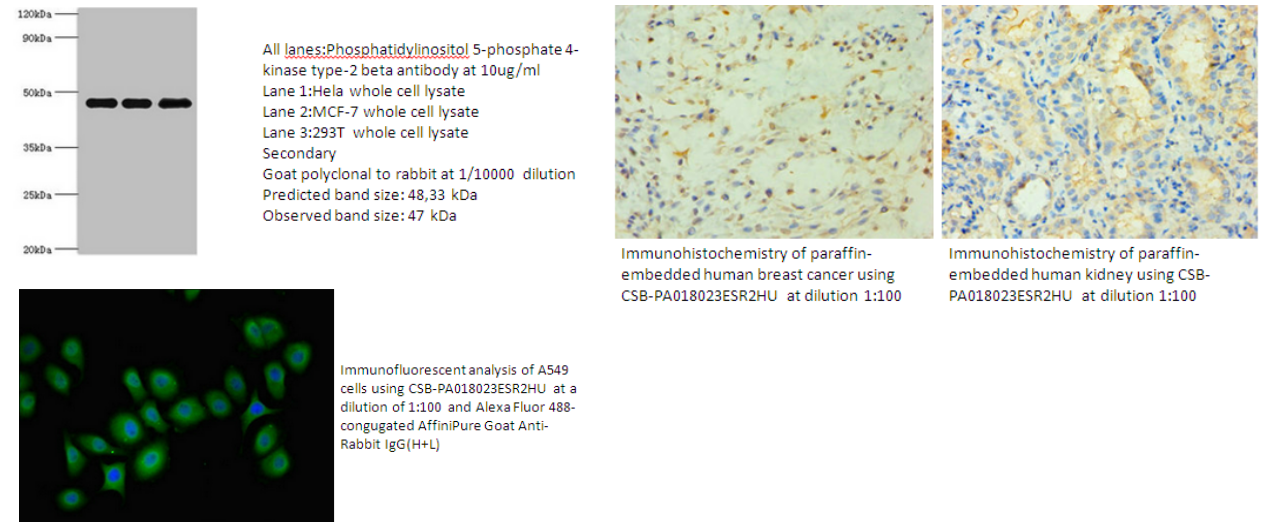
5.PIP4K2B Antibody(CSB-PA018023ESR2HU)
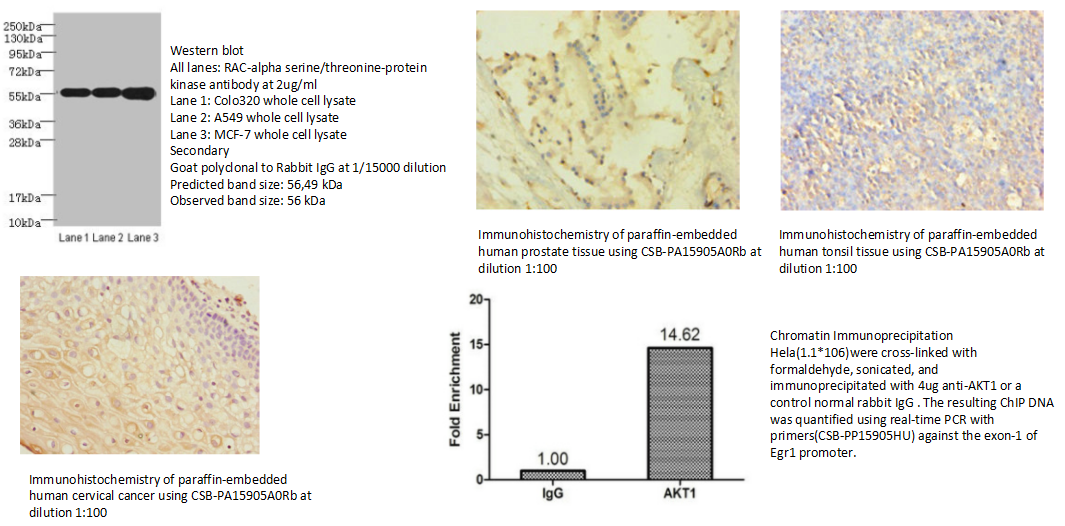
6.AKT1 Antibody (CSB-PA15905A0RB)
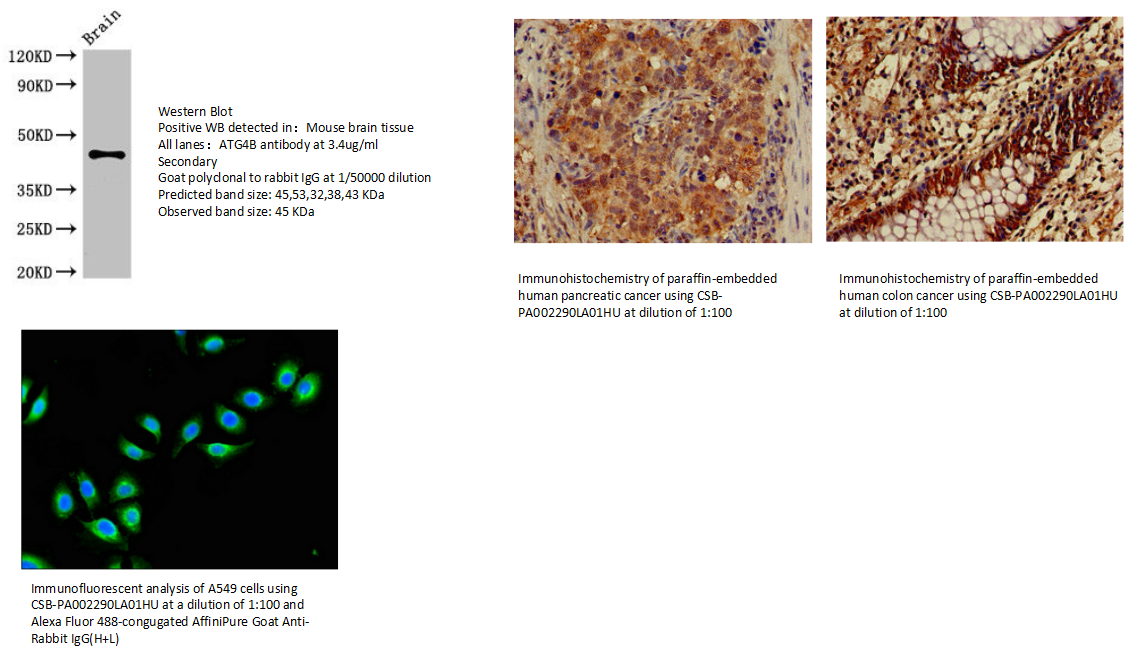
7.ATG4B Antibody (CSB-PA002290LA01HU)
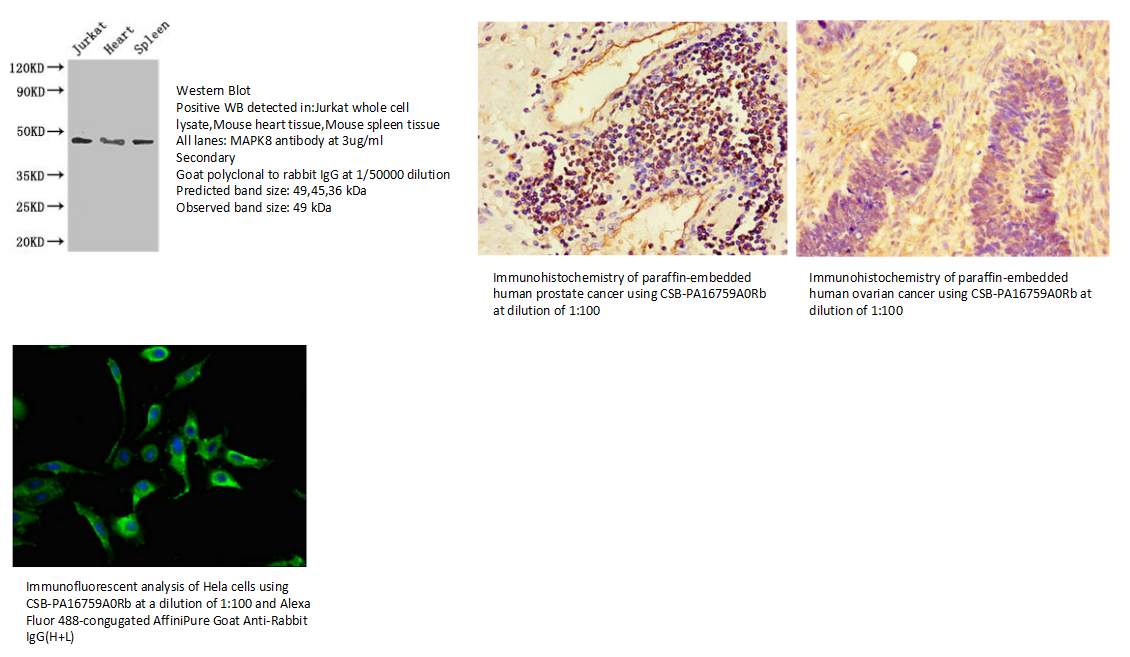
8.MAPK8 Antibody (CSB-PA16759A0Rb)
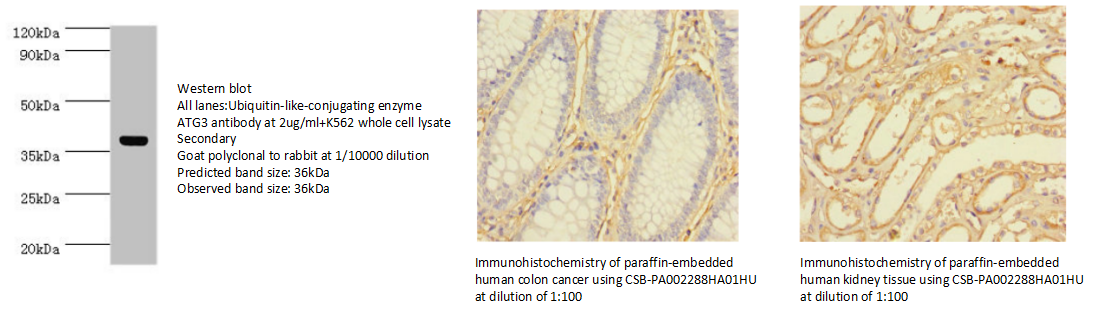
9.ATG3 Antibody (CSB-PA002288HA01HU)
10.LAMP2 Antibody (CSB-PA012740EA01HU)