Th1和Th2细胞如何分化?
日期:2023-11-17 09:01:06
根据它们合成和分泌的细胞因子,CD4+辅助T细胞(Th细胞)可以分为两个亚群,即第一型辅助T淋巴细胞(Th1)和第二型辅助T细胞(Th2)[1]。这两种类型的细胞均来源于共同的T细胞辅助前体细胞(Thp)。尽管T细胞的分化受到抗原浓度或共刺激分子的影响,但细胞因子是Th细胞分化的最有效调节因子。此外,细胞外微环境和转录因子的影响也发挥了重要作用。
1. Th1和Th2细胞
尽管Th1和Th2细胞来源于共同的前体细胞,但它们之间存在一定的差异:
在这里,我们在表格1中列出了一部分CUSABIO甲基化组蛋白抗体。
表1 .Th1和Th2细胞的差异
| 差异 | Th1 | Th2 |
|---|---|---|
| 分泌细胞因子 | IFN-γ,IL-2, IL-3, TNF-α, TNF-β | IL-4, IL-10, IL-5, IL-9, IL-13 |
| 特定的细胞因子 | IFN-γ | IL-4 |
| 调整因子 | IFN-γ, IL-12 | IL-4, IL-13, IL-5 |
Th1和Th2细胞的常见分泌细胞因子:GM-CSF,IL-3,TNF
2. Th1/Th2细胞的作用
Th1和Th2细胞在免疫中起着重要作用。Th1细胞刺激细胞免疫反应,参与抑制巨噬细胞活化并刺激B细胞产生IgM、IgG1。
Th2细胞刺激体液免疫反应,促进B细胞增殖并诱导抗体产生(IL-4)。它还可以诱导肥大细胞的分化和增殖(IL-3、IL-4),以及嗜酸性粒细胞的分化和增殖(IL-5)。
在正常情况下,Th1/Th2细胞的分化处于平衡状态,一旦Th1/Th2细胞的平衡失调,将导致疾病的发生 [2]。过度表达Th2可能导致不适当的免疫反应,引发过敏和哮喘等疾病。过度表达Th1或Th17可能导致类似风湿性关节炎和多发性硬化症的自身免疫性疾病 [3] [4]。
3. Th1/Th2细胞分化的细胞因子和转录因子
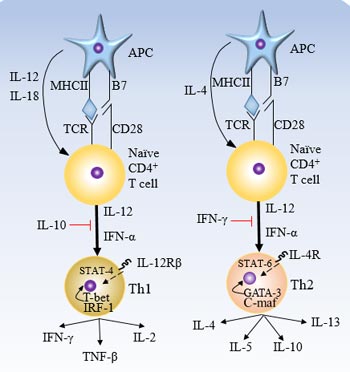
图1. 参与Th1和Th2分化的细胞因子和转录因子
分化Th1和Th2细胞受多种因素调控,而细胞因子起着最重要的作用。调控Th2细胞分化的细胞因子主要是IL-4和IL-13,而IFN-α、IL-12和IFN-γ则调节Th1细胞分化。此外,最近发现IL-18和T1/ST2产物也参与了Th1/Th2细胞分化调控 [5]。
3.1 Th1细胞分化中的细胞因子
● IFN-γ
IFN-γ促进Th1细胞分化并抑制Th2细胞分化。研究发现,IFN-γ信号通过阻止STAT6与IL-4R受体结合来抑制STAT6信号传导,这可能是IFN-γ介导Th1细胞分化的可能机制之一 [6]。
内源性IFN-γ产生受以下转录因子调控:活化T细胞核因子(NFAT)、NF-κB、IRF-1家族、ERM、YY1和Hlx。
MAPK通路也参与IFN-γ的产生。
● IL-12
通常情况下,IL-12是启动Th1细胞分化的最重要的细胞因子。IL-12通过激活STAT4并随后上调IFN-γ的表达来促进Th1分化 [7]。IL-12Rβ2仅在Th1细胞中表达,但IL-4可以抑制IL-12Rβ2的表达,导致T细胞不对IL-12产生反应,促使T细胞分化为Th2 [8]。因此,未能沉默IL-4产生潜力的产生IFN-γ的细胞将破坏Th1免疫 [9]。
● IL-18
IL-18是一种新发现的细胞因子。IL-18和IL-12在IFN-γ的产生上有很强的协同作用,虽然IL-18不诱导Th细胞分化,但它对IL-12诱导的Th1细胞分化有影响 [10]。
● STAT4
STAT4通过调节IL-12信号参与Th1细胞分化。它是Jak/STAT信号通路的重要调节因子。其活性受IL-12受体信号的影响。
3.2 Th2细胞分化中的细胞因子
● IL-4
IL-4通过STAT6诱导Th2分化。其活性的调节受以下因素影响:NFAT1、C-maf、Bcl-6、GATA-3(NF-κB在发育中的Th2细胞中抑制GATA-3的表达 [11])、IL-13、IL-6。Th1细胞上的MHCII类转化激活因子抑制IL-4。
● IL-13
IL-13和IL-4共享IL-4R亚单位,诱导相同的基因表达和炎症反应。
● T1 / ST2
最初在Th2细胞上选择和表达的T1是一种血清和肿瘤蛋白诱导基因,属于IL-1R家族。T1/ST2基因仅选择在Th2细胞上表达,并与IL-4的产生密切相关。
● SOCS
SOCS蛋白在某些信号通路中抑制信号传导。SOCS-1和SOCS-3抑制IFN-γ诱导的抗增殖和抗病毒反应,SOCS-1还抑制B细胞和成纤维细胞中的IL-4信号。同时,SOCS-1可能通过抑制JAK1和STAT6的活化来抑制IL-4的活性,但在Th1细胞和Th2细胞之间不同信号中的作用尚未确认 [12]。
4. 转录因子
除了细胞因子外,许多转录因子也参与Th1细胞和Th2细胞的分化。
4.1 NFAT
NFAT家族成员(NFAT1、NFAT2、NFAT3、NFAT4、NFAT5)具有高度保守的DNA和钙调素结合位点。NFAT经由钙调素磷酸化并进入细胞核。然后,在Ras/Raf-MEK-ERK等蛋白激酶的作用下,它与AP-1结合,形成NFAT-AP1复合物结合到DNA并介导基因转录。
4.2 C-maf
C-maf是特异性表达于Th2细胞的转录因子。C-maf的激活诱导IL-4的表达并促进Th2分化。研究人员发现,C-maf还通过独立于IL-4的途径促进Th2分化。此外,C-maf与IL-4R和IL-5R的表达显著相关,这也可能是C-maf调控IL-4基因表达的重要因素。
4.3 T-bet
T-bet(也称为T-box 21)是新发现的特异性于Th1的转录因子 [13]。在初级CD4+ T细胞中,T-bet主要通过以下方式促进Th1细胞分化:
T-bet刺激IFN-γ的产生并促进Th1细胞分化 [14];
T-bet还上调IL-12β2链以促进IL-12的响应 [15]。
T-bet可以通过IFN-γ-STAT1通路被激活,这在稳定Th1细胞表型方面起关键作用。
在Th2细胞中,T-bet可以与Runx3协同激活IFN-γ。T-bet还结合到IL-4的沉默区域并抑制IL-4的表达 [16]。
4.4 GATA-3
GATA-3是GATA家族转录因子,在Th2中选择性地表达,并在Th2分化过程中上调 [17]。它调节IL-4、IL-13和IL-5的表达。
GATA-3表达的调节:除IL-4R/STAT6信号传导外,GATA-3的表达也可以由其他GATA家族成员(如GATA-1、GATA-3、GATA-4)表达。TCR信号传导系统对GATA-3的表达也很重要。调节GATA-3功能的其他因素包括:NF-κB、FOG-1。
5. 细胞分化的信号通路
许多信号通路参与了T细胞分化,主要有以下几个:
5.1 T细胞受体信号通路
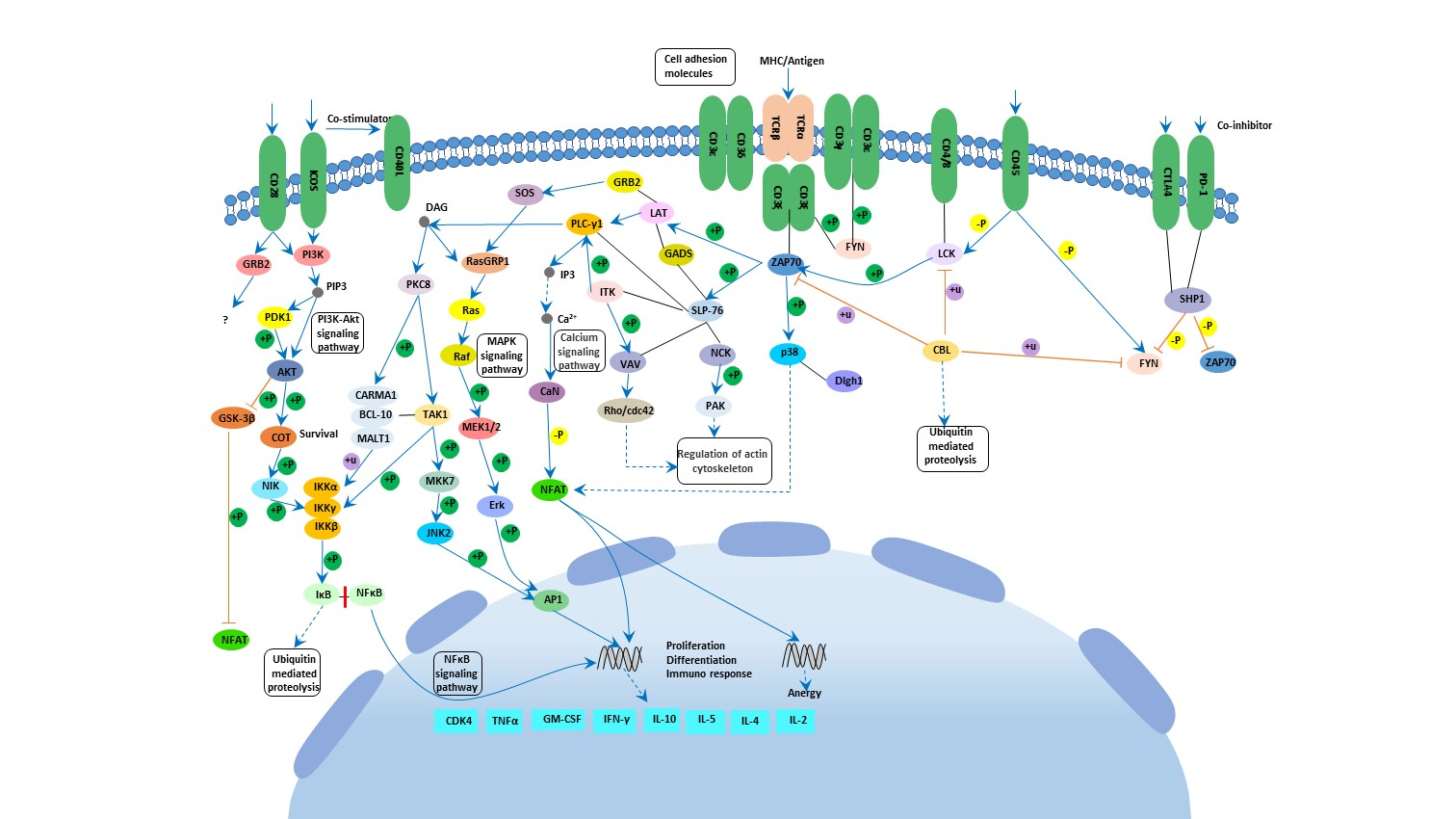
图2. T细胞受体信号通路
T细胞受体(TCR)信号传导和细胞因子信号传导对于辅助T细胞分化都是必不可少的。特定的TCR转录因子,如激活的T细胞核因子(NFATs)、核转录因子κB(NF-κB)在T细胞分化中发挥关键作用。
TCR的激活可以启动多个细胞内信号传导通路,如丝裂原活化蛋白激酶(MAPK)、核因子κB(核κB,NF-κB)、AP-1(Fos-Jun)和CaN-NFAT。
T细胞受体(TCR)与抗原递呈细胞(APC)表面的抗原/组织相容性复合物(MHCⅡ)结合是T细胞激活所需的第一个信号。在这个阶段,影响T细胞分化的因素主要是T细胞获取信号的强度:弱的TCR激活信号可以激活Ca2+流信号,诱导IL-4的合成并促进T细胞分化为Th2;强的TCR激活信号可以激活MAPK通路,诱导IFN-γ的合成,促使T细胞分化为Th1。
此外,TCR触发的时间长度也影响Th细胞的分化:在存在IL-12的情况下,短暂的TCR触发启动Th1分化,而长时间的TCR触发启动Th2分化。
5.2 Notch信号通路
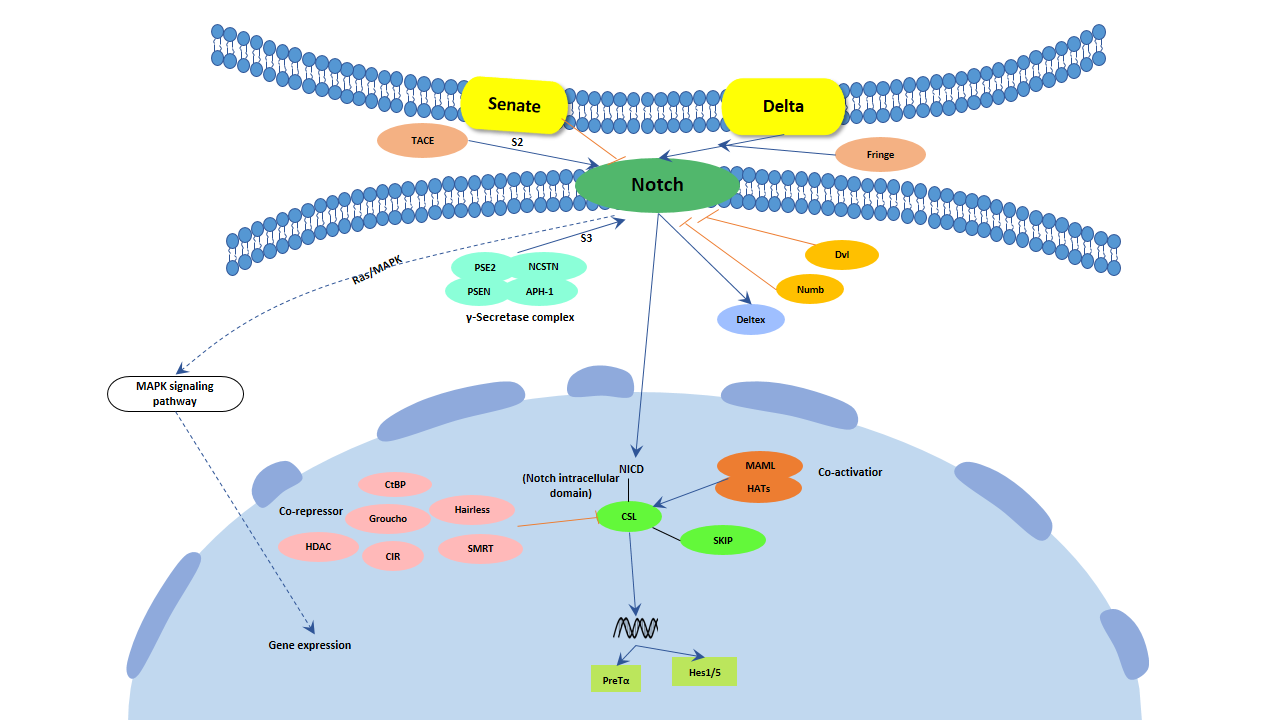
图3. Notch信号通路
目前在哺乳动物中已经发现了四种Notch受体,分别是Notch-1、Notch-2、Notch-3和Notch-4。Notch配体包括Jagged家族和Delta-like家族。Jagged家族包括Jagged-l和Jagged-2,Delta-like家族包括DLL-1、DLL-3和DLL-4 [18] [19]。
Delta-like和Jagged配体分别诱导T细胞极化为Th1和Th2,这与IL-4 / STAT6无关。
5.3 JAK/STAT信号通路
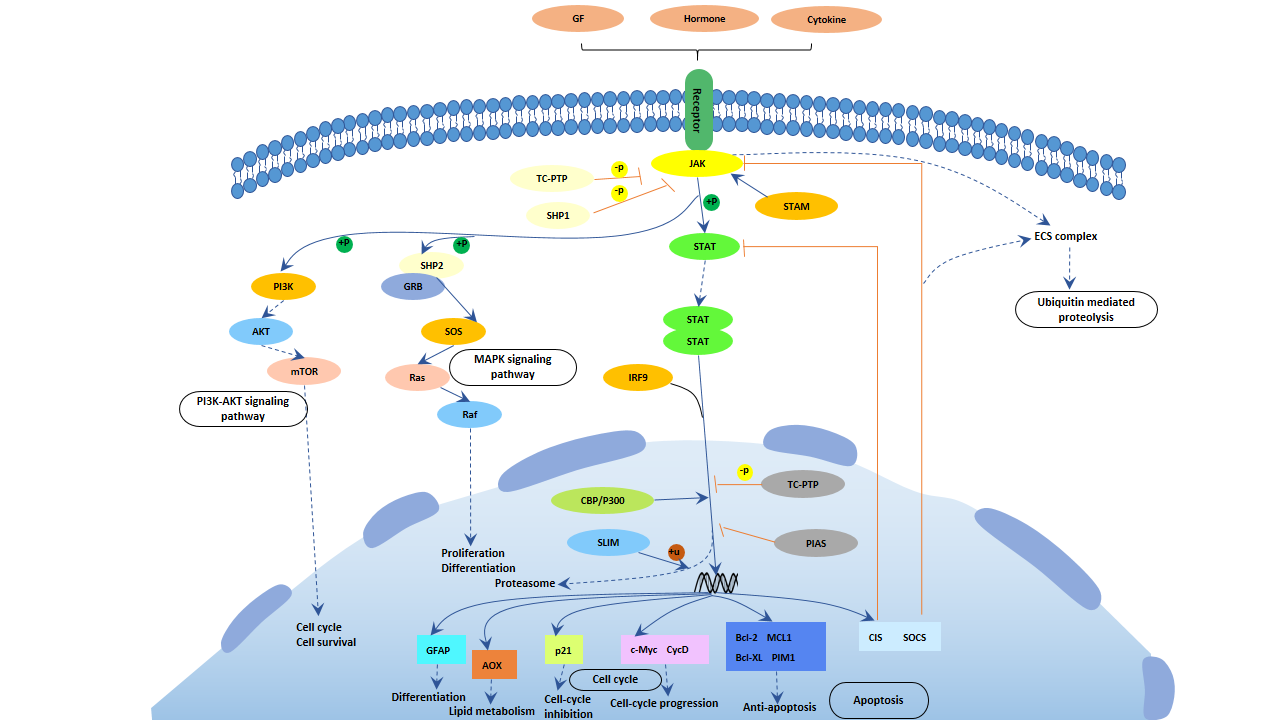
图4. JAK/STAT信号通路
JAK家族蛋白激酶属于酪氨酸蛋白激酶,包括JAK1、JAK2、JAK3和TyK2这四个成员。STAT家族包括STAT1、2、3、4、5A、5B和6这七个成员。
JAK-STAT是由细胞因子受体介导的重要信号转导通路。IFN-γ激活JAK1、JAK2和STAT1,IL-12激活JAK2、TYK2和STAT4,IL-4激活JAK1、JAK3和STAT6。阻断上述任何步骤都会导致相应的Th细胞分化受到抑制。
5.3.1 Th1分化的信号转导
IFN-γR和IL-12R介导的信号转导在Th1分化中起重要作用。
● IFN-γR/STAT1途径
IFN-γR1和IFN-γR2分别与IFN-γ结合并四聚化。然后,IFN-γR1和IFN-γR2分别被JAK1和JAK2磷酸化,STAT1被招募。被招募的STAT1被磷酸化和激活,从IFN-γR分离出来,二聚化并进入细胞核,结合IFN-γ基因的GAS顺式作用元件,从而促进IFN-γ基因的转录和表达。
● IL-12R/STAT4途径
IL-12R是由β1和β2亚单位组成的异二聚体。IL-12Rβ2专门在Th1细胞中表达。当IL-12R与IL-12结合时,JAK2和TyK2被激活,然后磷酸化β1和β2亚单位的细胞质酪氨酸残基。磷酸化的β1和β2亚单位结合并磷酸化STAT4。然后,STAT4形成同源二聚体或与STAT3形成异源二聚体,并进入细胞核,介导其下游基因的功能。
5.3.2 Th2分化的信号转导
在Th2分化过程中,JAK1/3/STAT6信号转导通路主要由IL-4R和IL-13R介导。
● JAK1/3/STAT6途径
IL-4是促进Th2细胞发展的关键细胞因子。IL-4的结合激活IL-4R,与之结合的JAK1/3也被磷酸化和激活。磷酸化的JAK1/3反过来磷酸化IL-4R上的酪氨酸残基,磷酸化的IL-4R招募并结合STAT6单体。STAT6单体在JAK1/3作用下经历酪氨酸磷酸化,从IL-4R分离出来形成活性的STAT6二聚体。STAT6二聚体核转位,进一步启动IL-4和其他基因的转录和表达[20]。类似地,IL-13结合II型IL-4R,通过JAK1/3/STAT6途径促进许多炎症基因的转录和表达。
5.4 MAPK信号通路
MAPK信号转导通路包括四个途径:细胞外信号调节激酶(ERK)、c-Jun N末端激酶(JNK)/应激激活蛋白激酶(SAPK)、P38MAPK和ERK5/BMK1。
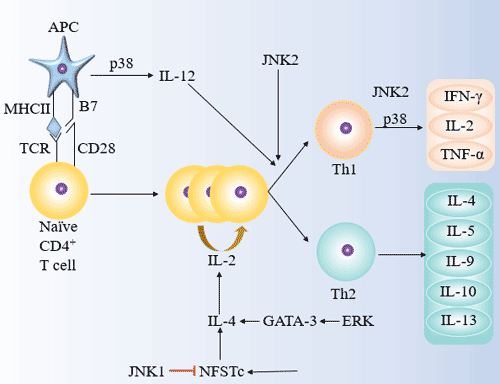
图5. JNK、p38和ERK在Th1/Th2分化中的作用
5.4.1 JNK在诱导Th1/Th2分化中的作用
JNK是应激激活的蛋白激酶(SAPK),包括JNK1/2/3。JNK/SAPK能够磷酸化c-Jun、ATF-2,并增加其转录活性,促进c-Fos、c-Jun和ATF-2调控基因的表达。
JNK1可以抑制原代CD4+ T细胞分化为Th2,但不影响其分化为Th1;JNK2诱导CD4+ T细胞分化为Th1,促进Th1效应细胞中IFN-γ的分泌,但不影响Th2分化。
5.4.2 P38
P38在诱导Th1/Th2分化中的作用是双向的。P38MAPK途径可能通过激活IFN-γ转录诱导Th1细胞分化。P38还可以通过促进DC中IL-12的分泌来改变DC的免疫调节功能,诱导CD4+ T细胞分化为Th1,介导Th1类型的免疫应答。
5.4.3 ERK
TCR诱导的Ras-ERK/MAPK途径能够诱导Th2分化,并介导Th2类型的免疫应答。
5.5 钙信号通路
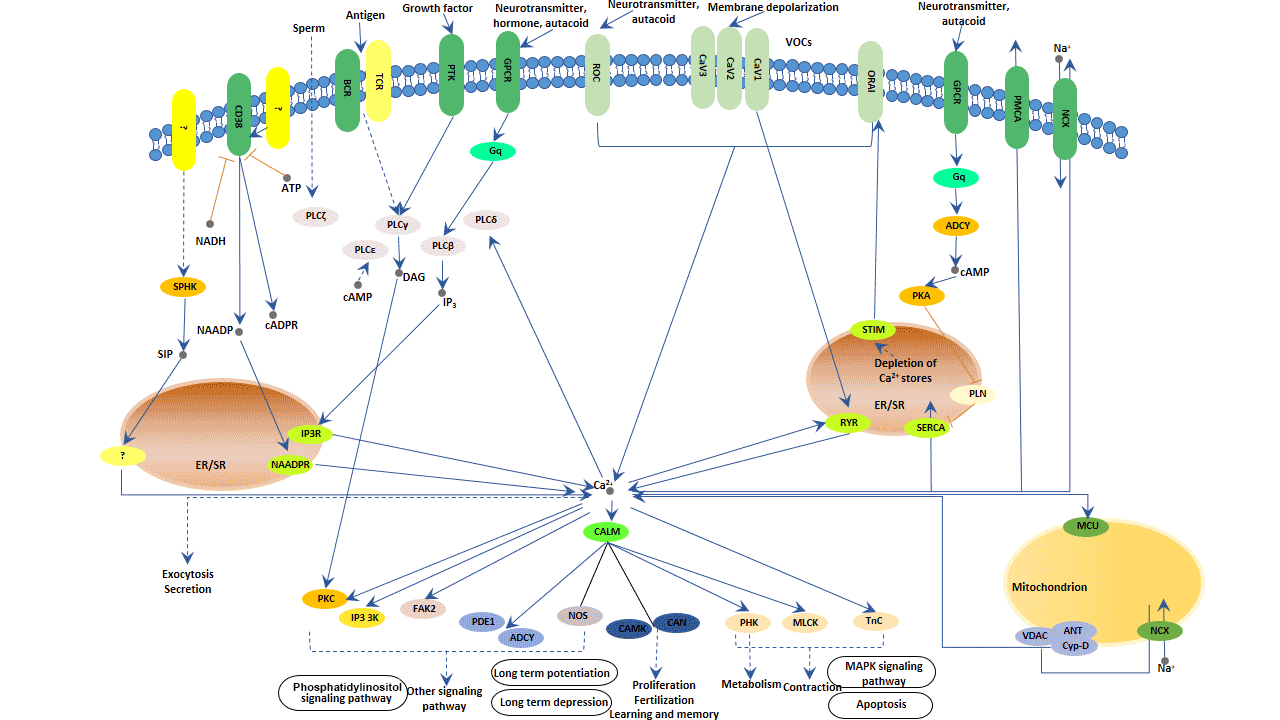
图6. 钙信号通路
Calcineurin (CaN) 是一种钙/钙调蛋白(CaM)依赖性的丝氨酸/苏氨酸磷酸蛋白磷酸酶,它催化多种已磷酸化蛋白的去磷酸化过程。通过激活核转录因子活化的T细胞(NFAT),CaN在T细胞激活、分化和增殖中发挥作用。
在T细胞中,Ca2+水平调节CaN的活性,从而在NFAT的激活中发挥重要作用。
Ca2+-CaN-NFAT的调控过程主要有两个信号途径:IP3-Ca2+和DAC-PKC。
5.5.1 IP3 Ca2+信号
IP3结合到内质网中的IP3钙通道,促使细胞质Ca2+浓度增加,然后激活细胞质CaN,CaN与NFAT结合,导致其去磷酸化和激活。激活的NFAT核转位后,与AP-1家族蛋白等转录因子以及其他激活因子结合,形成复合体,共同调控细胞因子的表达。
5.5.2 DAC-PKC信号
DAG激活PKC,抑制PIP2水解,激活IP3水解,使细胞内游离Ca2+不增加。同时,PKC还激活Ca泵,降低细胞内游离Ca2+。PKC还可以激活NFAT、NF-κB、AP-1等核因子,在淋巴细胞的激活和增殖、细胞因子的产生中发挥协同作用。
5.6 NF-κB信号通路

图7. 信号通路
通常情况下,NF-κB及其抑制剂I-κB位于细胞质中。上游激酶的活化(如NF-κB诱导激酶或MEKK1)导致I-κB激酶的激活和I-κB蛋白的磷酸化,使磷酸化的I-κB蛋白与NF-κB分离并降解。游离的NF-κB进入细胞核,激活靶基因的转录。NF-κB在Th细胞分化中的作用正在起步阶段。已经发现抑制NF-κB活性会阻断GATA-3的表达。
Hedgehog信号通路也与T细胞分化有一定的关系。我们发现关键的Th2细胞因子IL-4是T细胞中Hh信号的一个新的转录靶点,为Hh在Th分化中的作用提供了机制 [22]。
6. CUSABIO特色蛋白
参考文献:
[1] Seder R A, Paul W E. Acquisition of lymphokine-producing phenotype by CD4+ T cells [J]. Journal of Allergy & Clinical Immunology, 1994, 94: 1195.
[2] Romagnani S. Lymphokine Production by Human T Cells in Disease States [J]. Annual Review of Immunology, 2003, 12(12): 227-257.
[3] Valérie Dardalhon, Korn T, Kuchroo V K, et al. Role of Th1 and Th17 cells in organ-specific autoimmunity [J]. Journal of Autoimmunity, 2008, 31(3): 0-256.
[4] Wan Y Y, Flavell R A. How Diverse-CD4 Effector T Cells and their Functions [J]. Journal of Molecular Cell Biology, 2009, 1(1): 20-36.
[5] Murphy K M, Ouyang W, Farrar J D, et al. Signaling and Transcription in T Helper Development [J]. Annual Review of Immunology, 2000, 18(1): 451-494.
[6] Huang Z, Xin J, Coleman J, et al. IFN-γ Suppresses STAT6 Phosphorylation by Inhibiting Its Recruitment to the IL-4 Receptor [J]. The Journal of Immunology, 2005, 174(3): 1332-1337.
[7] Gately M K, Renzetti L M, Magram J, et al. THE INTERLEUKIN-12/INTERLEUKIN-12-RECEPTOR SYSTEM: Role in Normal and Pathologic Immune Responses [J]. Annual Review of Immunology, 1998, 16(1): 495-521.
[8] Glimcher L H, Murphy K M D A J. Lineage commitment in the immune system: the T helper lymphocyte grows up [J]. Genes Dev, 2000, 14(14): 1693-1711.
[9] Ansel K M, Greenwald R J, Agarwal S, et al. Deletion of a conserved IL-4 silencer impairs T helper type 1-mediated immunity [J]. Nature Immunology, 2004, 5(12): 1251-1259.
[10] O'Garra A. Cytokines induce the development of functionally heterogeneous T helper cell subsets [J]. Immunity, 1998, 8(3): 275.
[11] Das J, Chen C H, Yang L, et al. A critical role for NF-kappa B in GATA3 expression and TH2 differentiation in allergic airway inflammation [J]. Nature Immunology, 2001, 2(1): 45-50.
[12] Losman J A. SOCS-1 is a potent inhibitor of IL-4 signal transduction [J]. J. Immunol. 1999, 162(7): 3770-3774.
[13] Farrar J D, Asnagli H, Murphy K M. T helper subset development: roles of instruction, selection, and transcription [J]. Journal of Clinical Investigation, 2002, 109(4): 31-5.
[14] Szabo S J, Kim S T, Costa G L, et al. A Novel Transcription Factor, T-bet, Directs Th1 Lineage Commitment [J]. CELL, 2000, 100(6): 0-669.
[15] Mullen A C, High F A, Hutchins A S, et al. Role of T-bet in commitment of TH1 cells before IL-12-dependent selection [J]. Science, 2001, 292(5523): 1907-1910.
[16] Djuretic I M, Levanon D, Negreanu V, et al. Erratum: Transcription factors T-bet and Runx3 cooperate to activate IFN-γ and silence IL-4 in T helper type 1 cells (Nature Immunology) [J]. Nature Immunology, 2007, 8(2): 145-153.
[17] Zhang D H, Cohn L, Ray P, et al. Transcription Factor GATA-3 Is Differentially Expressed in Murine Th1 and Th2 Cells and Controls Th2-specific Expression of the Interleukin-5 Gene [J]. Journal of Biological Chemistry, 1997, 272(34): 21597-21603.
[18] Sara González-García, Marina García-Peydró, Alcain J, et al. Notch1 and IL-7 Receptor Signalling in Early T-cell Development and Leukaemia [J]. Current Topics in Microbiology & Immunology, 2012, 360: 47.
[19] Greenwald I, Kovall R. Notch signaling: genetics and structure [J]. Wormbook the Online Review of C Elegans Biology, 2013: 1.
[20] Rosenwasser L J, Zimmermann N, Hershey G K, et al. Chemokines in asthma: Cooperative interaction between chemokines and IL-13 [J]. Journal of Allergy & Clinical Immunology, 2003, 111(2): 227-242.
[21] Gwack Y, Feske S, Srikanth S, et al. Signalling to transcription: Store-operated Ca2+ entry and NFAT activation in lymphocytes [J]. Cell Calcium, 2007, 42(2): 145-156.
[22] Furmanski A L, Saldana J I, Ono M, et al. Tissue-Derived Hedgehog Proteins Modulate Th Differentiation and Disease [J]. The Journal of Immunology, 2013, 190(6): 2641-2649.
上一篇: 新一代ADC药代(PK)分析助力产品-抗DXD抗体火热上市!
下一篇: Th17细胞的分化











