Th17细胞的分化
日期:2023-11-17 12:02:00
根据细胞分化和功能特性,CD4+细胞被分为Th1、Th2和调节性T细胞(Treg)等亚群。近期的研究发现了一种新的CD4+ T效应T辅助细胞——Th17细胞,它与Th1型和Th2型不同,在IL-6和IL-23的刺激下由TH0细胞分化而来,主要分泌IL-17、IL-22等促炎因子。与Th1、Th2和Treg细胞一起,它们构成了CD4+细胞的四个亚群。在自身免疫性疾病、传染病和移植排斥中起着重要的调节作用 [1]。
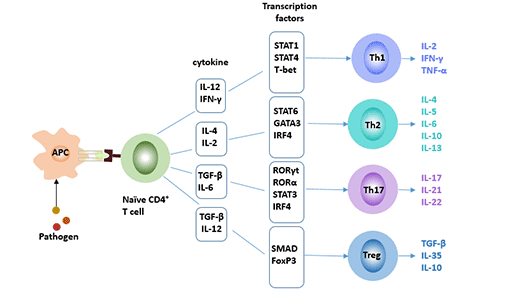
图1. CD4+ T细胞的四个亚群
1. Th17细胞的发现
Th17细胞是由Harrington等人于2005年发现的 [2]。Th17细胞主要根据它们分泌的细胞因子命名。通过建立自身免疫性脑炎和胶原诱导性关节炎的小鼠模型,证实了这些细胞的存在。Th17细胞在自身免疫性疾病和免疫防御反应中具有重要意义 [3]。Th17细胞的发现为治疗自身免疫性疾病提供了新的靶点。
2. Th17细胞的细胞标记
在人体内,可以通过细胞表面标志物CD4、CD161和CCR6来识别Th17细胞。Th17细胞的细胞标志物可以分为两类:细胞内标志物和细胞外标志物。
细胞内标志物:IL-17A、IL-17F、IL-21、IL-22、RORα、RORγt、Stat-3。
细胞外标志物:CD3、CD4、CD38、CD161、CD194(CCR4)、CD196(CCR6)、IL-1R、TGF-β。
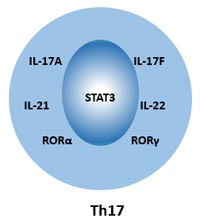
图2. Th17细胞的细胞标记
3. Th17细胞分化调节
Th17细胞的分化受多种细胞因子和信号分子的调控。CD4+ T细胞在TGF-β和IL-6的协同作用下分化为Th17细胞。
CD4+ T细胞的激活的第一步是T细胞受体(TCR)的参与。TCR信号的强度决定了Th1/Th2分化的方向。然而,TCR信号对Th17细胞分化的影响尚不清楚。
不同因子对Th17细胞分化的调控效果各异。
转化生长因子β(TGF-β)、IL-6、IL-23 [4]、IL-21和RORγt在Th17细胞分化和形成中发挥积极作用,而干扰素γ(IFN-γ)、IL-4和细胞因子信号3(Socs3)、Ets-1和IL-2则抑制其分化。
3.1 正向调节
Th17细胞的分化主要包括三个阶段:诱导、扩增和稳定。
在初始分化阶段,体内的初级CD4+ T细胞在TGF-β和IL-6的协同作用下分化为Th17细胞。IL-6 + TGF-β是其分化为Th17细胞的充分条件 [5]。
在这个阶段,调控因子主要包括以下几个:
● TGF-β
TGF-β在Treg细胞和Th17细胞分化中发挥重要作用。激活的初级CD4+ T细胞在仅TGF-β作用下分化为Foxp3+ Treg细胞;在TGF-β和IL-6的联合诱导下分化为Th17细胞。
β通过上调IL-23受体(IL-23R)的表达水平来促进Th17细胞分化。TGF-β还促进了Forkhead box P3(Foxp3)和RORγt的表达。Foxp3抑制RORγt的表达。因此,当TGF-β浓度过高时,会诱导高水平的Foxp3表达,以拮抗转录因子RORγt的分化促进作用,从而抑制Th17细胞的分化 [6]。Foxp3的作用受到IL-6和IL-21的抑制。TGF-β、IL-6和IL-21等细胞因子通过复杂的调控机制完成Th17细胞的分化。
● IL-6
IL-6是一种重要的免疫调节因子,在各种免疫应答的早期阶段发挥重要作用。IL-6可以直接作用于T细胞,通过gp130的酪氨酸残基的信号传导诱导STAT3激活。STAT3可以诱导Th17细胞特异性转录因子RORγt和RORα的表达,从而促进Th17细胞分化。
IL-6-gp130-STAT3通路是Th17细胞分化所必需的。阻断IL-6-gp130-STAT3可能是控制由Th17细胞引起的自身免疫性疾病的有效措施。
此外,IL-6通过内源性TGF-β诱导IL-23R的表达和Th17细胞分化。在缺乏IL-6时,IL-21可以替代IL-6和TGF-β来诱导Th17细胞的分化 [7]并释放IL-21。
● IL-9
IL-9是Th2产生的细胞因子。Th17细胞也表达IL-9。IL-9可以与TGF-β协同诱导Th17细胞分化,其诱导效率与TGF-β+IL-21诱导的Th17细胞分化类似。
● IL-1
IL-1在Th17细胞早期分化中发挥信号调控作用 [8]。在没有外源性TGF-β的情况下,IL-1与IL-6和IL-23协同促进Th17细胞分化。IL-1R1在Th17细胞分化过程中的表达上调。IL-1R1的表达主要受到IL-6的影响,IL-23和TGF-β对IL-1R1的表达影响较小。IL-1R1的表达也依赖于STAT3、RORα和RORγt。
● IL-21
扩增阶段主要由IL-21介导。细胞因子IL-21由Th17细胞自身分泌,可能通过自分泌来促进或维持Th17细胞的分化。IL-21的表达依赖于STAT3。STAT3可以直接结合分泌的IL-21启动子,诱导Th17细胞再生产IL-21,并形成STAT3-Th17-IL-21自分泌环 [9]。IL-21可以通过IL-6诱导,并与IL-6一起上调IL-23受体的表达。IL-21不仅促进了Th17细胞的扩增,还维持了其表型的稳定性。
● IL-23
稳定阶段主要由IL-23维持。尽管IL-23不参与Th17细胞的早期分化,但它是调节Th17细胞免疫功能的重要细胞因子,具有促进Th17细胞增殖和维持细胞亚群稳定性的功能。
在自身免疫性疾病的机制中,IL-23是促进Th17细胞引起的免疫病理损伤的重要效应因子,对诸如EAE和胶原关节炎等自身免疫疾病的诱导起重要作用。
IL-23与TGF-β、IL-6和IL-21一起上调Th17细胞表面的IL-23R的表达,并促进IL-17A、IL-17F和IL-22的产生。IL-23结合其受体并激活JAK-STAT信号通路,导致Jak2和Tyk2的磷酸化,从而促进信号转导和转录激活子1(STAT1)、STAT3、STAT4和STAT5的磷酸化。
细胞因子IL-23也可能通过激活STAT3信号通路上调IL-17的表达 [10]。
IL-1也在Th17细胞的扩增和稳定中发挥重要作用。
● IRF4
IRF4(干扰素调节因子4)因子也是Th17细胞发展的关键成分。Brustle等人 [11]发现IRF4对Th17细胞分化具有积极影响。
● STAT3
STAT3的激活对于IL-6和IL-2调控Th17分化是必要的。
STAT3的缺失会导致Th17细胞特异性转录因子RORγt和RORα的表达显著减少,而Foxp3的表达增加。Foxp3通过直接结合RORγt抑制RORγt介导的IL-17 mRNA转录,从而影响Th17细胞的功能 [12]。
当STAT3过度活跃时,RORγt的表达增加,从而抑制了Foxp3的表达,从而抑制了CD4+ T细胞分化为Treg细胞的过程,并促进Th17细胞的增殖。
此外,STAT3还可以增强Th17细胞对IL-23的响应能力,并通过SOCS3的抑制因子上调IL-17的表达。
● RORγt和RORα
RORγt(孤儿核受体γ t)是Th17细胞特异性转录因子。RORγt在Th17细胞分化过程中持续表达,并控制重要细胞因子如IL-17的表达。它诱导初级CD4+ T细胞分化为Th17细胞,IL-17的表达也依赖于其存在。与RORγt相比,RORα对于促进Th17细胞分化的能力较弱,似乎在Th17细胞的表达中发挥协同作用。
3.2 负向调节
● IL-27
IL-27是一种抑制Th17细胞分化的细胞因子,STAT1参与了这种抑制作用。IL-27的缺失会导致Th17细胞功能亢进,并在中枢神经系统中促进炎症反应 [13]。
● IL-2
最近的研究发现IL-2是Th17细胞分化的抑制因子。IL-2抑制Th17分化的机制需要STAT5的参与 [14]。IL-2可以磷酸化STAT5并直接结合IL-17基因的启动子,从而抑制IL-17的表达。此外,IL-2显著降低了RORγt的表达。
● STAT1
STAT1抑制Th17细胞分化。一方面,STAT1通过上调SOCS3的表达减弱STAT3的活性;另一方面,STAT1通过抑制TGF-β介导的Smad转录活性来抑制Th17细胞分化。
● STAT5
目前的实验显示STAT5在Th17细胞分化上具有不同的作用。Yang等人 [15]发现过表达活化STAT5并不影响Th17细胞分化,而其他研究发现STAT5参与介导IL-2对Th17分化的抑制作用。
● Socs3
细胞因子信号抑制因子3(SOCS3)是一组在Th17细胞分化中抑制Janus激酶(JAK)和STAT信号转导的蛋白质。它起到负调节作用。
SOCS3的作用机制:SOCS3限制STAT3的磷酸化,抑制STAT3与IL-17A/F启动子的结合,从而抑制Th17细胞的产生。
IL-6和IL-21可以促进细胞因子信号抑制因子3(SOCS3)的表达。相反,TGF-β抑制SOCS3的表达。
● Ets-1
Moisan J等人 [16] 表明Ets-1是Th17细胞分化的负调节因子。Ets-1通过调控IL-2的表达来抑制Th17细胞的分化。
● IFN-γ
IFN-γ通过抑制Smad3的磷酸化阻断TGF-β受体的作用,从而干扰TGF-β诱导的Th17细胞分化的过程。

图3. Th17细胞分化的调控过程
4. Th17细胞的生物学效应
Th17细胞主要通过分泌的细胞因子,如IL-17、IL-21、IL-22、IL-26和肿瘤坏死因子α(TNF-α),介导炎症反应,在外源性病原体感染、肿瘤、移植排斥和自身免疫组织损伤的发展中发挥重要作用。
在Th17细胞分泌的细胞因子中,最重要的效应分子是IL-17。这个细胞因子家族包括6个IL-17成员(AF)和5个受体(IL-17RAIL-17RD和SEF)。
IL-17的主要生物学效应是促进炎症反应,在宿主对抗细菌感染的免疫中扮演重要角色。
IL-17A的生理效应:在感染或炎症的早期阶段,IL-17A通过有效调节中性粒细胞参与促炎反应。
IL-17A可以诱导IL-6、急性期蛋白(APP)、粒细胞集落刺激因子(G-CSF)和前列腺素E2(PGE2)的表达,并与TNF-α一起增强促炎效应;IL-17A还增加了血管内皮细胞的生长,从而促进血管生成。
IL-17F和IL-17A在氨基酸水平上具有最高的同源性,并且在不同自身免疫疾病中也具有重叠的效应 [17]。
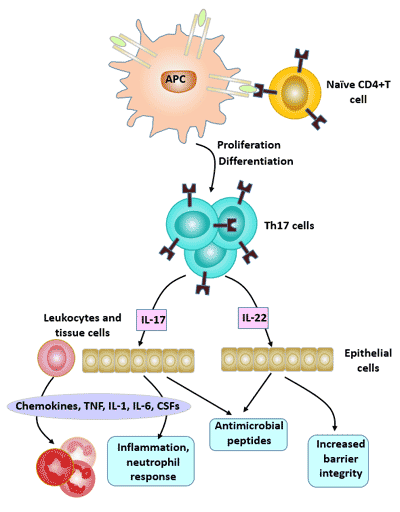
图4. Th17细胞的生物学效应
5. Th17细胞与疾病
Th17细胞在自身免疫性疾病、传染病和移植排斥中发挥重要的调节作用。大量研究表明,IL-17与实验性自身免疫性脑炎(EAE)、哮喘和类风湿性关节炎(RA)等自身免疫性疾病密切相关。
5.1 Th17细胞与类风湿性关节炎
类风湿性关节炎(RA)是一种慢性自身免疫性疾病,其发病机制尚不清楚。在类风湿性关节炎的发生和发展中,Th17细胞的激活及其细胞因子起着关键作用 [18]。
CD4+ T细胞在受到IL-23刺激后能产生大量的IL-17。IL-17可以促进各种趋化因子的表达,进一步诱导中性粒细胞、巨噬细胞和淋巴细胞在滑膜组织中积聚。随后,致病性T细胞的分化、增殖和功能稳定性引起滑膜组织增生和滑膜降解酶的分泌,最终导致类风湿性关节炎患者的滑膜炎症。
5.2 Th17与传染病
Th17细胞是炎症的重要效应细胞和靶细胞,在慢性炎症过程中发挥重要作用。体内Th17/Treg平衡是感染发生和感染严重性的重要调节机制。Th17细胞是参与传染病的重要淋巴细胞。
细胞因子IL-23能诱导Th17的发展,并促使其分泌其他因子(如IL-17、IL-6、IL-8等)。
5.3 Th17与肿瘤
大部分研究表明Th17细胞可能促进肿瘤的发展 [19]。研究发现 [20],IL-17能促进小鼠体内的肿瘤生长。然而,一些研究则暗示Th17细胞可能抑制肿瘤的发展 [21]。
参考文献:
[1] Park H, Li Z, Yang X O, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17 [J]. Nature Immunology, 2005, 6(11): 1133-1141.
[2] Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages [J]. Nature Immunology, 2005, 6(11): 1123-1132.
[3] Cua D J, Sherlock J, Chen Y, et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain [J]. Nature, 2003, 421(6924): 744-748.
[4] Croxford A L, Mair F, Becher B. IL-23: One cytokine in control of autoimmunity [J]. European Journal of Immunology, 2012, 42(9): 2263-2273.
[5] Carrier Y, Gao W, Korn T, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells [J]. Nature (London), 2006, 441(7090): 235-238.
[6] Zhou L, Lopes J E, Chong M M, et al. TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing ROR gamma t function [J]. Nature, 2008, 453(7192): 236-40.
[7] Monteleone G, Pallone F, Macdonald T T. Interleukin-21: a critical regulator of the balance between effector and regulatory T-cell responses [J]. Trends in Immunology, 2008, 29(6): 0-294.
[8] Chung Y, Chang S H, Martinez G J, et al. Critical Regulation of Early Th17 Cell Differentiation by Interleukin-1 Signaling [J]. Immunity, 2009, 30(4): 576-587.
[9] Wei L, Laurence A, Elias K M, et al. IL-21 Is Produced by Th17 Cells and Drives IL-17 Production in a STAT3-dependent Manner [J]. Journal of Biological Chemistry, 2007, 282(48): 34605-34610.
[10] Mathur A N, Chang H C, Zisoulis D G, et al. Stat3 and Stat4 Direct Development of IL-17-Secreting Th Cells [J]. The Journal of Immunology, 2007, 178(8): 4901-4907.
[11] Floess S, Freyer J, Siewert C, et al. Epigenetic Control of the foxp3 Locus in Regulatory T Cells [J]. PLoS Biology, 2007, 5(2): e38.
[12] Ichiyama K, Yoshida H, Wakabayashi Y, et al. Foxp3 inhibits ROR gamma t-mediated IL-17A mRNA transcription through direct interaction with RORgammat [J]. Journal of Biological Chemistry, 2008, 283(25): 17003-17008.
[13] Tone Y, Furuuchi K, Kojima Y, et al. Smad3 and NFAT cooperate to induce Foxp3 expression through its enhancer [J]. Nature Immunology, 2008, 9(2): 194-202.
[14] Cobb B S, Hertweck A, Smith J, et al. A role for Dicer in immune regulation [J]. Journal of Experimental Medicine, 2006, 203(11): 2519-2527.
[15] Li B, Carey M, Workman J L. The Role of Chromatin during Transcription [J]. Cell, 2007, 128(4): 0-719.
[16] Moisan J, Grenningloh R, Bettelli E, et al. Ets-1 is a negative regulator of Th17 differentiation [J]. Journal of Experimental Medicine, 2007, 204(12): 2825-2835.
[17] Chaudhari S S, Moussian B, Specht C A, et al. Functional Specialization Among Members Of Knickkopf Family Of Proteins In Insect Cuticle Organization [J]. Plos Genetics, 2014, 10(8): e1004537.
[18] Leipe J, Grunke M, Dechant C, et al. Role of Th17 cells in human autoimmune arthritis [J]. Arthritis & Rheumatism, 2014, 62(10): 2876-2885.
[19] Iwahashi. Tumor-infiltrating CD4+ Th17 cells produce IL-17 in tumor microenvironment and promote tumor progression in human gastric cancer [J]. Oncology Reports, 2011, 25(5).
[20] Numasaki M, Fukushi J I, Ono M, et al. Interleukin-17 promotes angiogenesis and tumor growth [J]. Blood, 2003, 101(7): 2620-2627.
[21] Yang L J, Qi Y X, Hu J, et al. Expression of Th17 Cells in Breast Cancer Tissue and Its Association with Clinical Parameters [J]. Cell Biochemistry & Biophysics, 2012, 62(1): 153-159.
上一篇: Th1和Th2细胞如何分化?
下一篇: Treg细胞的鉴别











