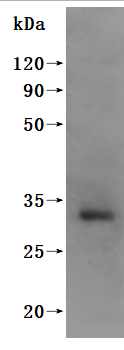
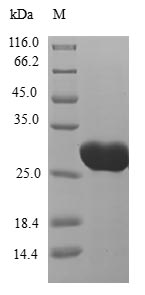
CT83/KK-LC-1蛋白:癌睾抗原CTAs家族潜力新秀,乳腺癌、肺癌、胃癌等肿瘤临床研究进行中!
日期:2024-04-30 11:31:35
癌睾抗原(Cancer Testis Antigens,CTAs)是一类主要在睾丸组织中表达的蛋白质,而在其它正常组织中通常不表达。越来越多的研究表明,CTAs在多种类型的肿瘤中呈异常高表达,且许多CTAs是致瘤性的。癌睾抗原-83(CT83),也称为KK-LC-1,属于CTAs家族中的一员。CT83最初在2006年的肺癌研究中被鉴定为一种肿瘤特异性抗原,随后的研究也发现它在胃癌、乳腺癌和肝癌等多种肿瘤中呈现差异性表达。来自Pubmed数据显示,CT83相关的报道鲜少,其在肿瘤中的作用和机制尚不明确。此外,市场上针对CT83的商业化单克隆抗体也是极其稀缺。尽管如此,已有关于CT83的研究进入临床阶段,因此,CT83作为一个新兴的肿瘤研究靶点,正逐渐受到药物研发机构的关注!
1. 什么是CT83?
1.1 CT83的结构
CT83,又称CXorf61或KK-LC-1,属于肿瘤/睾丸抗原CTAs(cancer/testis antigens)成员之一。CT83最初是从肺癌患者异体肺癌细胞系与HLA-B*1507限制性细胞毒性T淋巴细胞(CTL)建立的cDNA文库中筛选并克隆而得,因此也常见为Kita-Kyushu肺癌抗原-1(KK-LC-1)。CT83编码基因位于Xq22染色体上,编码的蛋白质含有113个氨基酸。早在1991年,van der Bruggen等通过T细胞表位克隆技术发现了第一个肿瘤/睾丸抗原--MAGE-1/MAGE-A1。随后,MAGE-A家族基因陆续被鉴定。后来,通过SEREX技术,研究人员发现了其他抗原,如NY-ESO-1/CTAG1A,NY-SAR-35/FMR1NB,CT7,SSX2,SCP1,OY-TES-1,PASD1,SLCO6A1和KK-LC-1等抗原。目前已鉴定的CTAs抗原超过200种,但它们的免疫原性仍有待进一步研究 [1-3]。
1.2 CT83表达和功能
癌睾抗原CTAs是一种在男性睾丸组织中表达,其它正常组织中不表达,而在肿瘤组织中高表达的蛋白。癌睾抗原的异常高表达与肿瘤的发生与转移紧密相关。多种癌睾抗原在肺癌、肝癌、胃癌、肠癌、乳腺癌、白血病和宫颈癌等恶性肿瘤中异常高表达,包括CT10、CT45和CT83等。虽然CT83的结构和功能尚未完全阐明,CT83作为癌睾抗原家族的一员,已有报道,CT83在多种恶性肿瘤中异常高表达(图1)[3]。此外,有研究揭示,CT83高表达可以在体内外显著增加肝癌细胞的迁移、侵袭、增殖和EMT的能力。因此,CT83被认为是一个潜在的肿瘤免疫治疗靶标 [4-6]。
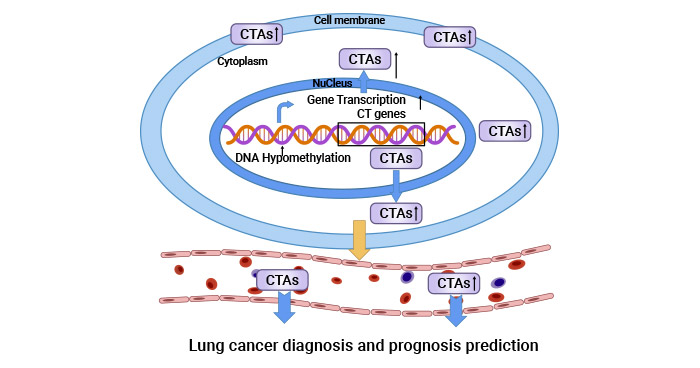
图1. 癌睾抗原CTAs和肿瘤密切相关 [3]
2. CT83相关的信号通路研究
CT83作为一种致瘤基因,在多种肿瘤中高表达,其背后涉及启动子去甲基化及致癌转录因子STAT3介导的转录激活过程。然而,是何种因素激活STAT3从而与CT83基因启动子结合进而促进CT83高表达有待更深入研究。无论如何,CT83的这种过度表达对癌细胞的迁移与侵袭特性产生显著影响,表现为增强此类恶性行为,而基因敲除实验则证实其对这些过程的必要调控作用。目前,已有相关研究进一步阐述CT83在肿瘤中的可能性信号调控机制 [7-9]。
一项研究发现,CT83高表达后可以提高宫颈癌细胞中磷酸化ERK、HIF-la、HIF-2a和VE-Cadherin等四种致瘤蛋白水平,CT83敲除可以抑制相关蛋白的表达(图2) [6, 10-11, 20]。总所周知,ERK信号通路在细胞的增殖、分化和癌变中起着重要作用,且与肿瘤的发生转移紧密相关;HIF-1a和HIF-2a作为转录因子,可以激活一系列与肿瘤细胞迁移、粘附和血管形成有关基因的表达;VE-Cadherin作为血管内皮细胞钙黏附蛋白,在肿瘤细胞黏附连接,血管形成中发挥重要作用 [11]。此外,关于CT83在其它肿瘤中的研究提示,CT83通过调控癌基因(如HSPB8和CDH5)与抑癌基因(如BATF、CDHR5和PRAPI)的表达平衡,促进肿瘤的恶性转化 [18-20]。因此,CT83在肿瘤中的信号调节,其涉及多个关键环节,它可能通过影响癌基因与抑癌基因的表达平衡以及参与重要的信号通路调控,促进了肿瘤的恶性转化。
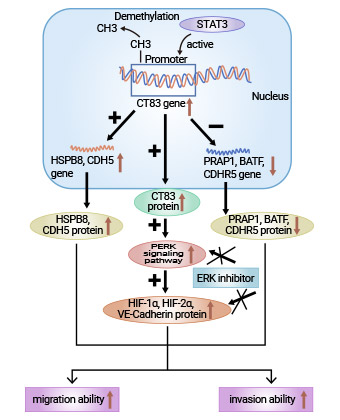
图2. CT83相关的信号通路研究 [20]
3. CT83和肿瘤相关的研究
CT83作为一种肿瘤特异性抗原,虽然现阶段国内外的相关报道较少,但现有文献表明,CT83可能成为未来肿瘤研究的重要靶标。研究表明,CT83在多种肿瘤中异常表达,包括肺癌、胃癌、乳腺癌和肝癌等,且与肿瘤的发生和发展密切相关。这一发现引起了学者们对CT83在肿瘤中作用和机制的兴趣。因此,CT83正逐渐崭露头角,吸引着越来越多的研究者的关注。
3.1 CT83和乳腺癌研究
相关生信分析表明,生物信息学分析显示,CT83激活与三阴性乳腺癌(TNBC)患者低生存率密切相关。CT83异常激活导致16个关键细胞周期调控基因失调,如CCNB2、CDC20、CDC25A/B、CDK1、CHEK1、ESPL1、MAD2L1、MCM2、MCM3、MCM5、MCM6、MYC、ORC6、PLK1和PTTG1,形成驱动TNBC发生的细胞周期信号网络。CDKs(如CDK1、CDK2、CDK4、CDK6)、CDC25磷酸酶及MYC致癌转录因子在肿瘤中常异常表达或活性增强,均参与细胞周期调控 [21]。此外,有研究报道,KK-LC-1通过MAL2/MUC1-C/PI3K/AKT/mTOR途径调节三阴性乳腺癌细胞的生物学行为(图3) [22]。因此,CT83可能通过协同激活一系列致瘤性细胞周期调控基因,促进三阴性乳腺癌TNBC的发生发展。
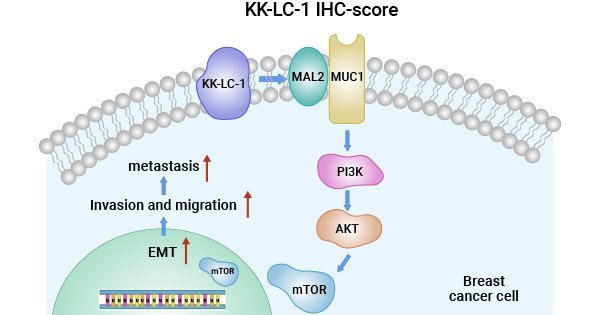
图3. CT83/KK-LC-1通过MAL2/MUC1-C/PI3K/AKT/mTOR途径调节TNBC [22]
3.2 CT83和肺癌研究
研究发现,CT83/KK-LC-1特异性的TCRαβ‐CD8 γδT细胞对KK-LC-1阳性的肺癌细胞F1121L显示出了细胞毒效应,且通过IFN-γ分泌增强抗癌效果。此外,有研究通过对CT83的转录本的表达进行生信分析后发现,6个与CT83相关的下游基因(CPS1、RHOV、TNNT1、FAM83A、JGF2BP1和GRIN2A)与肺癌患者不良预后相关,且6种免疫检查点分子(CTLA4、PD1、IDO1、TDO2、LAG3和TIGIT)与肺腺癌高风险评分相关,免疫抑制性微环境对预后的影响。抑制肺癌细胞CT83的表达或活性,理论上有望改善免疫微环境,增强免疫系统对肺癌的清除能力,提高患者预后。然而,CT83在肺癌中的确切作用机制尚有待深入探究 [23]。
3.3 CT83和胃癌研究
研究发现,幽门螺旋杆菌阳性胃癌患者中CT83常高表达,表明二者关联密切。进一步研究显示,CT83高表达胃癌患者体内幽门螺旋杆菌IgG滴度显著高于无CT83表达者,提示CT83可能是治疗干预的关键靶点。通过基因表达谱分析,发现胃癌早期关键mRNAs与蛋白质参与分泌调节、营养物质消化吸收、胆固醇代谢、血小板激活及p53信号传导等生物过程。生存分析中,构建的以ADGRG7、CT83和MMP12为基础的胃癌预后模型预测性能良好,为临床决策提供客观依据。因此,CT83在揭示胃癌与幽门螺旋杆菌相互作用机制、指导针对性治疗及预后评估方面具有重要意义 [24]。
3.4 CT83和肝癌研究
CT83在肝癌组织中呈现出显著的过度表达现象,其通过直接干预Presenilin-1/Notch1/Hes1信号传导轴,对肝癌细胞的增殖、迁移、侵袭以及上皮间质转化(EMT)进程产生深远影响。Notch信号通路,作为组织与器官正常发育的关键调控因子,在肝癌的发生与演化过程中起着核心作用。在哺乳动物体内,Notch家族包含四种不同的受体蛋白,其中Notch1在肝细胞中占据主导地位,其高表达与肝癌恶化、转移及不良预后相关。另一方面,CpG岛低甲基化可激活癌睾抗原基因,且与CT83高表达有关。总结而言,CT83在肝癌的进展与转移环节中发挥着不可或缺的作用,因而具备作为肝癌诊断与预后评估的重要生物标志物的潜力 [25]。
3.5 CT83和其它癌症研究
此外,CT83蛋白在黑色素瘤、结肠癌、宫颈癌、食管癌及胰腺癌等多种恶性肿瘤中呈现出显著的过表达现象,引起了医学研究领域的高度重视 [26-29]。大量研究证据表明,CT83的异常高表达并非偶然,而是与特定的分子机制紧密关联。具体来说,CT83基因启动子区域的DNA甲基化状态发生显著变化,尤其是去甲基化过程的增强,与CT83的过度表达直接相关。同时,这一过程往往伴随着致癌转录因子STAT3的激活,两者协同作用,促进癌细胞迁移与侵袭。此现象暗示CT83的高表达可能由启动子去甲基化的共性表观遗传调控所致。CT83有潜力作为癌症诊断标志物、预后指标及免疫治疗靶点,但这些理论有待进一步研究验证。
4. CT83的临床研究前景
目前针对CT83/KKLC1靶点的抗癌药物已有3款进入临床试验,涵盖乳腺癌、肺癌、胃癌等多种适应症,其作用机制涉及免疫细胞毒性和T淋巴细胞激活。多家研究机构如National Cancer Institute、T-Cure Bioscience, Inc.以及上海精缮生物科技有限责任公司等参与其中。尤其值得关注的是,瑞士CDR-Life Inc.在2024年AACR年会上公布的针对KK-LC-1/HLA-A01的TCE抗体预临床数据,展现出显著的抗肿瘤特性和活性。尽管面临健康组织中非目标肽的挑战,该TCE抗体对KK-LC-1/HLA-A01阳性癌细胞表现出强大杀伤力,且对健康细胞无细胞毒性,体外研究显示其对目标肽具有高度特异性结合与激活能力 [30]。这些成果不仅增强了对KK-LC-1/CT83靶向疗法的信心,也拓宽了针对不同HLA等位基因患者的治疗选择,预示着CT83靶点将在未来临床研究中开启更广泛、更具潜力的抗癌治疗研究路径。
为鼎力协助各药企针对CT83/KKLC1在多种肿瘤,如乳腺癌、肺癌、胃癌等在临床中的研究,j9九游会登录入口首页CUSABIO推出CT83/KKLC1(CSB-MP711093HU; CSB-EP711093HU1; CSB-EP711093HU1-B; CSB-EP711093HU)蛋白产品,助力您在对CT83/KKLC1机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页CUSABIO蛋白CT83
参考文献:
[1] Bai, Rui, and Cheng Yuan. "Kita-kyushu lung cancer antigen-1 (KK-LC-1): a promising cancer testis antigen." Aging and Disease 13.4 (2022): 1267.
[2] Hsu, Robert, et al. "Molecular characterization of Kita-Kyushu lung cancer antigen (KK-LC-1) expressing carcinomas." Oncotarget 12.25 (2021): 2449.
[3] Yang, Ping, et al. "Cancer/testis antigens as biomarker and target for the diagnosis, prognosis, and therapy of lung cancer." Frontiers in Oncology 12 (2022): 864159.
[4] Zhou, Xingchun, et al. "Heterogeneous expression of CT10, CT45 and GAGE7 antigens and their prognostic significance in human breast carcinoma." Japanese Journal of Clinical Oncology 43.3 (2013): 243-250.
[5] Chen, Zhiqiang, et al. "Hypomethylation‐mediated activation of cancer/testis antigen KK‐LC‐1 facilitates hepatocellular carcinoma progression through activating the Notch1/Hes1 signalling." Cell Proliferation 52.3 (2019): e12581.
[6] Norberg, Scott, et al. "A phase I trial of T-cell receptor gene therapy targeting KK-LC-1 for gastric, breast, cervical, lung and other KK-LC-1 positive epithelial cancers." (2022): TPS2678-TPS2678.
[7] Kang, Yanli, et al. "Cancer-testis antigen KK-LC-1 is a potential biomarker associated with immune cell infiltration in lung adenocarcinoma." BMC cancer 22.1 (2022): 834.
[8] Chen, Zhiqiang, et al. "Hypomethylation‐mediated activation of cancer/testis antigen KK‐LC‐1 facilitates hepatocellular carcinoma progression through activating the Notch1/Hes1 signalling." Cell Proliferation 52.3 (2019): e12581.
[9] Mabjeesh, Nicola J., and S. Amir. "Hypoxia-inducible factor (HIF) in human tumorigenesis." Histology and histopathology (2007).
[10] Marcinkowski, Bridget, et al. "Preclinical characterization of a KK-LC-1-specific T cell receptor for the treatment of epithelial cancers." Cancer Research 79.13_Supplement (2019): 1429-1429.
[11] Kim, Min Kyu, et al. "Clinical significance of HIF-2α immunostaining area in radioresistant cervical cancer." Journal of Gynecologic Oncology 22.1 (2011): 44.
[12] Gul, Samina, et al. "Stemness signature and targeted therapeutic drugs identification for Triple Negative Breast Cancer." Scientific Data 10.1 (2023): 815.
[13] Zeng, Yaoying, et al. "Integrating Network Pharmacology, Molecular Docking, and Experimental Validation to Investigate the Mechanism of (−)-Guaiol Against Lung Adenocarcinoma." Medical Science Monitor: International Medical Journal of Experimental and Clinical Research 28 (2022): e937131-1.
[14] Chen, Chen, et al. "Multiomics analysis reveals CT83 is the most specific gene for triple negative breast cancer and its hypomethylation is oncogenic in breast cancer." Scientific reports 11.1 (2021): 12172.
[15] Gao, Junyi, et al. "Up‐regulation of CDHR5 expression promotes malignant phenotype of pancreatic ductal adenocarcinoma." Journal of Cellular and Molecular Medicine 24.21 (2020): 12726-12735.
[16] Inoue-Shibui, Aya, et al. "A novel deletion in the C-terminal region of HSPB8 in a family with rimmed vacuolar myopathy." Journal of Human Genetics 66.10 (2021): 965-972.
[17] Li, Qingyang, et al. "Natural high-avidity T-cell receptor efficiently mediates regression of cancer/testis antigen 83 positive common solid cancers." Journal for Immunotherapy of Cancer 10.7 (2022).
[18] Marcinkowski, Bridget, et al. "Cancer targeting by TCR gene-engineered T cells directed against Kita-Kyushu Lung Cancer Antigen-1." Journal for immunotherapy of cancer 7 (2019): 1-9.
[19] Lin, Min, et al. "Recent advances on the molecular mechanism of cervical carcinogenesis based on systems biology technologies." Computational and Structural Biotechnology Journal 17 (2019): 241-250.
[20] Qiao Yingnan. The mechanisms underlying regulation of proto-oncogene CT83 expression and promotion of cervical cancer cell migration and invasion [D]. Soochow University, 2022.
[21] Chen, Chen, et al. "Multiomics analysis reveals CT83 is the most specific gene for triple negative breast cancer and its hypomethylation is oncogenic in breast cancer." Scientific reports 11.1 (2021): 12172.
[22] Zhu, Xudong, et al. "Targeting KK-LC-1 inhibits malignant biological behaviors of triple-negative breast cancer." Journal of Translational Medicine 21.1 (2023): 184.
[23] Ichiki, Yoshinobu, et al. "Development of adoptive immunotherapy with KK‐LC‐1‐specific TCR‐transduced γδT cells against lung cancer cells." Cancer Science 111.11 (2020): 4021-4030.
[24] Hu, Yeting, et al. "Quantitative Analysis on Molecular Characteristics Evolution of Gastric Cancer Progression and Prognosis." Advanced Biology 7.10 (2023): 2300129.
[25] Chen, Zhiqiang, et al. "Hypomethylation‐mediated activation of cancer/testis antigen KK‐LC‐1 facilitates hepatocellular carcinoma progression through activating the Notch1/Hes1 signalling." Cell Proliferation 52.3 (2019): e12581.
[26] Otsuka, Toshikazu, et al. "Detection of Kita-Kyushu Lung Cancer Antigen-1, a Cancer/Testis Antigen, in the Stomach Close to a Cancerous Condition." Journal of Cancer 13.14 (2022): 3526.
[27] Fukuyama, Takashi, et al. "Expression of KK-LC-1, a cancer/testis antigen, at non-tumour sites of the stomach carrying a tumour." Scientific reports 8.1 (2018): 6131.
[28] Bai, Rui, and Cheng Yuan. "Kita-kyushu lung cancer antigen-1 (KK-LC-1): a promising cancer testis antigen." Aging and Disease 13.4 (2022): 1267.
[29] Marcinkowski, Bridget, et al. "Cancer targeting by TCR gene-engineered T cells directed against Kita-Kyushu Lung Cancer Antigen-1." Journal for immunotherapy of cancer 7 (2019): 1-9.
[30] Scheifele, Fabian, et al. "Abstract LB442: Novel antibodies against a KK-LC-1-derived peptide presented on HLA-A* 01 on tumor cells." Cancer Research 84.7_Supplement (2024): LB442-LB442.