细胞衰老及其标志物
日期:2023-12-07 08:51:22
一个细胞不仅是生物结构和功能的基本单位,也是有机体衰老的基本单位。有机体的大多数细胞在其生命周期内经历几个阶段:增殖、分化、衰老和死亡。众所周知,没有什么是永恒不变的,细胞的增殖能力也不例外。细胞持续分裂的一个障碍是衰老,这首次被提出用来描述有限的增殖能力 [1]。正常人类胚胎细胞在分裂之前可以进行的次数(约50次),这被称为“海夫利克极限”,是由Leonard Hayflick和Paul Moorhead于1961年首次提出的,以描述培养中正常人类成纤维细胞的有限增殖能力。
在这篇综述中,我们将介绍细胞衰老的定义,衰老细胞的特征,调控衰老增殖阻滞的两条途径,以及细胞衰老标志物。
1. 什么是细胞衰老?
细胞衰老是一种增殖细胞停止分裂并永久性退出细胞周期的过程。与可通过适当的有丝分裂原恢复的休眠状态不同,衰老是一种永久性的细胞周期阻滞状态。细胞在遇到多种刺激时会发生衰老,包括端粒功能障碍、DNA损伤、线粒体功能障碍、氧化应激、癌基因活化、营养信号紊乱、慢性炎症、有丝分裂信号或暴露于外源性毒素等 [2-4]。
细胞衰老对细胞产生双重影响。它在胚胎发育、组织稳态维持、伤口愈合、宿主免疫以及抑制肿瘤进展方面发挥着有益作用 [5-8]。相反,细胞衰老是衰老和与年龄相关疾病的主要原因之一。它在发育和受伤后促进组织再生,但会削弱细胞的再生和功能能力,导致衰老生物体中的炎症和肿瘤发生。由于清除不足,衰老细胞会在晚期病理阶段稳定累积,导致病理症状加剧。此外,衰老细胞还可以通过上调和释放可以改变肿瘤微环境的因子来促进癌症进展,包括炎性细胞因子、趋化因子和生长调节因子。
2. 衰老细胞的特征
衰老细胞保持活力或代谢活性 [9][10],并表现出一些明显的变化,具有四个典型特征,包括不可逆的细胞周期阻滞、衰老相关分泌表型(SASP)、巨分子损伤和代谢紊乱。衰老细胞还可能经历结构和形态的改变,例如体积增大、扁平化、多核形态,伴有增加的液泡,修改的细胞膜组成以及令人惊讶的核膨胀。
细胞周期阻滞
不可逆的细胞周期阻滞是细胞衰老最基本的特征之一。这种现象是在体外鉴定细胞衰老最基本和不可或缺的指标之一。
衰老相关分泌表型(SASP)
衰老细胞分泌许多因子,包括炎性细胞因子、趋化因子、生长调节因子、血管生成因子和基质金属蛋白酶,统称为SASP。SASP是衰老细胞的另一个典型标志。这些SASP因子与免疫系统合作,改善细胞微环境,影响邻近细胞的增殖和分化,从而双向调节器官衰老以及肿瘤的发生和发展。
| SASP 类型 | 成分 |
|---|---|
| 白细胞介素 | IL-1a, IL-1b, IL-6, IL-7, IL-13, IL-15 |
| 趋化因子 (CXCL, CCL) | IL-8, GRO-a, GRO-b, GRO-gamma, MCP-2, MCP-4, MIP-1a, MIP-3a, HCC-4, eotaxin-3, TECK, ENA-78, I-309, I-TAC |
| 其他炎症因素 | GM-CSE, G-CSE, IFN-γ, BLC, MIF |
| 生长因子和调节因子 | EGF, bFGF, HGF, KGF (FGF7), VEGF, Angiogenin, SCF, SDF-1, PIGF, NGF, IGFBP-2, IGFBP-3, IGFBP-4, IGFBP-6, IGFBP-7 |
| 蛋白酶和调节剂 | MMP-1, MMP-3, MMP-10, MMP-12, MMP-13, MMP-14, TIMP-1, TIMP-2, PAI-1, PAI-2, tPA, uPA, Cathepsin B |
| 可溶性或脱落的受体或配体 | ICAM-1, ICAM-3, OPG, sTNFRI, TRAIL-R3, Fas, sTNFRII, uPAR, SGP130, EGF-R |
| 非蛋白可溶性因子 | PGE2,一氧化氮,活性氧 |
| 不溶性因子(ECM) | 纤维连接蛋白,胶原蛋白,层粘连蛋白 |
表1:SASP因子的包合作用
(本表资料引自:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4166495/)
巨分子损伤
在衰老细胞中存在三种巨分子损伤:DNA损伤、蛋白质损伤和脂质损伤。端粒缩短与细胞周期阻滞密切相关。在衰老细胞中,线粒体功能障碍、ATP生成受阻以及大量ROS产生最终导致蛋白质损伤和脂质损伤。
代谢紊乱
衰老细胞的溶酶体数量和大小增加。SA-B-GAL在溶酶体中积累。
3. 细胞衰老标志物
到目前为止,还没有完全独特于衰老状态的标志物或特征被确定。此外,并非所有衰老细胞都表达所有可用的衰老标志物。一些已知的衰老标志物包括短而功能异常的端粒、p16INK4A的表达、持续的DNA损伤反应、SASP的释放、衰老相关异染色质聚集点(SAHF)、增强的衰老相关β-半乳糖苷酶(SA-β-gal)活性是识别衰老细胞的最早的生物标志物之一,以及Lamin B1的丧失。
| 不同方面 | 衰老特征或标记 | 进一步说明 |
|---|---|---|
| 形态特征 | 增加的尺寸 |
衰老细胞通常呈现多核、大、多边形和扁平的形态,并具有纺锤形和液泡化特征[11]。衰老细胞的高尔基体和溶酶体数量增加,胞浆内颗粒明显增多。这些形态学特征可以用明视野显微镜等方法进行评估,并可能反映出它们代谢和细胞器稳态的改变。 |
| 增加的粒度 | ||
| 细胞周期阻滞 | P53和磷酸化P53 | 磷酸化p53的积累促进细胞周期蛋白依赖性激酶抑制剂(CDKIs)的激活,最终导致细胞周期阻滞。 |
| 53BP1 | 53BP1通过p53介导细胞衰老。53BP1-p53相互作用缺陷导致p53依赖性细胞周期检查点激活效率低下,最终导致细胞衰老。 | |
| P21 | 当与CDK2结合时,p21通过阻止G1-S转变来抑制细胞周期。 | |
| p16 | p16INK4A染色是公认的衰老标志物之一[12]。大多数衰老细胞表达p16INK4a。p16与CDK4和CDK6结合,导致细胞周期阻滞在G1期。 | |
| Rb和磷酸Rb | Rb的磷酸化促进了细胞周期的进展,而在衰老细胞中未检测到磷酸化Rb。多种CDKIs(包括p21和p16)对细胞周期的抑制导致Rb的过度活化;这最终促进了细胞周期的停滞和衰老。 | |
| 线粒体遗传 | 增加尺寸/数量 | 衰老细胞线粒体丰度增加,膜电位改变,ROS生成增加,氧化磷酸化和耗氧量增加。它们可以用来增强衰老细胞的表型。 |
| 增加活性氧生成 | ||
| 降低膜的完整性 | ||
| 溶酶体的变化 | 增加尺寸/数量 | 衰老细胞中的溶酶体丰度允许通过增强的自噬进行衰老溶解。 |
| 增强SA-β-gal活性 | SA-β-gal活性是最早识别衰老细胞的生物标志物之一,可在pH 6.0时检测到 [13]。SA-β-gal部分反映了溶酶体质量的增加 [13][14]。它在衰老细胞的溶酶体中积累。 | |
| 脂褐质积累 | 脂褐素是溶酶体副产物的聚集体,在衰老细胞中积累。 | |
| 核变化 | 端粒缩短 | 它是导致衰老的主要原因 [15],是细胞衰老的首要和最突出的特征性机制之一。 |
| telomere-associated foci | 这些标记都反映了DDR。H2AX在Ser139位点磷酸化成为γ-H2AX以响应DNA损伤,这使其成为研究DDR通路和衰老的有力工具。 | |
| SAHF | ||
| γ-H2AX | ||
| Lamin B1/LMNB1 缺失 | 层粘连蛋白B1参与细胞核随着衰老发生的结构变化 [16],在衰老细胞中丢失。 | |
| DNA复制减少 | 衰老细胞的增殖停止并保持较低的复制能力。 | |
| Ki67 | Ki67是一种核蛋白,常被用作细胞增殖的标记物。由于衰老细胞永久退出细胞周期,因此它们不表达Ki67。 | |
| 其他选定功能 | 胞质DNA/ cGAS-STING活化 | SASP包括白细胞介素如IL-6、趋化因子如IL-8和生长因子如VEGF7(见表1)。它们影响邻近组织,可能导致邻近细胞衰老。 |
| LINE-1逆转录转座子去抑制 | ||
| ssp相关超级增强子的重塑 |
表2:衰老标志物及特征
(本表资料引自:https://www.nature.com/articles/s43587-021-00121-8)
4. 维持细胞衰老生长阻滞的两个通路
在衰老细胞中,DNA和其他类型的巨分子损伤最终通过激活p53/p21CIP1和p16INK4a/RB抑癌通路导致细胞增殖停止。这两个通路由门卫抑癌蛋白p53和pRb调控 [17] [18]。
4.1 p53通路
在受到诸如端粒侵蚀、DNA损伤和癌基因活化等多种应激信号刺激后,p53通过两种翻译后修饰被激活:磷酸化(ATM-Chk2或ATR-Chk1)和乙酰化(p300/CBP、PCAF、Tip60/hMOF和SIRT1),以及通过增强蛋白质稳定性(ARF-MDM2)和增加翻译速率(RNPC1、HuR和RPL26)。然后,活性p53激活了促衰老的靶基因的表达,如p21和E2F7,分别有助于G1细胞周期阻滞和有丝分裂基因抑制,从而导致细胞衰老或其他细胞响应 [19] [20]。
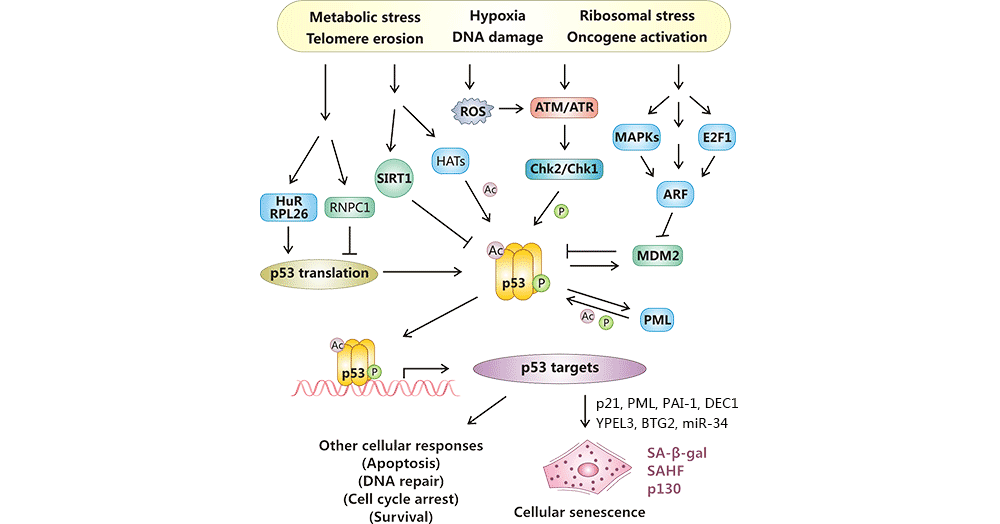
图1. p53对细胞衰老的调控
图片来自:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3784259
4.2 pRB通路
多种内部或外部应激因素触发DNA损伤应答(DDR)通路,从而引发p16INK4A通路。p16INK4A使Cdk4和Cdk6失活,导致磷酸化pRb的积累,抑制E2F转录因子的表达,促使细胞周期阻滞或衰老 [21]。
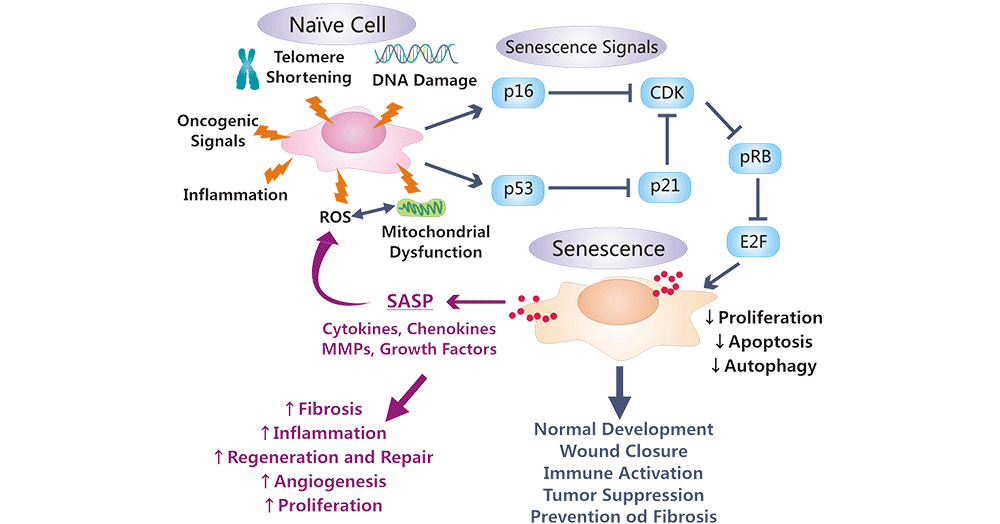
图2. 衰老细胞中p53和prb介导的调控、作用以及功能和形态改变
图片来自:衰老细胞中p53和prb介导的调控、作用以及功能和形态改变
5. 抗细胞衰老标志物抗体
j9九游会登录入口首页生物提供了一些抗体,将有助于识别和鉴定常用的细胞衰老标志物。
| 靶点 | 功能 | 抗体产品 |
|---|---|---|
| phospho-Histone H2AX (S139) | DNA损伤反应(DDR)标记物 | Recombinant Phospho-Histone H2AX (S139) Antibody |
| P16INK4A | 肿瘤抑制因子/细胞周期调节因子 | CDKN2A Antibody |
| P21 | 肿瘤抑制因子/细胞周期调节因子 | CDKN1A Antibody |
| P53 | 肿瘤抑制因子/细胞周期调节因子 | Recombinant TP53 Antibody |
| Phospho-RB1 (S780) | 肿瘤抑制因子/细胞周期调节因子 | Recombinant Phospho-RB1 (S780) Antibody |
| Ki67 | 细胞增生标记物 |
MKI67 Monoclonal Antibody |
| Beta-galactosidase | Lysosome-associated蛋白质;活性增强 | lacZ Monoclonal Antibody |
| IL-6 | SASP制造商;SASP中最显著的细胞因子;显著增加 | Recombinant IL-6 Antibody |
| IL-8 | SASP制造商;大多数衰老细胞过表达IL-8 | CXCL8 Monoclonal Antibody |
| Lamin B1 | 核层标记物;在衰老细胞中不存在 | LMNB1 Monoclonal Antibody |
参考文献:
[1] Hayflick, P.S. Moorhead. The serial cultivation of human diploid cell strains [J]. Exp. Cell Res., 25 (1961), pp. 585-621.
[2] B.G. Childs, M. Durik, et al. Cellular senescence in aging and age-related disease: from mechanisms to therapy [J]. Nat. Med., 21 (2015), pp. 1424-1435.
[3] D. Muñoz-Espín, M. Serrano. Cellular senescence: from physiology to pathology [J]. Nat. Rev. Mol. Cell Biol., 15 (2014), pp. 482-496.
[4] J.M. van Deursen. The role of senescent cells in ageing [J]. Nature, 509 (2014), pp. 439-446.
[5] Kuwano K, Araya J, et al. Cellular senescence and autophagy in the pathogenesis of chronic obstructive pulmonary disease (COPD) and idiopathic pulmonary fibrosis (IPF) [J]. Respir Investig. 54:397–406. 2016.
[6] Shimizu H, Bolati D, et al. NF-κB plays an important role in indoxyl sulfate-induced cellular senescence, fibrotic gene expression, and inhibition of proliferation in proximal tubular cells [J]. Am J Physiol Cell Physio. 2011 301:C1201–C1212.
[7] Lansu K and Gentile S. Potassium channel activation inhibits proliferation of breast cancer cells by activating a senescence program [J]. Cell Death Dis. 2013 Jun; 4(6): e652.
[8] Ma J, Hu X, Liao C, et al. Gypenoside L inhibits proliferation of liver and esophageal cancer cells by inducing senescence [J]. Molecules. 2019, 24(6):1054.
[9] J.R. Dörr, Y. Yu, M. Milanovic, et al. Synthetic lethal metabolic targeting of cellular senescence in cancer therapy [J]. Nature, 501 (2013), pp. 421-425.
[10] Matsumura T, Zerrudo Z, Hayflick L. Senescent human diploid cells in culture: survival, DNA synthesis and morphology [J]. J. Gerontol. 1979;34:328–334.
[11] Kuilman T, Michaloglou C, et al. The essence of senescence [J]. Genes Dev 2010; 24: 2463–2479.
[12] Krishnamurthy J, Torrice C, et al. Ink4a/Arf expression is a biomarker of aging [J]. J Clin Invest (2004) 114:1299–307.
[13] Dimri G.P., Lee X., et al. 1995. A biomarker that identifies senescent human cells in culture and in aging skin in vivo [J]. Proc. Natl. Acad. Sci. USA. 92:9363–9367.
[14] Lee B.Y., Han J.A., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase [J]. Aging Cell. 2006. 5:187–195.
[15] Harley CB, Futcher AB, Greider CW. Telomeres shorten during ageing of human fibroblasts [J]. Nature (1990) 345:458–60.
[16] Freund A, Laberge R-M, et al. Lamin B1 loss is a senescence-associated biomarker [J]. Mol Biol Cell (2012) 23:2066–75.
[17] F. Bringold and M. Serrano. Tumor suppressors and oncogenes in cellular senescence [J]. Exp. Gerontol., 35 (2000), pp. 317-329.
[18] A.S. Lundberg, W.C. Hahn, et al. Genes involved in senescence and immortalization [J]. Curr. Opin. Cell Biol., 12 (2000), pp. 705-709.
[19] Rufini, A., Tucci, P., et al. Senescence and aging: the critical roles of p53 [J]. Oncogene 32, 5129–5143 (2013).
[20] Qian Y and Chen X. Senescence regulation by the p53 protein family [J]. Methods Mol Biol. 2013;965:37-61.
[21] Parikh P, Wicher S, et al. Cellular senescence in the lung across the age spectrum [J]. Am J Physiol Lung Cell Mol Physiol. 2019;316(5):L826-L842.
上一篇: 细胞活力概述
下一篇: 一组有前途的蛋白质-细胞周期标记物











