一组有前途的蛋白质-细胞周期标记物
日期:2023-12-07 08:51:53
大多数真核细胞依赖内部时钟来维持其生存;它们按照一系列顺序事件进行,被称为细胞周期。细胞周期使多细胞生物能够生长和分裂,单细胞生物能够繁殖。然而,正常细胞周期调控的异常常常导致不适当的细胞分裂,最终引发疾病,甚至导致癌变。因此,细胞周期标记物的研究近年来越来越受到关注。
在这篇文章中,我们将从五个方面介绍细胞周期标记物,包括细胞周期本身,细胞周期标记物的定义,细胞周期标记物及其功能,与细胞周期标记物相关的产品,以及细胞周期标记物在肿瘤中的应用。
1. 什么是细胞周期?
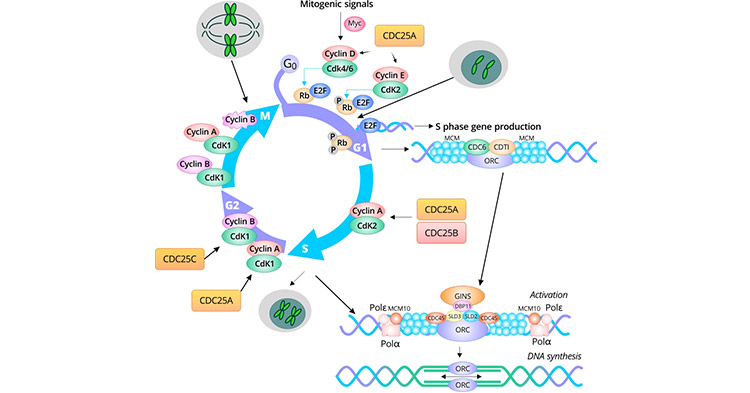
细胞周期是不断增殖的细胞从一次分裂完成到下一次分裂结束所经历的整个过程。它涵盖了一系列高度有序和调控的事件,导致真核细胞的繁殖。在形态上,它被分为间期和有丝分裂(M期)。间期包括第一生长(G1)、DNA合成(S)和第二生长(G2)阶段。
G1期是一个调控期,在此期间一系列事件决定细胞是继续分裂还是退出细胞周期(进入静止(G0)期)。在G1晚期,细胞开始合成进入S期所需的mRNA、蛋白质和酶。在S期,DNA完成复制,染色体在着丝粒处连接两个姐妹染色单体。G2期是细胞分裂的最后准备阶段。中心粒已经复制,形成两个中心体。还合成了RNA和微管蛋白。M期包括染色体分离、核分裂和细胞分裂。产生了两个遗传相同的子细胞。对M期的严格控制对于成功完成姐妹染色单体分离和细胞分裂至关重要。
2. 什么是细胞周期标记物?
在完整的细胞周期内,细胞周期素依赖性激酶(CDK)通过细胞周期素的激活,磷酸化相关蛋白质,导致其他蛋白质的激活和降解,从而实现一个细胞周期中不同阶段之间的正确过渡。在特定细胞周期阶段激活或降解的蛋白质被称为细胞周期标记物。它们可以评估细胞周期的进展和细胞周期阶段的分布。
3. 细胞周期标记物家族成员及其功能
细胞周期标记物负责调控和维持真核细胞的细胞周期。它们包括E2F转录因子、细胞周期素依赖性激酶(CDKs)、细胞周期素、微染色体维持(MCM)蛋白、增殖细胞核抗原(PCNA)、细胞分裂周期25(Cdc25)蛋白和Geminin。Cyclin D-Cdk4/Cdk6在G1早期调控事件;cyclin E-Cdk2触发S期;MCM蛋白对启动DNA复制至关重要;cyclin A-Cdk2和cyclin A-Cdk1调节S期的完成;所有三个Cdc25蛋白在有丝分裂期间发挥作用;Cdk1-cyclin B负责有丝分裂。
G1到S期
在哺乳动物细胞中,口袋蛋白视网膜母细胞(RB)蛋白、p107和p130与E2F转录因子结合,从而在早期G1期抑制转录。E2F1、E2F2和E2F3在G1期与RB结合 [1]。E2F4和E2F5在静止期(G0期)与p130结合,而在G1期与p107和p130结合。E2F6、E2F7和E2F8的抑制作用与口袋蛋白无关。当细胞转向S期时,E2F6累积并与目标启动子结合,抑制转录。
有丝分裂原刺激Erk依赖性激活基因调节蛋白Myc,增加了基因表达,包括Cyclin D、SCF亚基基因和E2F基因。Cyclin D对G1/S细胞周期转换至关重要。Cyclin D1与Cdk4或Cdk6形成复合物,导致Rb磷酸化。上调SCF亚基基因的转录促进CKI蛋白p27的降解,从而增加cyclin E-Cdk2的活性 [2]。磷酸化的RB变得不活跃,导致E2F蛋白的解离,从而诱导参与G1-S转变的基因表达,包括c-Myc、cyclin D1、cyclin A、cyclin E、p21、Cdk2、Cdc2、PNCA和Cdc25C。RB在M期之前保持不活跃,直到被pp1型磷酸酶去磷酸化。Cyclin E-Cdk2和cyclin A/Cdk2磷酸化RB,强化正反馈环。在G1晚期,Cdc25A表达高度增加,激活cyclin D/Cdk4/6和cyclin E/Cdk2,加速G1/S转变 [3]。
微小染色体维持(MCM)是最早在酵母中发现的高度保守的蛋白质家族。MCM蛋白是必需的DNA复制因子,在真核细胞的一个细胞周期内仅启动一次DNA复制 [2]。在早期G1期,DNA复制许可因子细胞分裂周期6(Cdc6)和染色质许可和DNA复制因子1(Cdt1)通过ORC(ORC1-6)被招募到复制起始点,然后将MCM2-7六聚体装载到染色质上,形成“许可”(L)预复制复合物(pre-RC) [2] [4] [5]。Geminin是DNA许可抑制因子,是从G1期向S期转变的初始信号。在S期的初始阶段,Geminin开始在细胞核中积累。随着细胞周期的推进,Geminin通过与Cdt1结合干扰预-RC的稳定性,并防止MCM加载到染色体上,从而导致DNA复制启动终止。它在G2期积累并在M期达到峰值,在解旋酶活性复杂(APC)活性在解相期间增强时,诱导了Geminin基因的“破坏盒”突变,然后在下一个G1期之前降解。在G1晚期,MCM复合物的解旋酶活性由Cdc45/MCM2-7/GINS复合物激活。在S期,激活的MCM复合物在起始点解开双链DNA,招募DNA聚合酶(Polε和Polδ),并启动DNA合成。在S期,cyclin A/Cdk2活性 [5]。
增殖细胞核抗原(PCNA)对DNA复制和修复至关重要。作为DNA pol δ/ɛ的辅因子,它在DNA合成和Okazaki片段成熟中发挥作用。它在晚期G1期诱导表达,S期达到峰值,此后减少。PCNA广泛用作S期的标记物 [6] [7]。
在高等真核细胞中存在三种Cdc25磷酸酶:Cdc25A、Cdc25B和Cdc25C。Cdc25A主要功能是调节G1/S转变 [8]。Cdc25B作为有丝分裂的起始者,Cdc25C协助通过去磷酸化cyclin B/Cdk1促使细胞进入有丝分裂 [3] [9] [10]。
S到G2期
Cyclin A2调节S/G2转变,还参与有丝分裂的进入 [11]。它在S、G2和早期M期存在。Cyclin A2-Cdk2在G2期发挥了启动有丝分裂激酶PLK1激活的作用。在G2晚期,Cyclin A2-Cdk1和Cyclin B-Cdk1可以通过磷酸化Bora进一步增加PLK1的活性,最终导致对M期的承诺,并保护Bora免受SCF依赖性降解 [12] [13]。
G2到M期
G2到M期的进展是增殖细胞生命周期中最显著的形态和生理变化。Cyclin B/Cdk1复合物对G2到M期的转变至关重要。在哺乳动物中有三个亚型:B1、B2和B3。中心体相关的检查点激酶1(CHK1)磷酸化Cdc25B,引发cyclin B/Cdk1活性,并调节G2-M转变中的中心丝微管核化 [9]。Cdc25A通过去磷酸化Cdk4、Cdk6以及Cdk2和Cdk1,更广泛地协助G1/S和G2/M进程。
在哺乳动物中有三个亚型的Cyclin B:B1、B2和B3。Cyclin B1与Cdk1形成M期促进因子(MPF)复合物,其表达在G2晚期达到峰值。Cdc25C刺激cyclin B1/Cdk1活性,促进G2/M转变 [9]。Cyclin B1在有丝分裂中期迅速降解并消失。与此同时,细胞退出M期并进入下一个细胞周期。Cyclin B2-Cdk1在间期与高尔基体结合,可能在有丝分裂期间发挥高尔基体解体的作用。
Aurora A/B和PLK1在S期积累,并在G2/M期达到峰值,然后在有丝分裂结束时迅速降解 [14]。
组蛋白H3是Aurora激酶的底物,仅在有丝分裂期磷酸化丝氨酸10位。随着细胞周期的推进,H3S10PH在中期达到峰值,并延伸到染色体的所有部分。当细胞有丝分裂进入解相期和末相期时,H3S10PH将出现在纺锤体的中央部分,直到有丝分裂结束和H3S10PH的去磷酸化发生。这意味着H3S10PH在整个M期持续存在,并在M期的染色体聚合和分离中起重要作用。由于H3S10PH与细胞周期的G2晚期到M期显著相关,因此在一些针对肿瘤细胞有丝分裂期的研究中,它已被用作M期的特异性标记物。
4. 细胞周期标记物在肿瘤中的应用
细胞周期是一个严密调控的过程,影响着所有真核细胞的生长、发育和复制。细胞周期的失调与许多疾病,特别是癌症有关。正常细胞中的癌变变化可能来自异常的DNA复制和DNA修复机制。因此,一些细胞周期标记物在肿瘤的诊断和预后评估中具有重要的应用前景。
由于MCM蛋白在增殖细胞的基因组复制中起重要作用,其功能的失调会导致染色体缺陷,可能有助于肿瘤发生。G1到S转换的准确进行对于真核细胞的增殖至关重要。G1进展的失调在癌症中经常发生。MCM3是DNA复制起始的不可或缺的因子,在确保每个细胞周期只启动一次精确DNA复制方面发挥重要作用。MCM5的高表达在多种人类肿瘤中发现,如宫颈癌、皮肤癌和胰腺癌。
Cyclin A和E可能是人类癌症诊断和预后的标记物。Cyclin A1是高度在急性髓系白血病和睾丸癌中表达的组织特异性细胞周期蛋白。Cyclin A2与细胞增殖相关,可以作为增殖标记物的分子诊断。此外,Cyclin A2表达与多种类型的癌症相关的不良预后。Cyclin E的高水平在许多类型的癌症中发现。Cyclin E的过度表达不仅与增殖有关,而且与更恶性的表型相关,可能与诱导染色体不稳定性有关。当发现高Cyclin E水平时,这些生物学功能与不良预后相关。Cyclin E和不良预后之间的联系在乳腺癌和肺癌中得到了充分证实,但可能也会在其他癌症中观察到 [16]。
Cdc25A过表达在多种癌细胞系中频繁报道,与恶性和癌症患者的不良预后密切相关 [8]。
5. 细胞周期标记物相关产品
越来越多的研究关注细胞周期标记物,因为它们在肿瘤进展和预后评估中具有重要作用。对细胞周期标记物相关产品的需求也在增加。CUSABIO一直致力于为广大学者和科研机构提供高质量的科研产品。以下是与细胞周期标记物相关的产品列表。
| 细胞周期标记物 | 产品 |
|---|---|
| E2F转录因子 | E2F1 |
| E2F2 | |
| E2F3 | |
| E2F4 | |
| E2F5 | |
| E2F6 | |
| E2F7 | |
| E2F8 | |
| 细胞周期蛋白 | cyclin A1 |
| cyclin A2 | |
| cyclin B1 | |
| cyclin B2 | |
| cyclin B3 | |
| cyclin D1 | |
| cyclin D2 | |
| cyclin D3 | |
| cyclin E1 | |
| cyclin E2 | |
| cyclin E | |
| 蛋白激酶 | Cdk1 |
| Cdk2 | |
| Cdk4 | |
| Cdk6 | |
| PLK1 | PLK1 |
| 细胞周期标记物 | 产品 |
|---|---|
| MCM | MCM2 |
| MCM3 | |
| MCM4 | |
| MCM5 | |
| MCM6 | |
| MCM7 | |
| MCM10 | |
| Cdc25 | Cdc25A |
| Cdc25B | |
| Cdc25C | |
| ORC | ORC1 |
| ORC2 | |
| ORC3 | |
| ORC4 | |
| ORC5 | |
| ORC6 | |
| Cdc6 | Cdc6 |
| Cdc45 | Cdc45 |
| Cdt1 | Cdt1 |
| Geminin | Geminin |
| PCNA | PCNA |
| Aurora A | Aurora A |
| Aurora B | Aurora B |
| H3S10PH | H3S10PH |
参考文献:
[1] Cosetta Bertoli, Jan M. Skotheim, et al. Control of cell cycle transcription during G1 and S phases [J]. Nat Rev Mol Cell Biol. 2013 Aug; 14(8): 518–528.
[2] Qian Wei, Junhui Li, et al. Phosphorylation of Minichromosome Maintenance Protein 7 (MCM7) by Cyclin/Cyclin-dependent Kinase Affects Its Function in Cell Cycle Regulation [J]. CELL BIOLOGY VOLUME 288, ISSUE 27, P19715-19725, JULY 05, 2013.
[3] Swastika Sur and Devendra K. Agrawal. Phosphatases and Kinases Regulating CDC25 Activity in the Cell Cycle: Clinical Implications of CDC25 Overexpression and Potential Treatment Strategies [J]. Mol Cell Biochem. 2016 May; 416(1-2): 33–46.
[4] Zheng Li and Xingzhi Xu. Post-Translational Modifications of the Mini-Chromosome Maintenance Proteins in DNA Replication [J]. Genes 2019, 10(5), 331.
[5] M Loddo, S R Kingsbury, et al. Cell-cycle-phase progression analysis identifies unique phenotypes of major prognostic and predictive significance in breast cancer [J]. British Journal of Cancer volume 100, pages959–970(2009).
[6] Emily Ming-Chieh Lu, Jithendra Ratnayake, et al. Assessment of proliferating cell nuclear antigen (PCNA) expression at the invading front of oral squamous cell carcinoma [J]. BMC Oral Health volume 19, Article number: 233 (2019).
[7] Wojciech Strzalka and Alicja Ziemienowicz. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation [J]. Ann Bot. 2011 May; 107(7): 1127–1140.
[8] Tao Shen and Shile Huang. The role of Cdc25A in the regulation of cell proliferation and apoptosis [J]. Anticancer Agents Med Chem. 2012 Jul; 12(6): 631–639.
[9] Estelle Schmitt, Rose Boutros, et al. CHK1 phosphorylates CDC25B during the cell cycle in the absence of DNA damage [J]. Journal of Cell Science 2006 119: 4269-4275.
[10] Kai Liu, Minying Zheng, et al. The role of CDC25C in cell cycle regulation and clinical cancer therapy: a systematic review [J]. Cancer Cell International volume 20, Article number: 213 (2020).
[11] Helena Silva Cascales, Kamila Burdova, et al. Cyclin A2 localises in the cytoplasm at the S/G2 transition to activate PLK1 [J]. Life Sci Alliance. 2021 Jan 5;4(3):e202000980.
[12] Gheghiani, L., D. Loew, B. Lombard, et al. PLK1 Activation in Late G2 Sets Up Commitment to Mitosis [J]. Cell Rep. 2017, 19:2060– 2073.
[13] Tavernier, N., A. Noatynska, C. Panbianco, et al. Cdk1 phosphorylates SPAT-1/Bora to trigger PLK-1 activation and drive mitotic entry in C. elegans embryos [J]. J. Cell Biol. 2015, 208:661–669.
[14] Kulkarni AA, Loddo M, et al. DNA replication licensing factors and aurora kinases are linked to aneuploidy and clinical outcome in epithelial ovarian carcinoma [J]. Clin Cancer Res 2007, 13: 6153–6161.
[15] Crosio C, Fimia GM, et al. Mitotic phosphorylation of histone H3: spatio-temporal regulation by mammalian Aurora kinases P [J]. Mol Cell Biol 2002, 22: 874–885.
[16] Amber Yasmeen, Wolfgang E Berdel, et al. E- and A-type cyclins as markers for cancer diagnosis and prognosis [J]. Expert Rev Mol Diagn. 2003 Sep;3(5):617-33.