什么是组蛋白?揭示其在疾病发病机制中的关键作用
日期:2024-02-05 14:27:43
组蛋白是一类基本的蛋白质,在真核细胞的细胞核内在DNA的包装、组织和调控中起着至关重要的作用。它们构成染色质的基本结构,这是DNA包裹其中的复杂结构,使遗传信息能够高效存储和传递。
理解组蛋白的组成、结构和功能,为我们提供了对这些蛋白质与DNA之间错综复杂关系的宝贵洞见,阐明了正常细胞过程和疾病状态(如癌症)之间的关系。
在本文中,我们将更详细地了解组蛋白。我们将看看组蛋白是什么,它们的分类是什么,组蛋白的结构如何支持其功能,以及组蛋白如何导致疾病。
1. 什么是组蛋白?
组蛋白最初是从禽类红细胞中分离出来的,并由Albrecht Kossel于1884年描述。组蛋白是存在于所有真核细胞染色质中的DNA结合蛋白。组蛋白含有丰富的碱性氨基酸精氨酸和赖氨酸,赋予它们正电荷,使其能够与带有负电荷的DNA紧密结合,促进核小体的形成,促使染色质紧缩。
组蛋白具有球状的核心结构和无结构的N-末端尾部。核心结构有助于组装组蛋白八聚体,而N-末端尾部从核小体中延伸出来,并经历各种翻译后修饰(PTMs),包括乙酰化、甲基化、泛素化、磷酸化等。这个无结构的区域提供了灵活性,并允许各种修饰来调节染色质结构和基因表达 [1]。核心结构包含组蛋白折叠,这是一个三螺旋束,允许蛋白质-蛋白质相互作用、DNA结合和染色质紧缩 [2]。
2. 组蛋白的分类
组蛋白主要分为五类:H2A、H2B、H3和H4(核心组蛋白)以及连接组蛋白:H1 / H5 [3]。 H2A、H2B、H3和H4组蛋白形成核小体的核心,并积极参与DNA的精确包裹。连接组蛋白H1与两个核小体之间的DNA连接区域相关联,促使大量核小体构建成更高阶的染色质结构。 H1在物种之间变化很大。作为H1的变体,H5是禽类红细胞中的主要连接组蛋白。
| 超家族 | 家族 | 定位和功能 | 亚族 | 成员 |
|---|---|---|---|---|
| Linker | H1 | 在连接线上;与染色质纤维中的核小体和连接体-DNA 结合 | H1F | H1F0, H1FNT, H1FOO, H1FX |
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | |||
| Core | H2A | 核心颗粒;参与核小体的形成 | H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ |
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI,HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | |||
| H2A2 | HIST2H2AA3, HIST2H2AC | |||
| H2B | 核心颗粒;参与核小体的形成 | H2BF | H2BFM, H2BFS, H2BFWT | |
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG,HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | |||
| H2B2 | HIST2H2BE | |||
| H3 | 核心颗粒;参与核小体的形成 | H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | |
| H3A2 | HIST2H3C | |||
| H3A3 | HIST3H3 | |||
| H4 | 核心颗粒;参与核糖体的形成 | H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | |
| H44 | HIST4H4 |
3. 组蛋白的功能
在细胞核中,组蛋白主要负责压实 DNA 链并形成核小体,而核小体是染色质的基本组成部分 [4]。通过将 DNA 包裹在组蛋白的八聚体上,组蛋白可以有效地储存遗传物质,并保护其免受损伤。
组蛋白还参与基因表达的调控。对组蛋白的修饰,如乙酰化、甲基化、磷酸化和泛素化,就像表观遗传密码一样,为不同的调控过程标记基因组的特定区域。它们可以促进或抑制参与基因调控的蛋白质的结合,影响 DNA 与转录因子和其他调控蛋白质的可及性,并影响基因表达模式 [5]。
例如,组蛋白的乙酰化通常与开放的染色质和活跃的基因转录有关,而甲基化则可产生激活或抑制作用,具体取决于特定的氨基酸和甲基化程度。
大量证据表明,组蛋白修饰几乎参与了所有基于 DNA 的过程,包括基因转录、DNA 复制、DNA 损伤修复和 DNA 重组 [6-10]。
组蛋白修饰有助于表观遗传调控。组蛋白修饰与 DNA 甲基化等其他表观遗传标记一起,参与建立和维持这些基因表达模式。
在细胞表面,组蛋白可促进细胞介导的凋亡、神经发生、迁移和内吞。此外,新的研究表明,组蛋白被释放到细胞外空间,在体内和体外,组蛋白在细胞外空间发挥显著的毒性或促炎活性 [11][12]。
4. 组蛋白相关疾病
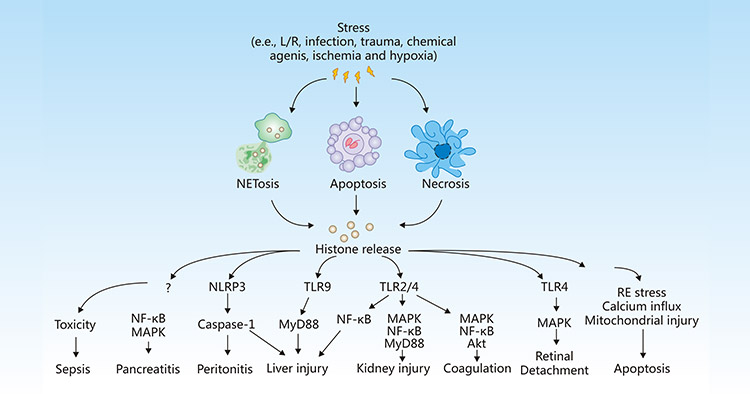
组蛋白是真核染色质的基本结构蛋白。然而,在炎症、感染、缺血、缺氧等应激条件下,细胞可能发生凋亡、坏死或NETosis,从而导致组蛋白释放到细胞外空间,组蛋白可激活免疫和炎症反应,引发或加重组织损伤,或介导各种疾病的发生和发展,包括败血症、胰腺炎、腹膜炎、肝损伤、肾损伤、凝血、脱落和细胞凋亡等
Figure 1:Release and activity of histones in response to stress
The picture is cited from https://www.nature.com/articles/cddis2014337
在败血症期间,大量释放促炎因子TNF-α和IL-6,触发组蛋白大量流出到细胞外空间,从而导致内皮功能障碍、器官衰竭和死亡 [12]。
Kang R等人表明,细胞外组蛋白介导的HMGB1释放在激活的免疫细胞中对L-精氨酸诱导的HMGB1胰腺条件敲除小鼠急性胰腺炎中起作用 [13]。
细胞外组蛋白能够激活NLRP3炎性小体,间接诱导细胞坏死产生局部细胞因子,从而导致腹膜炎 [14]。
一旦释放,组蛋白选择性地结合到TLRs,包括TLR-2、TLR-4和TLR9,产生促炎细胞因子,增强肝脏 [15][16]、肾脏 [17]、肺部 [18]和大脑中的炎症反应和组织损伤。诱导的TLR2和TLR4信号通路还促进血小板激活、血液凝结、von Willebrand因子水平增加,并加速深静脉血栓早期发生 [19]。
Kawano H等人揭示了在视网膜脱离(RD)中受损视网膜释放的组蛋白可能通过诱导视网膜色素上皮(RPE)细胞的炎症和细胞死亡,恶化亚视网膜微环境的状况 [20]。
来自NETosis的组蛋白已经涉及多种自身免疫和自身炎症性疾病,如全身性红斑狼疮、类风湿性关节炎和小血管炎。
细胞外组蛋白和组蛋白修饰也与神经系统疾病的发病机制相关,包括缺血再灌注损伤、组蛋白修饰介导的转录障碍和胶质细胞反应性增生。
此外,已经在不同类型的癌症中鉴定了编码组蛋白或其修饰酶的基因突变,突显了它们在肿瘤发展中的重要性。这些突变可以影响核小体的稳定性,破坏基因表达的调控,并促使肿瘤发生。特别是组蛋白修饰酶的失调表达已经与组蛋白修饰机器的破坏强烈相关,最终导致癌症的发生、发展和转移。
例如,转录因子FOXA1通过调控H3K27ac来组织广泛的增强子重编程,从而促进胰腺癌(PC)的发展。在肝细胞癌(HCC)中,RARRES3基因启动子区域中H3K9me2的上调抑制了其转录,从而促进癌细胞迁移。组蛋白修饰已被探索作为癌症中潜在的诊断和预后标志,有助于个性化治疗策略的制定。
总之,组蛋白是DNA的神秘守护者,组织其包装、调控和传递。它们的组成、结构和修饰允许对染色质结构和基因表达的精确控制。理解组蛋白与DNA之间错综复杂的关系为正常细胞过程和疾病状态,尤其是癌症,提供了宝贵的见解。对组蛋白生物学的进一步探索有望揭示新的治疗靶点,并推动个性化治疗方法的进步,为患有癌症和其他疾病的患者提供改善预后的希望。
参考文献:
[1] Peterson CL, Laniel MA. Histories and histone modifications [J]. Curr Biol. 2004;14(14):R546–R551.
[2] Arents G, Moudrianakis EN. The histone fold: a ubiquitous architectural motif utilized in DNA compaction and protein dimerization [J]. Proc Natl Acad Sci USA. 1995;92(24):11170–11174.
[3] Bhasin M, Reinherz EL, et al. Recognition and classification of histones using support vector machine [J]. J Comput Biol. 2006 Jan-Feb;13(1):102-12.
[4] Campos EI, Reinberg D. Histones: annotating chromatin [J]. Annu Rev Genet 2009; 43: 559–599.
[5] Carlberg C., Molnár F. The Histone Code. In: Human Epigenomics. Springer, Singapore, 2018.
[6] Shilatifard A. Chromatin modifications by methylation and ubiquitination: implications in the regulation of gene expression [J]. Annu. Rev. Biochem 2006, 75, 243–269.
[7] Li B, Carey M, et al. The role of chromatin during transcription [J]. Cell 2007, 128, 707–719.
[8] Unnikrishnan A, Gafken PR, et al. Dynamic changes in histone acetylation regulate origins of DNA replication [J]. Nat. Struct. Mol. Biol 2010, 17, 430–437.
[9] Jacob Y, Stroud H, et al. Regulation of heterochromatic DNA replication by histone H3 lysine 27 methyltransferases [J]. Nature 2010, 466, 987–991.
[10] Scully R. A histone code for DNA repair [J]. Nat. Rev. Mol. Cell. Biol 2010, 11, 164.
[11] Allam R, Kumar SV, et al. Extracellular histones in tissue injury and inflammation [J]. J Mol Med (Berl) 2014; 92: 465–472.
[12] Xu J, Zhang X, et al. Extracellular histones are major mediators of death in sepsis [J]. Nat Med 2009; 15: 1318–1321.
[13] Kang R, Zhang Q, et al. Intracellular Hmgb1 Inhibits Inflammatory Nucleosome Release and Limits Acute Pancreatitis in Mice [J]. Gastroenterology 2014; 146: 1097–1107.
[14] Allam, R., Darisipudi, M. N., et al. Histones trigger sterile inflammation by activating the NLRP3 inflammasome [J]. Eur. J. Immunol. 2013, 43, 3336–3342.
[15] Huang H, Evankovich J, et al. Endogenous histones function as alarmins in sterile inflammatory liver injury through Toll-like receptor 9 in mice [J]. Hepatology 2011; 54: 999–1008.
[16] Wen Z, Liu Y, et al. Circulating histones exacerbate inflammation in mice with acute liver failure [J]. J Cell Biochem 2013; 114: 2384–2391.
[17] Allam R, Scherbaum CR, et al. Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4[J]. J Am Soc Nephrol 2012; 23: 1375–1388.
[18] Bosmann M, Grailer JJ, et al. Extracellular histones are essential effectors of C5aR-and C5L2-mediated tissue damage and inflammation in acute lung injury[J]. Faseb J 2013; 27: 5010–5021.
[19] Carestia A, Rivadeneyra L, et al. Functional responses and molecular mechanisms involved in histone-mediated platelet activation [J]. Thromb Haemost 2013; 110: 1035–1045.
[20] Kawano H, Ito T, et al. Toxic effects of extracellular histones and their neutralization by vitreous in retinal detachment [J] Lab Invest 2014; 94: 569–585.
下一篇: 组蛋白去甲基化酶:LSD和JmjC家族