胶质纤维酸性蛋白-胶质细胞特异性标记物
日期:2023-11-28 08:35:00
胶质纤维酸性蛋白(Glial fibrillary acidic protein, GFAP)属于III类中间丝(intermediate filament, IFs),特异性表达于中枢神经系统星形胶质细胞(central nervous system astrocytes, AS)的细胞质中。作为一种星形胶质细胞特异性标记物。它与微管、微丝共同构成大多数真核细胞的细胞骨架,为其他细胞或细胞外基质接触的质膜提供机械支持,维持星形胶质细胞形态稳定,参与血脑屏障形成,调节突触功能等多种生物学功能。此外,GFAP还参与细胞的迁移、运动和有丝分裂。
图1. 星形胶质细胞
1. GFAP的发现历史
最早在多发性硬化症(MS)患者的大脑中发现了胶质纤维酸性蛋白(GFAP)[1]。1969年首次提出了GFAP的氨基酸(AA)组成 [2]。在1984年,首次克隆了小鼠GFAP基因,这是GFAP分子生物学研究的起点。在1989年,人类GFAP基因被克隆 [3]。
2. GFAP的组织特异性
胶质纤维酸性蛋白(GFAP)是第三类中间丝,在中枢神经系统的星形胶质细胞、外周神经系统的非髓鞘雪旺细胞以及成熟的肠胶质细胞(EGCs)中存在 [4]。此外,GFAP还在软骨细胞、成纤维细胞、肌上皮细胞、淋巴细胞和肝星形胶质细胞中表达。
然而,一些研究表明,外周系统表达的GFAP可能在结构上与中枢神经系统表达的GFAP有所不同。
3. GFAP基因
人类GFAP基因位于17q21染色体上,包含8个内含子和9个外显子,以及2个选择性内含子DNA和4个选择性外显子DNA,以促进形成大小约为10 kb的DNA片段,由它产生的成熟mRNA大小约为3 kb。
人类GFAP基因与小鼠和大鼠的基因编码区高度同源 [5]。
GFAP基因具有选择性剪接 [6],导致产生编码不同亚型蛋白的多个转录变体。
已知在小鼠和人类的神经系统中表达了十个GFAP剪接异构体。在小鼠大脑中表达的异构体包括GFAPα、β、γ、δ、ζ、κ和∆外显子7,而在人类大脑中表达的异构体包括GFAPα、β、δ、ζ、κ、∆135、∆164、∆外显子6和∆外显子7 [7]。最丰富的亚型是GFAPα。
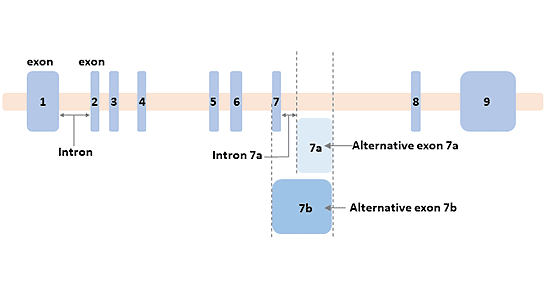
图2. GFAP基因的结构
4. GFAP蛋白
GFAP是一种酸性蛋白,由432个氨基酸组成,相对分子量为5052KD,等电点为5.7-5.8。
GFAP是AS的重要骨架蛋白。星形胶质细胞的细胞骨架是由大量GFAP单体聚合形成的。
GFAP单体聚合形成聚合物,成为细胞中间丝(IFs)的一个组成部分。IFs属于III型IFs超家族,与波形蛋白、肌动蛋白和周蛋白等相同,在它们之间有70%以上的同源性。
所有类型的IFs蛋白都包含三个主要结构域:氨基端、中心螺旋棒和羧基端尾域。
IF蛋白的棒状域(310 - 350个氨基酸残基)高度保守,而头域和尾域的大小和氨基酸序列在不同物种之间高度多态。
GFAP的不同结构域以不同方式参与了IFs的形成。
GFAP蛋白通过棒状域形成二聚体和四聚体。
至于III型IF蛋白的尾域,目前认为它可以在体外稳定原丝亚单元的相互作用,控制丝的宽度,从而在体内形成适当的IF网络。
5. GFAP的表达调控
GFAP的表达受多种因素影响(如脑损伤和疾病),并在昼夜周期内波动。GFAP基因表达受到GFAP启动子的调控。基础启动子对于正确的转录至关重要,启动子上的其他元素确定了表达的特异性。TATA-box是碱基启动子的一个重要元件,是与一般转录因子IID (TFIID)结合所必需的。
GFAP也受到多种翻译后修饰的影响,包括磷酸化和去磷酸化。这些修饰对其结构和性质有重要影响。
在GFAP头区的特定氨基酸残基的磷酸化和去磷酸化参与了GFAP组装的调控,这对GFAP在细胞周期中的重分布很重要。这些磷酸化的氨基酸残基通常是保守的。除了磷酸化外,其他翻译后修饰如糖基化和脲基化也影响了GFAP的结构和性质。
GFAP基因的表达和修饰影响星形胶质细胞的功能:GFAP基因的初始激活表明星形胶质细胞的分化,其上调通常伴随着对中枢神经系统损伤的反应。
6. GFAP的功能
星形胶质细胞是大脑中最丰富的细胞类型。它们为神经元提供结构和功能支持(包括神经递质谷氨酸和营养因子的释放),在神经生理活动、神经组织再生和免疫以及各种神经系统疾病的发生中发挥重要作用。
胶质纤维酸性蛋白在星形胶质细胞中充当主要的细胞骨架蛋白。GFAP形成细胞核与细胞膜之间的连接,参与细胞内的细胞骨架重组、细胞粘附、维持脑部髓鞘的形成和神经元结构,以及参与细胞信号转导途径 [8] [9],还参与细胞迁移、运动和有丝分裂。胶质纤维酸性蛋白可以维持星形胶质细胞的稳定形态,参与血脑屏障的形成和调节突触功能。
GFAP的具体功能如下:
6.1 迁移和运动
GFAP参与细胞运动和迁移,但其对不同星形胶质亚型的正常生理或病理功能的贡献尚不清楚。转染胶质瘤细胞系U1242 MG和U251 MG的载体系统,诱导GFAP表达,表明GFAP在细胞运动中发挥作用。研究表明,强制表达GFAP会抑制细胞运动。
在与亚历山大病相关的突变GFAP的研究中,关于GFAP在运动中的作用有更多的证据。与转染了野生型GFAPα或在GFAP尾域发生突变的突变GFAPα的细胞相比,转染了GFAP杆状域中两个突变GFAP(V87G和R88C)的突变胶质瘤细胞表现出了增强的运动能力。
6.2 增殖
许多研究表明,GFAP表达的改变会改变星形胶质细胞的增殖能力或其他转化特征。GFAP表达水平与增殖水平呈负相关[10]。与野生型小鼠相比,来自GFAP-/-小鼠的初级星形胶质细胞的增殖增强。
6.3 囊泡运输和自噬
星形胶质细胞释放多种胶质转导体,包括经典转导体、肽类、趋化因子和细胞因子。
胞外排泄是星形胶质细胞将物质从囊泡释放出来的方式之一。在这个过程中,囊泡沿着细胞骨架被运输到质膜并与质膜融合。
细胞骨架的普遍解聚会影响星形胶质细胞中囊泡的定向迁移。细胞骨架的破坏会降低囊泡的线性长度,减少囊泡的流动性。
6.4 星形胶质细胞与神经元的相互作用
星形胶质细胞参与多种神经元功能,包括突触形成和可塑性、能量和氧化还原代谢,以及神经递质和离子的突触稳态。
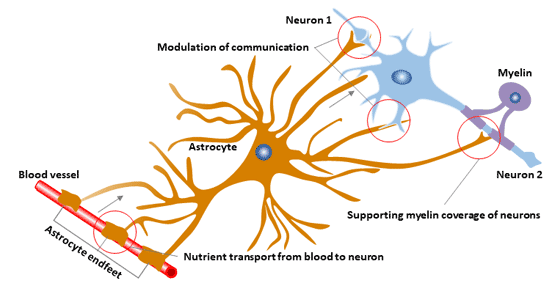
图3. 星形胶质细胞的功能
6.5 血脑屏障与髓鞘生成
血脑屏障(BBB)由毛细血管内皮细胞形成,并被基底层和血管周围的星形胶质细胞所包围。
在小鼠模型中,突变小鼠的BBB包含少数星形胶质细胞的单层,与野生型小鼠相比其渗透性更高。GFAP-/-小鼠还显示出中枢神经系统髓鞘生成延迟,年龄较大的小鼠白质损失以及脑积水。
7. GFAP相关信号通路
在Jak-STAT信号通路中,通过调控GFAP的表达,它控制细胞分化并调节细胞周期。信号图如下所示:
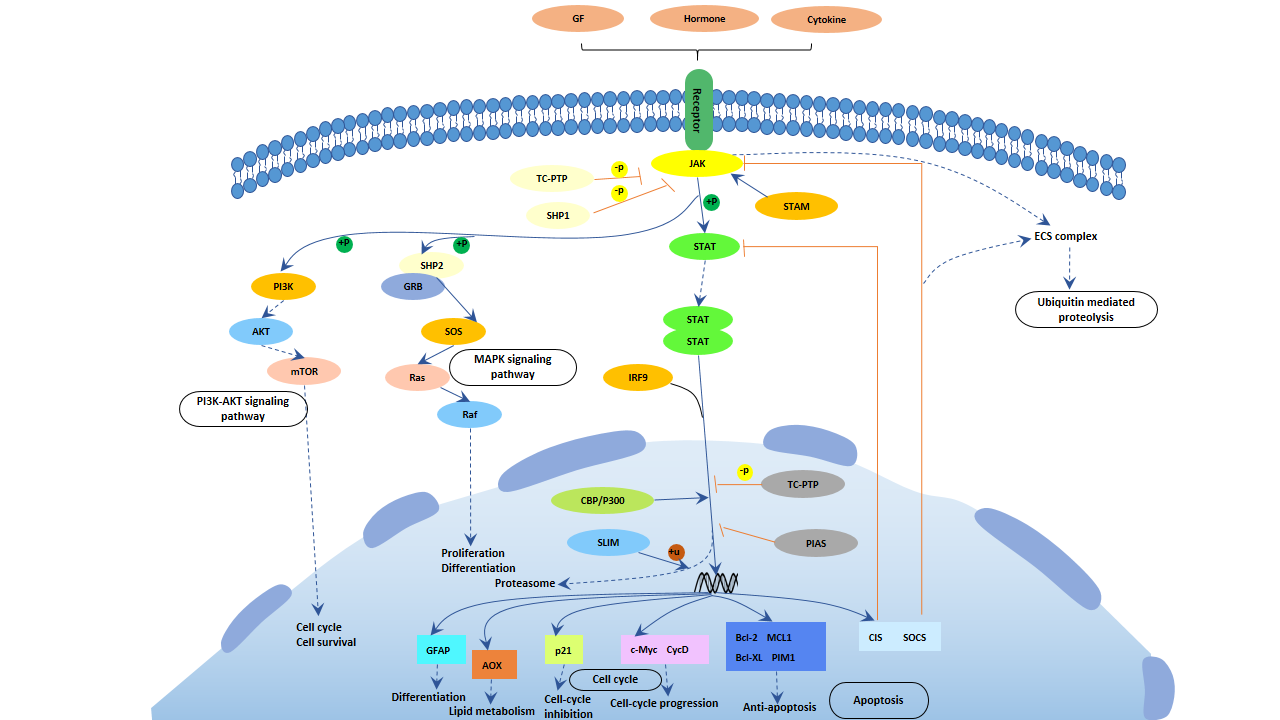
图4. Jak-STAT信号通路
8. GFAP与疾病之间的关系
星形胶质细胞参与了多种中枢神经系统疾病,包括外伤、缺血以及神经退行性疾病。
GFAP的mRNA和蛋白水平在多种疾病中升高。这些疾病主要包括:阿尔茨海默病、疯牛病和克雅氏病。在包括脑血管事故、刺伤和其他损伤以及实验性过敏性脑脊髓炎等中枢神经系统损伤中,GFAP的表达也会增加。
8.1 阿尔茨海默病
星形胶质细胞疾病是阿尔茨海默病(AD)的显著神经病理学变化,AD病理的严重程度与反应性星形胶质细胞的密度以及组织和脑脊液中GFAP表达的强烈上调相关。
阿尔茨海默患者的海马区受星形胶质细胞疾病的影响比其他老年脑部的海马区更严重。GFAP mRNA水平与AD患者额叶皮层中神经元斑块的密度之间存在强烈相关性。
8.2 抑郁症
星形胶质细胞在建立和维护血脑屏障方面发挥重要作用。它们可以控制可溶性分子和有害物质的运动,调节脑内稳态,调节神经元功能,并促进成年后的神经发生。因此,星形胶质细胞的功能障碍可能会影响抑郁症的病理过程。
研究发现,在精神分裂症、双相情感障碍和抑郁症中,GFAP的表达较低。GFAP在抑郁症发作期间参与了多种神经递质的调节。
8.3 亚历山大病(AxD)
亚历山大病的发生与GFAP基因突变有关。GFAP基因突变导致GFAP组装的变化,导致GFAP的积累和细胞内的病理性沉积。
亚历山大病属于中枢神经系统变性疾病,是一种遗传病。
该疾病特点是婴儿期逐渐出现的肌无力,伴有逐渐发展的痉挛和精神障碍。
Messing等人提出了靶向治疗方法,可以防止GFAP聚集和病理性沉积,提高GFAP的蛋白酶体清除速率。
研究表明,反义寡核苷酸抑制GFAP可能为亚历山大病的治疗提供了治疗策略。
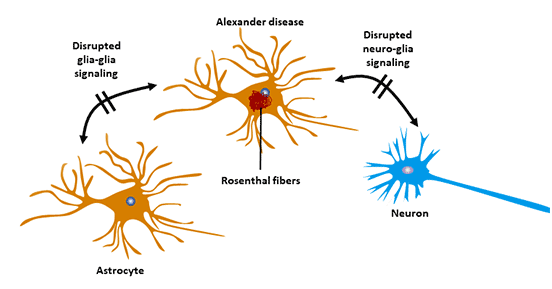
图5. 星形胶质细胞与亚历山大氏病
9. GFAP在诊断中的应用
在正常情况下,GFAP会自发地在细胞内或细胞外降解,血液中的GFAP水平相对稳定。在病理情况下,当患者的中枢神经系统受伤、星形胶质细胞受损或死亡时,GFAP聚合物会分解并分解,从受伤的星形胶质细胞泄漏到周围的细胞间隙,并通过血脑屏障进入血液,从而提高血液中的GFAP水平。
因此,GFAP的体液水平是评估星形胶质细胞增生和激活的重要手段,间接反映了神经损伤的程度。
9.1 脑外伤
在脑外伤后,星形胶质细胞经常出现增生,这是由变性疾病和中枢神经系统损伤引起的神经变化的主要表现。 S100β蛋白和胶质纤维酸性蛋白是两种主要的胶质细胞标记蛋白 [14]。与NSE和S100β蛋白相比,GFAP在出血性脑外伤患者的血清中具有更早的高峰时间,更强的特异性和更高的敏感性 [15]。
9.2 脑卒中
早期、快速、准确地诊断脑卒中对于其治疗和预后具有积极的影响。
GFAP已被广泛研究作为反映脑损伤的新型标志物。急性缺血性卒中患者的血浆GFAP水平升高。血浆GFAP水平在急性缺血性卒中患者中增加。血浆GFAP水平的测量可以反映急性缺血性卒中患者中中枢神经细胞的损伤和死亡。GFAP水平与脑梗死区域相关 [16]。
GFAP重组蛋白
Recombinant Human Glial fibrillary acidic protein(GFAP) (CSB-EP009369HU)
Recombinant Mouse Glial fibrillary acidic protein(Gfap) (CSB-EP009369MOb1)
Recombinant Rat Glial fibrillary acidic protein(Gfap) (CSB-EP009369RAa0)
GFAP ELISA kit
Human glial fibrillary acidic protein,GFAP ELISA Kit (CSB-E08601h)
Mouse glial fibrillary acidic protein,GFAP ELISA Kit (CSB-E08603m)
Rat glial fibrillary acidic protein,GFAP ELISA Kit (CSB-E08602r)
Pig glial fibrillary acidic protein,GFAP ELISA Kit (CSB-E14950p)
参考文献:
[1] Eng L F, Vanderhaeghen J J, Bignami A, et al. An acidic protein isolated from fibrous astrocytes [J]. Brain research, 1971, 28(2): 351-354.
[2] Eng L F, Ghirnikar R S, Lee Y L. Glial fibrillary acidic protein: GFAP-thirty-one years (1969–2000) [J]. Neurochemical research, 2000, 25(9-10): 1439-1451.
[3] Reeves S A, Helman L J, Allison A, et al. Molecular cloning and primary structure of human glial fibrillary acidic protein [J]. Proceedings of the National Academy of Sciences, 1989, 86(13): 5178-5182.
[4]Yang Z, Wang K K W. Glial fibrillary acidic protein: from intermediate filament assembly and gliosis to neurobiomarker [J]. Trends in neurosciences, 2015, 38(6): 364-374.
[5] Brenner M. Structure and transcriptional regulation of the GFAP gene [J]. Brain pathology, 1994, 4(3): 245-257.
[6]Blechingberg J, Holm I E, Nielsen K B, et al. Identification and characterization of GFAPκ, a novel glial fibrillary acidic protein isoform[J]. Glia, 2007, 55(5): 497-507.
[7]Hol E M, Pekny M. Glial fibrillary acidic protein (GFAP) and the astrocyte intermediate filament system in diseases of the central nervous system [J]. Current Opinion in Cell Biology, 2015, 32: 121-130.
[8] Rutka J T, Murakami M, Dirks P B, et al. Role of glial filaments in cells and tumors of glial origin: a review [J]. Journal of neurosurgery, 1997, 87(3): 420-430.
[9]Kamphuis W, Kooijman L, Orre M, et al. GFAP and vimentin deficiency alters gene expression in astrocytes and microglia in wild‐type mice and changes the transcriptional response of reactive glia in mouse model for Alzheimer's disease [J]. Glia, 2015, 63(6): 1036-1056.
[10]Toda M, Miura M, Asou H, et al. Suppression of glial tumor growth by expression of glial fibrillary acidic protein [J]. Neurochemical research, 1999, 24(2): 339-343.
[11]Johnston-Wilson N L, Sims C D, Hofmann J P, et al. Disease-specific alterations in frontal cortex brain proteins in schizophrenia, bipolar disorder, and major depressive disorder [J]. Molecular psychiatry, 2000, 5(2): 142.
[12]Brenner M, Johnson A B, Boespflug-Tanguy O, et al. Mutations in GFAP, encoding glial fibrillary acidic protein, are associated with Alexander disease [J]. Nature genetics, 2001, 27(1): 117.
[13]Hagemann T L, Powers B, Mazur C, et al. Antisense suppression of glial fibrillary acidic protein as a treatment for Alexander disease [J]. Annals of neurology, 2018, 83(1): 27-39.
[14]Hua Y A N, Zhang H, WU Q, et al. Increased leakage of brain antigens after traumatic brain injury and effect of immune tolerance induced by cells on traumatic brain injury [J]. Chinese medical journal, 2012, 125(9): 1618-1626.
[15]Senn R, Elkind M S V, Montaner J, et al. Potential role of blood biomarkers in the management of nontraumatic intracerebral hemorrhage [J]. Cerebrovascular Diseases, 2014, 38(6): 395-409.
[16]Wunderlich M T, Wallesch C W, Goertler M. Release of glial fibrillary acidic protein is related to the neurovascular status in acute ischemic stroke [J]. European journal of Neurology, 2006, 13(10): 1118-1123.













