TM4SF1:四次跨膜蛋白TM4SF家族成员,抗肿瘤血管新生潜力靶点?
日期:2023-11-23 14:54:30
近年来,TM4SF1作为多种恶性肿瘤治疗的新靶点被广泛研究。TM4SF1属于四次跨膜蛋白TM4SF家族成员,其家族蛋白可以与细胞内外的多种分子相互作用,调控细胞信号转导、细胞黏附和迁移过程,从而对肿瘤的发生和发展产生影响。最新研究报道,TM4SF1-CAR-T细胞在体外显示出特异性细胞毒性,能够杀死TM4SF1阳性的肿瘤细胞,并释放干扰素-γ(IFN-γ)和肿瘤坏死因子α(TNF-α)。TM4SF1-CAR-T细胞在体内抑制了SKOV3来源的肿瘤生长,达到了90%的缓解率,包括低剂量和高剂量组 [1]。TM4SF1作为一种在多种肿瘤中潜在的生物标志物,已被证实在多种肿瘤中高表达。越来越多的研究显示TM4SF1在癌症研究中具有潜在的应用价值,并展示了基于TM4SF1蛋白的靶向潜力。因此,新靶点TM4SF1正成为许多研究学者关注的焦点!
1. 什么是TM4SF家族?
TM4SF(Transmembrane 4 Superfamily)是四次跨膜蛋白超家族,在多数哺乳动物组织和白细胞中均有不同程度的表达。目前,在哺乳动物中有约30多个公认的四次跨膜蛋白超家族成员,包括CD9(MRP1)、CD82(KAI1)、CD63(LAMP-3)、CD81(TAPA1)、CD151(PETA3)、CD37、CD53、C0-029和Sm23等 [2-4]。其中,TM4SF1(L6)与TM4SF家族其它成员相比,虽具有相似的拓扑结构,但缺乏四次跨膜蛋白整体序列的同源性-高度保守的CCG(Cys-Cys-GLy)序列,因此,将其从4次跨膜蛋白家族中细化出来,又归为4次跨膜蛋白L6超家族(L6 superfamily),这一家族成员还包括TM4SF4、TM4SF5、TM4SF18、TM4SF19、TM4SF20等 [5-6]。TM4SF家族有些成员对肿瘤细胞的生长、移动和转移起着负性调节的作用,即可以抑制肿瘤细胞的迁移及侵袭,但也有些可以促进恶性肿瘤的发生发展及转移浸润 [1, 2-4]。
2. 什么是TM4SF1?
2.1 TM4SF1的结构
TM4SF1(Transmembrane-4-L-six-family-1)又称L6、TAL6。TM4SF1是近十几年才发现的一种癌基因,因结构和功能上都与TM4SF家族类似,属于四次跨膜蛋白家族(TM4SF)成员之一。TM4SF家族成员结构相似,大多由200-350个氨基酸组成,具有四个跨膜区域。蛋白内部有短的C末端和N末端,可能与细胞骨架和信号传导相关。在细胞外部,它们与特定受体等空间蛋白相互作用 [7-8]。目前,TM4SF1的分子结构尚未完全阐明,一项研究揭示TM4SF1蛋白是由202个氨基酸组成的一个富含半胱氨酸且呈现疏水性的多肽,该肽链有四个疏水结构域并四次跨越细胞膜,其中三个疏水区靠近氨基端,第四个靠近羟基末端,疏水区域Ⅲ与Ⅳ之间被一个由29个氨基酸组成的亲水结构域分隔开,该亲水结构域含有两个潜在的糖基化位点,同时与类似拓扑酶结构的细胞表面蛋白相关联 [10]。
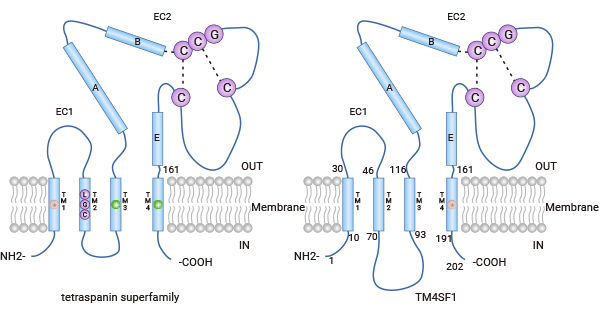
图1. TM4SF1的结构 [10]
2.2 TM4SF1的表达及功能研究
通常情况下,在正常组织中TM4SF1呈现低表达。然而,研究发现TM4SF1在胰腺癌、卵巢癌、肝癌、前列腺癌、结直肠癌以及乳腺癌等多种上皮性恶性肿瘤细胞中高表达,参与肿瘤细胞的生长、黏附、侵袭和转移,以及调控血管内皮细胞的功能及病理血管的生成 [11-12]。此外,研究发现,TM4SF1抗体可能通过调控人类单核细胞抗体依赖性细胞毒作用和人类补充因子补体依赖性细胞毒作用来杀灭肿瘤细胞,并抑制它们代谢产物的生成 [13]。对乳腺癌、结肠癌、肺癌、卵巢癌等复发患者进行I期临床研究发现,TM4SF1抗体的耐受性较好,且也有效地局限了肿瘤细胞,有复发的患者甚至得到了完全缓解。因此,TM4SF1抗体有望成为未来恶性肿瘤研究的新靶点 [14-16]。
3. TM4SF1相关的抗肿瘤血管生成的调控机制
肿瘤生长依赖肿瘤血管的形成,它是肿瘤代谢的关键途径。TM4SF1通过与整合素家族成员形成跨膜复合体来参与细胞的多项生命活动及影响肿瘤细胞的生长、黏附、侵袭和转移能力,并参与肿瘤血管生成。也有报道TM4SF1能够激活Rho信号通路,从而介导上皮-间质的转化(EMT),进而参与肿瘤细胞的浸润转移,具体作用机制尚在研究中 [17]。
研究报道,TM4SF1基因敲除后可以阻止丝状伪足的形成,抑制细胞迁移,阻止细胞分裂,促进内皮细胞衰老。整合素α5(Integrin α5)和整合素β1(Integrin beta 1/CD29)亚基,与TM4SF1结合后相互作用,且整合素只在血管内皮生长因子A(VEGF-A)或凝血酶刺激作用下才与TM4SF1相互结合。因此,TM4SF1敲除后能抑制血管生成内皮生长因子的成熟。同时,TM4SF1存在于肿瘤细胞膜及细胞器(如溶酶体)中,可与LAMP-1和LAMP-2或乳铁蛋白结合蛋白(LTF)实现共定位后影响细胞功能;TM4SF1促进血管的生成同时,可通过募集到TEMs区域及相关的泛素化修饰影响细胞的迁移能力;还可通过与CD13相互作用以及调节跨膜蛋白CD63、CD82等的表达,参与调节细胞的运动及侵袭能力。无论无何,TM4SF1对体外内皮细胞和体内病理性血管形成具有重要作用,有望作为潜在的抗肿瘤血管生成的靶点 [17]。
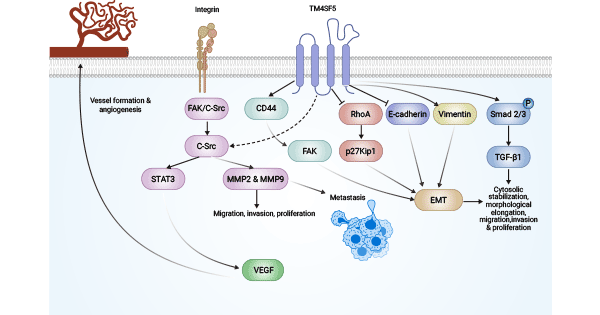
图2. TM4SF1的抗肿瘤血管生成的调控机制 [17]
4. TM4SF1相关的肿瘤研究
4.1 TM4SF1和胰腺癌研究
TM4SF1在胰腺癌中的表达量明显高于良性肿瘤和正常组织。研究表明,通过siRNA沉默TM4SF1后,胰腺癌细胞的侵袭力和迁移能力受到抑制,但肿瘤细胞的增值能力并未受到影响。这可能是因为TM4SF1仅在肿瘤细胞的迁移和转移途径中发挥作用,与肿瘤的发生并无显著关系。siRNA沉默TM4SF1后,肿瘤细胞对化疗药物卡培他滨的敏感性增加,然而其具体机制尚不明确。有研究提示,TM4SF1通过调节MMP-2和MMP-9的基因表达影响胰腺癌细胞的迁移和侵袭。事实上,TM4SF家族多种成员在胰腺癌组织中高表达。例如,CD151、CD9、CD81等家族成员在胰腺导管腺癌的细胞膜以及胞浆中均呈弥漫性表达 [18-21]。
4.2 TM4SF1和乳腺癌研究
研究发现,TM4SF1在乳腺癌组织中高表达,可能与乳腺癌的发生发展及转移密切相关,能够促进肿瘤细胞的转移。在HER-2高表达型乳腺癌中,TM4SF1蛋白的表达量最高,暗示两者可能存在某种潜在联系 [22]。另有研究发现,与周围正常乳腺组织相比,乳腺肿瘤组织中高表达TM4SF1。其后,合成来源于抗原表位的衍生物HLA-A2,发现它能抑制肿瘤细胞生长。这些研究结果的发现对未来的乳腺癌新药研发具有重要意义 [23]。此外,有研究揭示,TM4SF1可能通过PI3K/AKT/mTOR信号通路在TNBC细胞的侵袭和凋亡中起重要作用 [24]。
4.3 TM4SF1和前列腺癌研究
TM4SF1是雄激素受体(Androgen receptor,AR)转录因子的直接靶基因。雄激素受体在前列腺癌内环境中扮演关键角色,促进了前列腺癌的发展。雄激素与其配体结合后,可能完全失去对其活性的控制,导致肿瘤细胞过度增殖。研究发现,TM4SF1其启动子区含有雄激素反应元件(ARE),并且受雄激素调节。在前列腺癌中,TM4SF1表达水平高于良性前列腺增生。进一步的功能研究表明,TM4SF1参与调控肿瘤细胞的迁移,可能在肿瘤转移中发挥作用。深入研究TM4SF1作为雄激素受体(AR)的靶点,有望为前列腺癌研究开辟新的治疗途径。 [25-27]。
4.4 TM4SF1和卵巢癌研究
应用SEREX技术将TM4SF1从人卵巢癌腹水cDNA文库中筛选出来,并通过分离并纯化相关抗原,对其进行了进一步的分析。研究发现,TM4SF1基因在不同卵巢组织中的表达,发现随着卵巢癌的发生与发展,TM4SF1呈逐渐增高的趋势,其基因表达显示出与卵巢癌发生发展相关的特征 [28]。另有报道,通过基因芯片数据库分析和蛋白相互作用网络分析显示,TM4SF1和DDR1有直接相互作用,并且与细胞外基质、胶原、整合素等信号通路相关 [29]。
4.5 TM4SF1和其它癌症研究
TM4SF1在多种恶性癌症的迁移和侵袭中起重要作用,如研究发现TM4SF1通过调节caspase-3、caspase-9、MMP-2、MMP-9和VEG等相关基因的表达促进肝癌细胞的增殖、侵袭和转移 [30];根据基于芯片结果,筛选宫颈癌相关的目标基因2个:EFNB2和TM4SF1。EFNB2和TM4SF1在宫颈癌原代SP细胞中有较高表达,且两者与肿瘤的转移、侵袭均有密切相关性 [28, 31];TM4SF1通过调控凋亡相关蛋白caspase-3等促进胃癌细胞的增殖、迁移和侵袭;亦或通过调控PPARγ-SIRT1反馈环影响膀胱癌细胞凋亡、细胞周期 [32]。
5. TM4SF1临床研究前景
目前,有四种针对TM4SF1的药物在研发中,分别是Angiex公司的抗体偶联药物Anti-TM4SF1 ADC,上海科棋药业科技有限公司的两种CAR-T细胞疗法CART-TM4SF1 cells和KQ-L6,以及上海科医联创生物科技有限公司的CAR-T细胞疗法Anti-TM4SF1-CAR-T-cell therapy。这些药物都通过不同的作用机制抑制或杀死表达TM4SF1的肿瘤细胞,主要适用于实体瘤以及消化系统肿瘤。其中,Anti-TM4SF1 ADC还处于临床前阶段,而其他三种药物已进入临床I期阶段。TM4SF1作为潜力巨大的肿瘤研究靶点,其在临床药物研究方面具有广阔前景。然而,要证明其有效性和优势,需要进一步收集临床研究数据并进行安全性评估。
为鼎力协助科研和药企人员针对TM4SF1在肿瘤中的临床应用研究,CUSABIO推出TM4SF1活性蛋白(Code:CSB-MP013330HU)以及重组抗体(Code:CSB-RA023615MA1HU),助力您在TM4SF1机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页 CUSABIO TM4SF1 蛋白
● Recombinant Human Transmembrane 4 L6 family member 1(TM4SF1)-VLPs (Active) Code: CSB-MP023615HU

CSB-MP023615HU is detected by Mouse anti-6*His monoclonal antibody.The two bands respectively correspond to monomer, Homodimer.
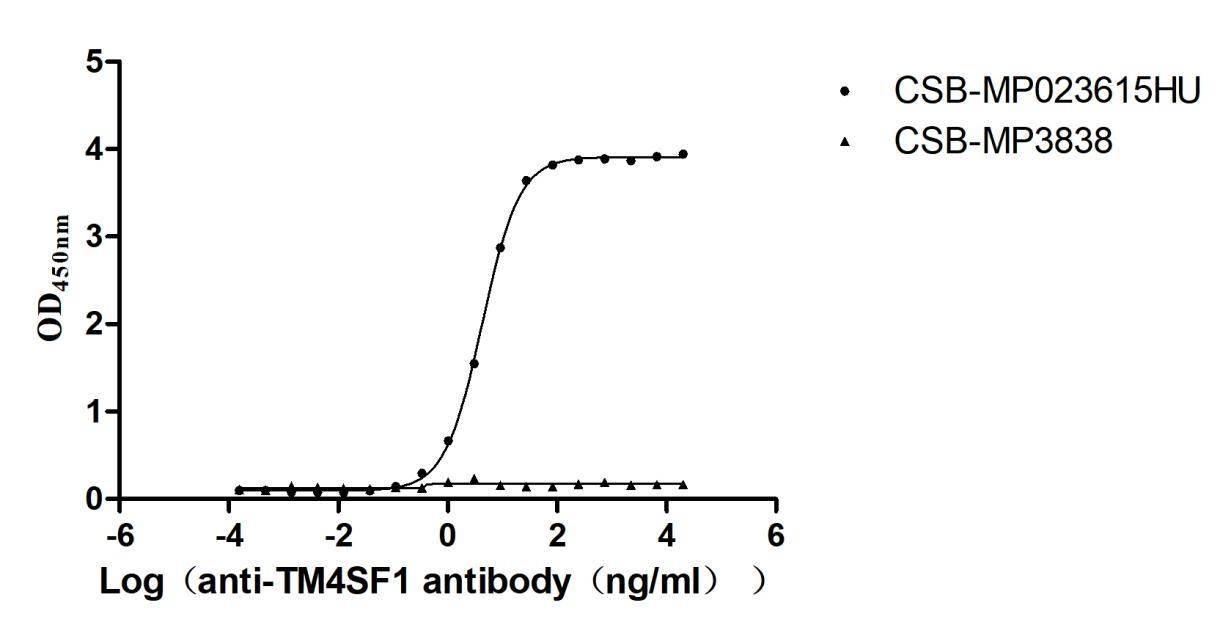
Immobilized Human TM4SF1 at 5μg/mL can bind Anti-TM4SF1 recombinant antibody(CSB-RA023615MA1HU). The EC50 is 4.079-4.472 ng/mL. VLPs (CSB-MP3838) is negative control.

CSB-MP5031MOV is detected by Mouse anti-6*His monoclonal antibody.The two bands respectively correspond to monomer, Homodimer.

Immobilized Cynomolgus TM4SF1 at 5μg/mL can bind Anti-TM4SF1 recombinant antibody(CSB-RA023615MA1HU). The EC50 is 4.480-4.930 ng/mL. VLPs (CSB-MP3838) is negative control.
j9九游会登录入口首页 CUSABIO TM4SF1 抗体
TM4SF1 Recombinant Monoclonal Antibody (Code: CSB-RA023615MA1HU)
参考文献:
[1] Shen, Yijie, et al. "Construction of CAR-T cells targeting TM4SF1 and its anti-tumor capacity in ovarian cancer." Immunology Letters 255 (2023): 1-9.
[2] Rahim, Nur Syafiqah, et al. "Three Members of Transmembrane-4-Superfamily, TM4SF1, TM4SF4, and TM4SF5, as Emerging Anticancer Molecular Targets against Cancer Phenotypes and Chemoresistance." Pharmaceuticals 16.1 (2023): 110.
[3] Qi, Yaoyue, et al. "Expression and function of transmembrane 4 superfamily proteins in digestive system cancers." Cancer Cell International 20.1 (2020): 1-12.
[4] Seldin, Michael F., et al. "Mapping of the genes for four members of the transmembrane 4 superfamily: mouse Cd9, Cd63, Cd81, and Cd82." Immunogenetics 42 (1995): 422-425.
[5] Fu, Fangmei, et al. "Role of transmembrane 4 L six family 1 in the development and progression of cancer." Frontiers in molecular biosciences 7 (2020): 202.
[6] Xu, Lijian, et al. "hsa-miR-141 downregulates TM4SF1 to inhibit pancreatic cancer cell invasion and migration." International journal of oncology 44.2 (2014): 459-466.
[7] Xian, Jinwen, et al. "Molecular Characterization of a Tetraspanin TSP11 Gene in Echinococcus granulosus and Evaluation Its Immunoprotection in Model Dogs." Frontiers in Veterinary Science 8 (2021): 759283.
[8] Murungi, Edwin K., et al. "Evolution and structural analyses of Glossina morsitans (Diptera; Glossinidae) tetraspanins." Insects 5.4 (2014): 885-908.
[9] Fu, Fangmei, et al. "Role of transmembrane 4 L six family 1 in the development and progression of cancer." Frontiers in molecular biosciences 7 (2020): 202.
[10] Shih, Shou-Ching, et al. "The L6 protein TM4SF1 is critical for endothelial cell function and tumor angiogenesis." Cancer research 69.8 (2009): 3272-3277.
[11] Visintin, Alberto, et al. "Novel anti-TM4SF1 antibody–drug conjugates with activity against tumor cells and tumor vasculature." Molecular Cancer Therapeutics 14.8 (2015): 1868-1876.
[12] Lin, Chi-Iou, et al. "TM4SF1: a new vascular therapeutic target in cancer." Angiogenesis 17 (2014): 897-907.
[13] Sciuto, Tracey E., et al. "Intracellular distribution of TM4SF1 and internalization of TM4SF1-antibody complex in vascular endothelial cells." Biochemical and biophysical research communications 465.3 (2015): 338-343.
[14] Chen, Guang, et al. "Targeting TM4SF1 exhibits therapeutic potential via inhibition of cancer stem cells." Signal Transduction and Targeted Therapy 7.1 (2022): 350.
[15] Fu, Fangmei, et al. "Role of transmembrane 4 L six family 1 in the development and progression of cancer." Frontiers in molecular biosciences 7 (2020): 202.
[16] Allioli, Nathalie, et al. "TM4SF1, a novel primary androgen receptor target gene over‐expressed in human prostate cancer and involved in cell migration." The Prostate 71.11 (2011): 1239-1250.
[17] Rahim, Nur Syafiqah, et al. "Three Members of Transmembrane-4-Superfamily, TM4SF1, TM4SF4, and TM4SF5, as Emerging Anticancer Molecular Targets against Cancer Phenotypes and Chemoresistance." Pharmaceuticals 16.1 (2023): 110.
[18] Visintin, Alberto, et al. "Novel anti-TM4SF1 antibody–drug conjugates with activity against tumor cells and tumor vasculature." Molecular Cancer Therapeutics 14.8 (2015): 1868-1876.
[19] Cao, Jia, et al. "TM4SF1 regulates pancreatic cancer migration and invasion in vitro and in vivo." Cellular Physiology and Biochemistry 39.2 (2016): 740-750.
[20] Cao, Jia, et al. "TM4SF1 promotes gemcitabine resistance of pancreatic cancer in vitro and in vivo." PloS one 10.12 (2015): e0144969.
[21] Zheng, Biao, et al. "TM4SF1 as a prognostic marker of pancreatic ductal adenocarcinoma is involved in migration and invasion of cancer cells." International journal of oncology 47.2 (2015): 490-498.
[22] Gao, Xinya, et al. "Expression of TM4SF1 in breast cancer tissue and its clinical significance." Journal of Jilin University (Medicine Edition) (2017): 1186-1192.
[23] Chen, Jie, et al. "Transmembrane 4 L Six Family Member 1 Suppresses Hormone Receptor-–Positive, HER2-Negative Breast Cancer Cell Proliferation." Frontiers in Pharmacology 13 (2022): 770993.
[24] Sun, Yonghong, et al. "Role of TM4SF1 in regulating breast cancer cell migration and apoptosis through PI3K/AKT/mTOR pathway." International journal of clinical and experimental pathology 8.8 (2015): 9081.
[25] Allioli, Nathalie, et al. "TM4SF1, a novel primary androgen receptor target gene over‐expressed in human prostate cancer and involved in cell migration." The Prostate 71.11 (2011): 1239-1250.
[26] Chen, Junyi, et al. "Over-expression of TM4SF1 improves cell metastasis and growth by activating ERK1/2 signaling pathway in human prostate cancer." J. BUON 24 (2019): 2531-2538.
[27] Cao, Jia, et al. "TM4SF1 regulates pancreatic cancer migration and invasion in vitro and in vivo." Cellular Physiology and Biochemistry 39.2 (2016): 740-750.
[28] Gao, Caiyun, et al. "TM4SF1 is a potential target for anti-invasion and metastasis in ovarian cancer." BMC cancer 19 (2019): 1-12.
[29] Huang, Zhijiong, Hongyu Yao, and Zhijun Yang. "Prognostic significance of TM4SF1 and DDR1 expression in epithelial ovarian cancer." Oncology Letters 26.4 (2023): 1-12.
[30] Huang, Yu-Kun, Xue-Gong Fan, and Fu Qiu. "TM4SF1 promotes proliferation, invasion, and metastasis in human liver cancer cells." International journal of molecular sciences 17.5 (2016): 661.
[31] Alam, Syed Mahfuzul, et al. "Coexpression of EphB4 and ephrinB2 in tumor advancement of uterine cervical cancers." Gynecologic oncology 114.1 (2009): 84-88.
[32] Cao, Rui, et al. "TM4SF1 regulates apoptosis, cell cycle and ROS metabolism via the PPARγ-SIRT1 feedback loop in human bladder cancer cells." Cancer letters 414 (2018): 278-293.
上一篇: 干细胞-人体中的奇妙资源
下一篇: 胶质纤维酸性蛋白-胶质细胞特异性标记物











