DSG3:新兴的肿瘤相关粘附因子,寻常天疱疮PV临床诊断的特异性标记物!
日期:2023-09-28 13:46:07
DSG3是DSGs家族成员之一(DSG1、DSG2、DSG3、DSG4)。它们均属于细胞粘附分子钙粘素超家族的成员。近年来对于粘附分子与肿瘤关系的研究逐渐成为一个热点,主要分为钙粘素超家族、选择素、免疫球蛋白超家族、整合素等类型。钙粘素超家族中的E-cadherin近年来的研究较多,其与肿瘤侵袭发展的关系也较明确被证实。然而,DSG3是一个相对新兴的粘附因子,研究已经明确了其作为自身免疫性疾病寻常天疱疮的特异性抗原的角色。此外,最新的国内外研究也揭示了DSG3在肿瘤中发挥着重要的生物学功能。因此,深入研究DSG3有望为相关疾病带来的新的诊断和治疗方法!
1. 什么是DSG3?
1.1 DSG3的结构
桥粒芯糖蛋白3(Desmoglein 3,DSG3)是桥粒芯蛋白家族DSGs的成员之一,其基因位于人类染色体18q12.1-q12.2区域。桥粒芯糖蛋白Desmoglein 3作为构成桥粒的主要成分之一,参与形成细胞间连接。因而,DSG3属于细胞黏附分子中的钙黏素超家族。DSG3相对分子质量约为160 kDa,从DSG的氨基酸序列推论显示,它和钙依赖细胞黏附分子有同源性。和典型的钙粘素一样,DSG3有5个大约相似的细胞外的结构域,称为EC1(氨基端)一EC5(梭基端)。DSG3的细胞外结构域含有与其他细胞蛋白相互作用的结构域,这些结构域在维持细胞间的黏附和连接中具有关键作用(图1) [1-3]。
1.2 DSG3的表达和功能
目前的研究发现,DSG3只见于分布在复层鳞状上皮表皮层的角质细胞膜上,在颗粒层和颗粒下层中呈优势表达。DSG3与其它蛋白如DSG1一起形成细胞间的桥粒(Desmosomes),这些桥粒起着维护组织结构的作用,使细胞能够紧密连接在一起,从而确保组织的完整性和稳定性。此外,DSG3是天疱疮亚型寻常型天疱疮(Pemphigus vulgaris,PV)的重要靶点之一。在PV患者中,免疫系统产生抗DSG3的抗体,这些抗体与DSG3结合,干扰了细胞间的连接,导致皮肤和黏膜上的水疱和大疱形成,是PV发病的重要因素之一 [1-4]。
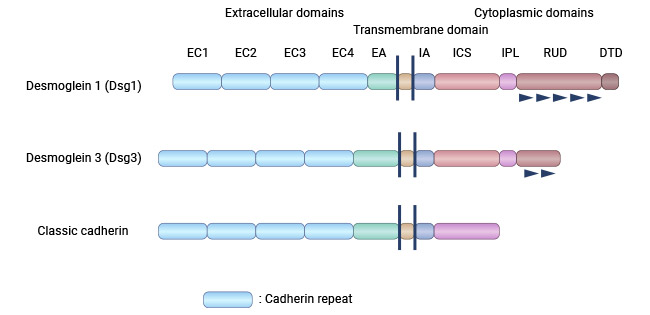
图1. DSG3的结构 [3]
2. DSG3相关的信号机制
2.1 DSG3在寻常天疱疮PV发病中的机制
寻常型天疱疮的发病机制仍然不清楚,特别是在水疱形成的关键驱动因素方面。水疱的形成涉及多个细胞内信号事件(例如Src、p38MAPK、PKC、ERK、Bax、FasL、Bcl-2等)、DSG3降解、细胞凋亡,以及促进自身抗体产生的遗传因素 [5-7]。综合研究表明,DSG3在维持角质形成细胞-细胞间的粘附上起重要作用,特异性抗体与DSG3结合可干扰这种细胞-细胞间的粘附,而导致皮肤棘层松解,被认为是PV发病的关键步骤。然而,尚不完全了解DSG3在PV发病中介导细胞内信号传导的具体机制。
一项研究揭示,寻常型天疱疮(PV)患者的血清中含有特定的免疫球蛋白PV-IgG,可以特异性地靶向DSG3,导致p53蛋白的表达上升。为了验证这一特异性效应,研究人员进行了额外的实验。其中一种实验使用了PV患者的血清,其含有多克隆抗体,这些抗体针对DSG3抗原。另一种实验使用了一种已知特异性结合DSG3粘附位点的单克隆抗体,名为AK23。这两种实验方法的结果均表明,当细胞暴露于PV血清或AK23处理时,p53的表达显著上升,同时DSG3蛋白水平下降。这表明PV-IgG或AK23引发的p53上升与DSG3的特异性干扰相关。这些实验结果强烈支持了PV中DSG3/p53通路的激活,并提示这一通路可能在PV的病理过程中发挥作用(图2)[5]。
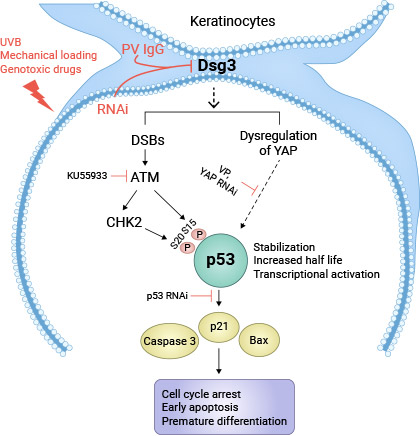
图2. 角质细胞中的DSG3减少诱导p53激活模型 [5]
2.2 DSG3在肿瘤中的调控机制
目前关于DSG3在癌症中的生物学功能及机制作用还知之甚少。一项研究揭示,在鳞状细胞癌中,DSG3调节c-Jun/AP-1的活性以及蛋白激酶C(PKC)-介导的Ezrin-Thr567的磷酸化,导致癌细胞的运动能力增强,从而促进癌细胞的转移 [8]。
具体而言,DSG3会与Ezrin在质膜上形成复合物,这对其与F-actin和CD44相互作用的正常功能至关重要,当敲除DSG3,这些相互作用就会受到干扰。DSG3过表达细胞中Ezrin磷酸化增加,可被多种丝/苏氨酸激酶的药理抑制剂大幅抑制(eg. PKC和Rho激酶)。此外,在DSG3过表达细胞中发现了c-Jun S63磷酸化的显著增加。综上所述,这项研究揭示了一种新的DSG3调控机制,它涉及c-Jun/AP-1的活化以及依赖于PKC的Ezrin磷酸化过程,这些机制可能是导致DSG3相关癌转移的原因之一(图3)[8-10]。
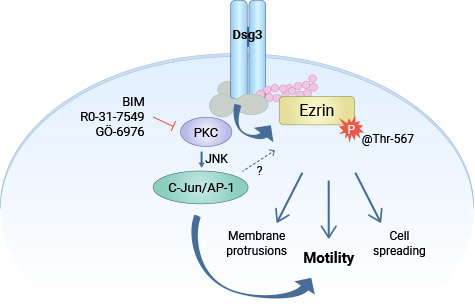
图3. DSG3通过PKC/AP-1调控Ezrin的磷酸化,促进肿瘤细胞的浸润 [6]
3. DSG3在疾病中的作用
3.1 DSG3与自身免疫性疱病
天疱疮是一种罕见的、慢性的、反复发作的皮肤疾病,其特征是在正常皮肤和黏膜上形成松弛的水疱。PV发病分为两个阶段:首先是低滴度的自身抗体出现,然后抗体滴度上升,随后出现临床症状。临床上,天疱疮分为四个主要类型:寻常型天疱疮、落叶型天疱疮、副肿瘤性天疱疮和IgA型天疱疮。寻常型天疱疮(Pemphigus vulgar,PV)是天疱疮中最常见的亚型,其特点是在表皮细胞的桥粒上存在自身抗体。PV以其严重的临床症状而闻名,不仅影响皮肤和黏膜,还引起严重的并发症,如低蛋白血症、感染甚至败血症。目前认为,PV的症状主要是由DSG1和/或DSG3 IgG抗体引起 [11-13]。
研究表明,DSG3的致病性与PV的严重程度之间存在着密切的相关性。在PV患者血清中常可检测出抗DSG3抗体。PV皮肤病损严重程度与DSG1抗体水平呈正相关,即皮肤病损越严重DSG1抗体水平越高。黏膜病损严重程度与DSG3抗体水平呈正相关,口腔黏膜病损越严重DSG3抗体水平越高。目前,在临床检验上,采用间接免疫荧光(indirect immunofluorescence,IIF)方法检测患者血清中总的循环抗体,但是并不能明确到究竟是哪一种致病性靶抗原引起水疱的发生 [14-16]。
随着科学技术的发展,如今已经明确DSG1,DSG3和BP180,BP230这些靶抗原能直接导致大疱性皮肤病的发生。国内外文献的综合分析表明,ELISA方法在检测DSG3方面的应用逐年增加,具有高敏感性和高特异性,而且操作简单、结果判定客观,对准确检测天疱疮抗体以及区分PV和其他类型的天疱疮提供了诊断依据,是一种较好的临床辅助诊断方法 [17-19]!
3.2 DSG3与肿瘤
DSG3是寻常天疱疮的特异性抗原,目前国内外的绝大多数文献报道都是有关这方面的。然而,国外的一些最新研究显示、DSG3与某些肿瘤的发生、预后密切相关。一项对同一细胞株DJM-1的研究发现,“DSG3耗竭的桥粒”可能不足以维持表皮细胞间的正常黏附强度,导致皮肤出现多种病变 [20-21]。利用全基因组芯片构建基因表达谱结合SqRT-PCR等实验研究,筛选出与鼻咽癌发病相关的候选靶基因,高表达的DSG3被认为是重要的促瘤因素 [22];在人鳞状细胞癌中,细胞间桥粒明显减少,患者血清中DSG3可作为人鳞状细胞癌诊断及鉴别诊断的指标 [8]。
在肺癌中,近些年研究比较多而且比较成熟的指标有CD44v6,MMPs,TIMPs,p53,VEGF,EGFR,COX-2等 [23],利用免疫组化法监测DSG3在非小细胞肺癌患者中的表达,结果提示,DSG3与肿瘤的病理类型、分化程度有相关性,分化程度高组阳性表达高于分化程度低组;DSG3与患者生存率有关,表达阳性组的生存率高于阴性组。因此,DSG3在肺癌组织中的表达或可作为肺癌预后的一个指标 [23-26]。
4. DSG3的临床研究前景
目前关于DSG3国内的报道相对有限,国外的研究主要集中在DSG3在天疱疮诊疗方面的潜力,多款处于临床阶段的靶向DSG3药物,主要用于免疫系统疾病以及皮肤和肌肉骨骼疾病。新的研究发现,在小鼠的天疱疮模型中,一种名为Stable/Functional-Induced Regulatory T Cells (S/F-iTregs)的治疗方式显著降低了患者的临床评分、循环中的抗Dsg3 IgG滴度,以及其它与天疱疮相关的自身免疫标记物 [27]。
此外,从天疱疮患者的样本中获得的S/F-iTregs在体外试验中也表现出有效抑制自体T细胞增殖的特性 [27]。美国公司Cabaletta Bio, Inc.的DSG3+DSG1 CAART是一款CAR T的免疫疗法,正处于临床前阶段,治疗免疫性天疱疮。此外,国外最新的研究揭示了DSG3在肿瘤中发挥调控作用。因此,DSG3作为新兴的肿瘤相关粘附因子,在自身免疫性疱病及肿瘤中有重要临床意义!
为鼎力协助科研和药企人员针对DSG3在自身免疫性疱病和肿瘤中的临床应用研究,CUSABIO推出DSG3活性蛋白(CSB-MP007205MOd7 ; CSB-BP007205HUc7),助力您在DSG3机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页CUSABIO DSG3 蛋白
● Recombinant Human Desmoglein-3(DSG3),partial (Active) (Code: CSB-BP007205HUc7)
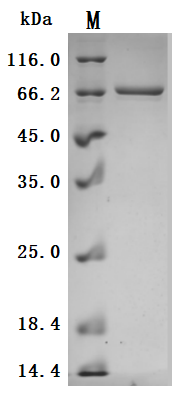
The high purity is greater than 95% as determined by SDS-PAGE.

Immobilized Human DSG3 at 2 μg/mL can bind Anti-DSG3 recombinant antibody (CSB-RA007205A0HU), the EC50 is 4.552-5.720 ng/mL.
● Recombinant Mouse Desmoglein-3(Dsg3),partial (Active) (Code: CSB-MP007205MOd7)

The high purity is greater than 85% as determined by SDS-PAGE.
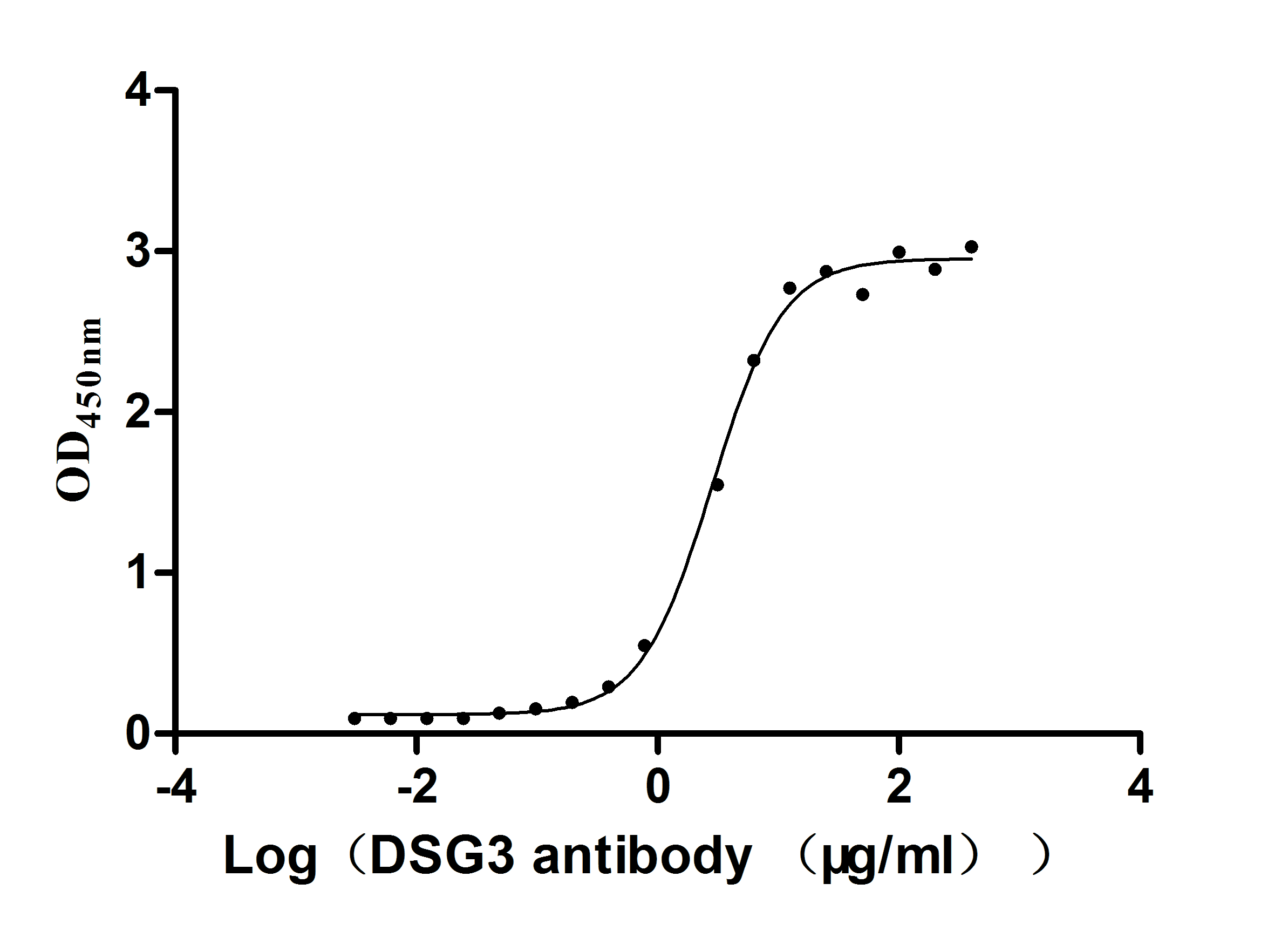
Immobilized Mouse Dsg3 at 5 μg/ml can bind Anti-DSG3 recombinant antibody (CSB-RA007205A0HU), the EC50 is 2.624-3.182 μg/ml.
j9九游会登录入口首页CUSABIO DSG3 抗体
DSG3 Recombinant Monoclonal Antibody (Code: CSB-RA007205A0HU)
参考文献:
[1] Nguyen-Thoi, T., et al. "A cell-based smoothed discrete shear gap method (CS-DSG3) using triangular elements for static and free vibration analyses of shell structures." International Journal of Mechanical Sciences 74 (2013): 32-45.
[2] Ishikawa, H., et al. "Cloning of the mouse desmoglein 3 gene (Dsg3): interspecies conservation within the cadherin superfamily." Experimental dermatology 9.4 (2000): 229-239.
[3] Amagai, Masayuki. "Desmoglein as a target in autoimmunity and infection." Journal of the American Academy of Dermatology 48.2 (2003): 244-252.
[4] Heupel, Wolfgang-Moritz, et al. "Pemphigus vulgaris IgG directly inhibit desmoglein 3-mediated transinteraction." The Journal of Immunology 181.3 (2008): 1825-1834.
[5] Rehman, Ambreen, and Hong Wan. "A novel regulatory pathway of Desmoglein-3 in keratinocyte stress response." Journal of Cellular Signaling 1.4 (2020): 169-179.
[6] Bumiller-Bini Hoch, Valéria, et al. "Marked to Die-Cell Death Mechanisms for Keratinocyte Acantholysis in Pemphigus Diseases." Life 12.3 (2022): 329.
[7] Jolly, Puneet S., et al. "p38MAPK signaling and desmoglein-3 internalization are linked events in pemphigus acantholysis." Journal of Biological Chemistry 285.12 (2010): 8936-8941.
[8] Brown, L., et al. "Desmoglein 3 promotes cancer cell migration and invasion by regulating activator protein 1 and protein kinase C-dependent-Ezrin activation." Oncogene 33.18 (2014): 2363-2374.
[9] Savci-Heijink, Cemile Dilara, et al. "The role of desmoglein-3 in the diagnosis of squamous cell carcinoma of the lung." The American journal of pathology 174.5 (2009): 1629-1637.
[10] Baron, Sylvain, et al. "Unimpaired skin carcinogenesis in Desmoglein 3 knockout mice." PloS one 7.11 (2012): e50024.
[11] Amagai, Masayuki, et al. "Antibodies against desmoglein 3 (pemphigus vulgaris antigen) are present in sera from patients with paraneoplastic pemphigus and cause acantholysis in vivo in neonatal mice." The Journal of clinical investigation 102.4 (1998): 775-782.
[12] Brandão, Maria Luiza Figueiredo Braga, et al. "Refractory pemphigus vulgaris associated with herpes infection: case report and review." Revista do Instituto de Medicina Tropical de São Paulo 53 (2011): 113-117.
[13] Pitoia, Fabián, et al. "Prevalence of thyroid autoimmunity in patients with pemphigus vulgaris." MEDICINA-BUENOS AIRES- 65.4 (2005): 307.
[14] Scully, Crispian, and Stephen J. Challacombe. "Pemphigus vulgaris: update on etiopathogenesis, oral manifestations, and management." Critical Reviews in Oral Biology & Medicine 13.5 (2002): 397-408.
[15] Baker, John, Kristina Seiffert-Sinha, and Animesh A. Sinha. "Case report: Documentation of cutaneous only pemphigus vulgaris without history of mucosal lesions in North America." Frontiers in Immunology 13 (2022): 969279.
[16] Arbache, Samia Trigo, et al. "Immunofluorescence testing in the diagnosis of autoimmune blistering diseases: overview of 10-year experience." Anais brasileiros de dermatologia 89 (2014): 885-889.
[17] Candiz, María Emilia, et al. "Diagnóstico serológico de patologías ampollares autoinmunitarias." Dermatología Argentina 24.4 (2018): 177-184.
[18] Lim, Yen Loo, et al. "Autoimmune Pemphigus: latest advances and emerging therapies." Frontiers in Molecular Biosciences 8 (2022): 808536.
[19] Calle Isaza, Juliana, Isabel Cristina Ávila Gómez, and Ana María Abreu Vélez. "Autoimmune blistering diseases of the pemphigus group." Iatreia 27.3 (2014): 309-319.
[20] Aoyama, Yurni, and Yasuo Kitajima. "Pemphigus vulgaris-IgG causes a rapid depletion of desmoglein 3 (Dsg3) from the Triton X-100 soluble pools, leading to the formation of Dsg3-depleted desmosomes in a human squamous carcinoma cell line, DJM-1 cells." Journal of Investigative Dermatology 112.1 (1999): 67-71.
[21] Tsuchisaka, A., et al. "Presence of autoimmune regulator and absence of desmoglein 1 in a thymoma in a patient with pemphigus foliaceus." British Journal of Dermatology 173.1 (2015): 268-271.
[22] Huang, Yu-Mei, et al. "Integrated analysis of bulk and single-cell RNA sequencing reveals the interaction of PKP1 and tumor-infiltrating B cells and their therapeutic potential for nasopharyngeal carcinoma." Frontiers in Genetics 13 (2022): 935749.
[23] Dong, Boming, et al. "Computed tomographic images reflect the biologic behavior of small lung adenocarcinoma: they correlate with cell proliferation, microvascularization, cell adhesion, degradation of extracellular matrix, and K-ras mutation." The Journal of Thoracic and Cardiovascular Surgery 130.3 (2005): 733-739.
[24] Khoor, A., et al. "DSG3/TTF-1: A single chromogen antibody cocktail to distinguish between Squamous Cell Carcinoma (SCC) and adenocarcinoma of the lung." Virchows Arch 467.1 (2015): S1-S279.
[25] ZHANG, Xindong, et al. "Expression and clinical significance of CK5/6, DSG3, P40, TTF-1, CK7, NapsinA in small biopsy specimens of non-small cell lung cancer." Chinese Journal of Primary Medicine and Pharmacy (2020): 218-221.
[26] Pancewicz, J., and W. Niklinska. "A brief overview of clinical implications of desmoglein 3 in lung cancer." Progress in Health Sciences 11.2 (2021): 141-144.
[27] Collaborators at the Keio and Osaka Universities Present Key Non-Clinical Data with Stable/Functional-Induced Regulatory T Cells (S/F-iTregs) in Autoimmune Disease Models.












