ALPG:一种ALP同工酶“生殖细胞碱性磷酸酶”,多种癌症中高度特异的细胞表面抗原!
日期:2023-10-17 17:06:59
近期,Nature子刊发布了一篇名为“Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours”的综述文章,重点总结了解决CAR T细胞疗法中靶向非肿瘤效应相关毒性(OTOT)问题的最新进展 [1]。这项研究强调,采用名为SynNotch CAR T的系统为OTOT问题提供了可定制的解决方案。尤为引人瞩目的是,一项针对表达ALPPL2-HER2的卵巢癌异种移植模型的原理性临床前研究已经成功验证该方案的有效性。ALPG(ALPPL2)作为ALP同工酶“生殖细胞碱性磷酸酶”,它是一种高度特异且可靶向肿瘤细胞的抗原,上述研究的发现更进一步凸显了ALPG(ALPPL2)的特殊地位。这些发现提示,ALPG(ALPPL2)可作为一个潜力的靶点,在治疗实体瘤的智能细胞疗法中发挥重要作用!
1. 什么是碱性磷酸酶同工酶(ALP)?
碱性磷酸酶同工酶(Alkaline phosphatase,ALP)是一种水解酶,它能够在碱性条件下去除各种磷酸化底物的磷酸基团,催化磷酸单酯水解。ALP在人体中分为组织非特异性碱性磷酸酶(TNAP)和组织特异性碱性磷酸酶(TSAP)。TSAP包括胎盘碱性磷酸酶(PLAP/ALPP)、肠道碱性磷酸酶(IAP/ALPi)、生殖细胞碱性磷酸酶(ALPG/ALPPL2/GCAP)。ALP广泛存在于人体组织中,参与细胞周期、生长、凋亡和信号转导等多种过程 [2-4]。
ALP活性变化与多种疾病密切相关,包括骨质疏松、骨软化、胆道阻塞、肝硬化和败血症等。同时,ALP也在一些癌症中作为重要的生物标志物,如骨癌、胰腺癌、卵巢癌、乳腺癌以及前列腺癌。此外,ALP还能将一磷酸腺苷水解为细胞信号分子腺苷。因此,对ALP进行高灵敏度检测对于临床诊断和生物医学研究至关重要 [2-4]。
2. 什么是生殖细胞碱性磷酸酶(ALPG)?
2.1 ALPG的结构
生殖细胞碱性磷酸酶(Alkaline phosphatase, germ cell type,ALPG)又叫NAGAO isozyme,GCALP,ALPPL,ALPPL2,编码蛋白ALP-1,属于一种碱性磷酸酶同工酶(Alkaline phosphatase,ALP)。人类的组织特异性碱性磷酸酶(TSAP)基因(ALPG/ALPPL2/GCAP、PLAP/ALPP、IAP/ALPi),都集中定位于在人类染色体2q34-q37区域。TSAP基因在结构上几乎是相同的,它们都包括11个外显子和10个小的内含子。ALPG、PLAP和IAP之间的同源性为90-98%,而TNAP与其他三者的同源性约为50%。与其它碱性磷酸酶一样,ALPG通过糖基磷脂酰肌醇(GPI)锚定到细胞膜上(图1)[5]。
2.2 ALPG的表达和功能
ALPG(ALPPL2/GCAP)在胚胎生殖细胞、一些肿瘤组织和胎盘中以低水平表达,它本质上是精原细胞碱性磷酸酶(ALP),在某些肿瘤中被视为肿瘤标志物,如精原细胞瘤和卵巢癌。另一方面,GCAP在植入前的原始态胚胎干细胞表面出现短暂的高表达,与IGFBP-1的mRNA相互作用,对原始态多能性转录因子CP2样1(TFCP2L1)以及信号转导和转录激活因子3(STAT3)的mRNA水平进行调节,从而参与调控胚胎干细胞的多能性状态转化过程 [6-8]。
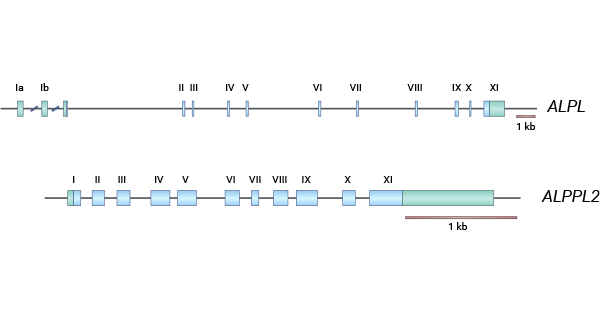
图1. ALPG基因的结构 [5]
3. ALPG(ALPPL2)相关的信号通路
3.1 ALPG在原始态多能性建立和维持中的机制
目前,一项研究揭示ALPG(ALPPL2)在原始态多能性建立和维持中的重要作用。原始态(Naïve State)多能性研究已成为干细胞和重编程领域的焦点。现已鉴定的表面抗原在Naïve态的建立和维持过程中似乎并不起关键作用,其动态变化和相关分子机制仍然不清楚 [6]。
研究通过系统性的蛋白质组学和转录组学分析,确定了ALPPL2作为人原始态(Naïve state)多能干细胞首个功能性表面标志物。更进一步,证明了ALPPL2对于建立和维持原始多能性都是至关重要的。此外,实验数据表明ALPPL2可以与RNA结合蛋白IGF2BP1相互作用,稳定原始多能性转录因子TFCP2L1和STAT3的mRNA水平,从而调控原始多能性。这一发现为进一步改进Naïve态多能干细胞的纯化、分离,以及Naïve态诱导和培养体系提供了重要信息。Naïve态多能干细胞的可塑性和潜在能力使其成为干细胞治疗的有力候选者。通过将它们诱导分化成需要的细胞类型,可以治疗许多疾病和损伤,如心脏病、糖尿病和神经退行性疾病(图2) [6]。
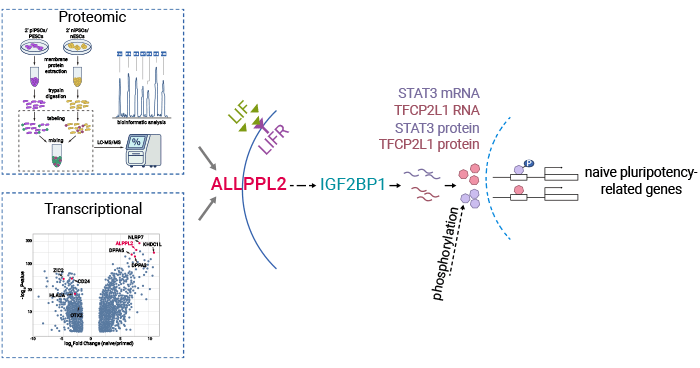
图2. ALPG在原始态多能性建立和维持中的机制 [6]
3.2 ALPG在SynNotch CAR T电路中靶向肿瘤的机制
SynNotch CAR T是最新报道的一种“智能”肿瘤疗法,它被设计用来识别主要存在于非恶性组织中的抗原 [8]。相关研究提示,ALPPL2可以通过SynNotch CAR T电路作为引导开关,用于靶向其他肿瘤相关抗原,以最小化对靶向/非肿瘤组织的毒性作用。SynNotch CAR-T细胞通路在表达ALPPL2的实体瘤临床前模型中显示出增强的特异性,包括间皮瘤和卵巢癌。通过阻止CAR介导的强直信号传导,在临床前模型中实现了优越的肿瘤控制 [9-10]。
具体而言,一项研究利用ALPPL2这一特异性肿瘤抗原,将T细胞进行改造,使其在感知到特异性肿瘤抗原ALPPL2时,产生能够识别并攻击肿瘤细胞的CAR受体。这样一来,T细胞就能更有效地对抗肿瘤。研究中使用了三种CAR,分别定位于MCAM、mesothelin和HER2这三种肿瘤相关抗原,通过监测GFP(绿色荧光蛋白)表达确认CAR受体的存在。此外,实验中还涉及到两种间皮瘤肿瘤细胞,分别是M28(上皮样)和VAMT-1(肉瘤样)。这些工程化T细胞能够有效地杀死这些肿瘤细胞,而且这种杀伤作用是通过ALPPL2 SynNotch电路来调控的。这种电路能够调控GFP的表达,从而控制CAR的表达和T细胞的活性。因此,通过ALPPL2 SynNotch电路来控制CAR受体的表达和T细胞的活性,能够高效地杀伤实体肿瘤细胞(图3) [9]。
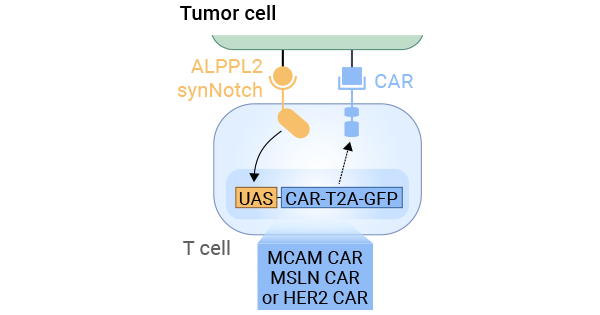
图3. T细胞被改造,使其感知到ALPPL2时产生特定CARs,进而识别并攻击肿瘤细胞 [9]
4. ALPG(ALPPL2)在肿瘤中的作用
目前尚不清楚ALPG(ALPPL2)在疾病中的具体作用,但碱性磷酸酶在多种疾病中发挥重要作用,包括骨代谢疾病、肠道疾病和肿瘤等。因此,ALPPL2可能在这些疾病的发生和发展中发挥一定的作用,但需要进一步的研究来揭示其具体机制和作用方式。现有的文献报道主要集中在ALPG(ALPPL2)在一些肿瘤中的作用。
4.1 ALPG和胰腺癌
一项研究采用SELEX技术(一种可以从随机单链核酸序列库中筛选出特异性与靶物质高度亲和的核酸适配体(Aptamer)的技术),找到了一种能够识别胰腺癌细胞的RNA分子SQ-2。然后,研究发现SQ-2分子的靶蛋白ALPG(ALPPL2),它在胰腺癌细胞中异常表达。利用RNA干扰技术降低了ALPPL2的表达,且影响细胞生长和侵袭。此外,SQ-2能够识别ALPPL2,ALPPL2不仅存在于胰腺癌细胞的表面,还存在于细胞的分泌物中。缺乏早期敏感诊断标志物是胰腺导管腺癌(PDAC)相关致死性的主要原因之一。这一发现提示,ALPPL2可能在基于血清和膜的胰腺导管腺癌(PDAC)诊断中具有重要作用 [11-13]。
4.2 ALPG和乳腺癌
在一项针对ER+乳腺癌患者的研究中,发现了与药物阿那曲唑(Anastrozole)在血浆中浓度有关的基因变异。最重要的基因变异信号(rs11648166)位于SLC38A7基因附近,表明该基因编码了安莫司唑的传输蛋白。另一个重要信号(rs28845026)位于ALPG(ALPPL2)基因附近,并与SLC38A7信号互相影响。这两个SNP会影响这两个基因的表达。值得注意的是,那些同时携带这两个SNP变异的患者,其药物浓度最高,SLC38A7基因表达最高,而ALPPL2基因表达最低。总结来说,这项研究揭示了一个新的基因SLC38A7,它编码了阿那曲唑的转运蛋白,并发现了SLC38A7基因中的SNP与ALPPL2基因附近的SNP之间的相互作用,这些相互作用会影响转运蛋白的表达以及阿那曲唑在血浆中的浓度 [7]。
4.3 ALPG和间皮瘤
研究发现ALPG(ALPPL2)在间皮瘤中广泛表达,覆盖多种亚型,并表现出高度组织特异性。间皮瘤是一种无法治愈的肿瘤,可分为上皮型、双相型和肉瘤型。研究人员通过在活体间皮瘤细胞和正常细胞上进行抗体展示筛选,抗体M25特异地识别ALPPL2。为了评估ALPPL2靶向治疗的潜力,研究人员开发了ALPPL2靶向的抗体-药物结合物,展示了其在体外和体内对间皮瘤的强效和特异性肿瘤杀伤作用。这些发现为间皮瘤治疗提供了新的方向和策略 [14]。
4.4 ALPG和胃癌
研究使用免疫组化技术和生物信息学来分析ALPG(ALPPL2)在胃组织和邻近正常组织中的表达,并评估其在早期检测和预测胃腺癌预后的潜力。研究结果显示,ALPPL2在胃腺癌组织中的表达显著增加,并且是一个独立的因素,可以提供可靠的胃腺癌患者预后信息。高表达的ALPPL2与进展期TNM分期和高表达的HER-2相关。因此,ALPPL2有潜力成为揭示胃癌预后信息的生物标志物 [15]。
4.5 ALPG和其它肿瘤
ALPG(ALPPL2)在癌症领域引起了广泛的关注,特别是在精原细胞瘤的早期检测和基于血液样本的诊断方法中 [6]。已有研究发现,ALPPL2在多种实体肿瘤中表达较高,包括卵巢、子宫内膜和睾丸癌等 [6]。此外,ALPPL2在肺癌、膀胱癌、卵巢癌、黑色素瘤、子宫癌、肾癌、前列腺癌、中枢神经系统肿瘤、结直肠癌、淋巴瘤和白血病等多种肿瘤中也有表达 [6, 16-19]。然而,ALPPL2在这些肿瘤中的表达和功能可能受到多种因素的影响,包括肿瘤亚型、患者群体和实验条件等。因此,对于每一种肿瘤类型,都需要需要进一步的研究和验证,以深入探究ALPPL2在该特定肿瘤中的角色。
5. ALPG(ALPPL2)临床应用前景
目前,已有一款靶向ALPG(ALPPL2)的临床项目在研(SGN-ALPV)。SGN-ALPV是一种创新的vedotin ADC,它借助高度特异性的抗体识别ALPG(ALPPL2)和ALPP,并释放细胞毒剂MMAE,从而引发癌细胞的有丝分裂阻滞、凋亡和免疫原性细胞死亡 [20]。临床前研究结果表明,SGN-ALPV在卵巢、肺、胰腺和胃癌等模型中表现出卓越的抗肿瘤活性,包括对不同ALPG(ALPPL2)和ALPP表达水平的抗肿瘤效应 [20]。总结而言,ALPG(ALPPL2)是一种与多种肿瘤相关的生殖细胞碱性磷酸同工酶。尽管ALPG(ALPPL2)的确切功能和调控机制尚未完全阐明,但它可能在多种肿瘤中发挥关键作用。未来的研究将有助于深入了解ALPG(ALPPL2)的功能,以及其在肿瘤治疗领域的潜在应用价值。
为鼎力协助科研和药企人员针对ALPG(ALPPL2)的在肿瘤中的临床应用研究,CUSABIO推出ALPG活性蛋白(Code:CSB-MP001633HU),助力您在ALPG机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页 CUSABIO ALPG 蛋白
Recombinant Human Alkaline phosphatase, germ cell type(ALPG) (Active) Code: CSB-MP001633HU
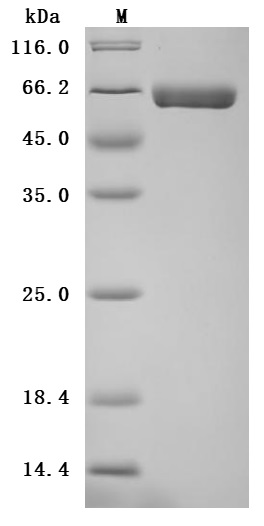
The high purity is greater than 95% as determined by SDS-PAGE.
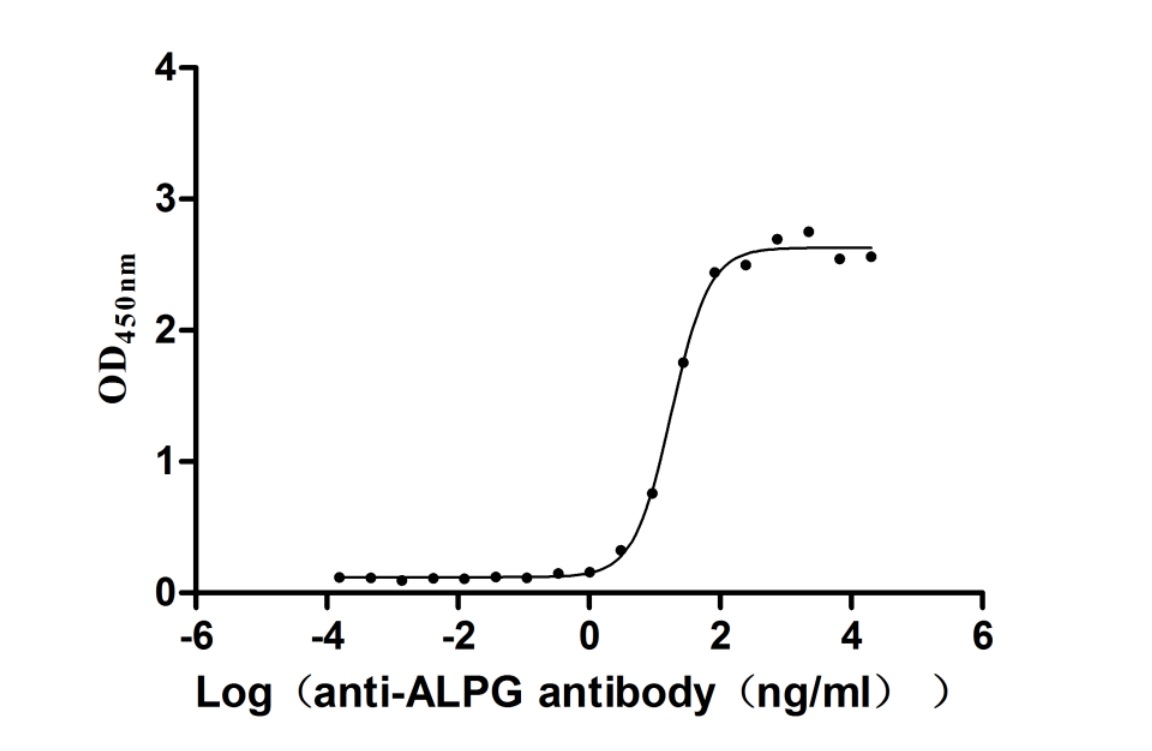
Immobilized Human ALPG at 2μg/mL can bind Anti-ALPG recombinant antibody (CSB-RA001633MA1HU). The EC50 is 14.09-23.17 ng/mL.
j9九游会登录入口首页 CUSABIO ALPG 抗体
ALPG Recombinant Monoclonal Antibody (Code: CSB-RA001633MA1HU)
参考文献:
[1] Flugel, Christian L., et al. "Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours." Nature Reviews Clinical Oncology 20.1 (2023): 49-62.
[2] Sharma, Ujjawal, Deeksha Pal, and Rajendra Prasad. "Alkaline phosphatase: an overview." Indian journal of clinical biochemistry 29 (2014): 269-278.
[3] Orimo, Hideo. "The mechanism of mineralization and the role of alkaline phosphatase in health and disease." Journal of Nippon Medical School 77.1 (2010): 4-12.
[4] Zhang, Hongyi, et al. "Recent progress of fluorescent probes for the detection of alkaline phosphatase (ALP): A review." Dyes and Pigments 194 (2021): 109569.
[5] Buchet, René, José Luis Millán, and David Magne. "Multisystemic functions of alkaline phosphatases." Phosphatase modulators (2013): 27-51.
[6] Bi, Yan, et al. "Identification of ALPPL2 as a naive pluripotent state-specific surface protein essential for human naive pluripotency regulation." Cell Reports 30.11 (2020): 3917-3931.
[7] Dudenkov, Tanda M., et al. "Anastrozole Aromatase Inhibitor Plasma Drug Concentration Genome‐Wide Association Study: Functional Epistatic Interaction Between SLC 38A7 and ALPPL 2." Clinical Pharmacology & Therapeutics 106.1 (2019): 219-227.
[8] Su, Yang, et al. "ALPPL2 is a highly specific and targetable tumor cell surface antigen." Cancer research 80.20 (2020): 4552-4564.
[9] Hyrenius-Wittsten, Axel, et al. "SynNotch CAR circuits enhance solid tumor recognition and promote persistent antitumor activity in mouse models." Science translational medicine 13.591 (2021): eabd8836.
[10] Hyrenius-Wittsten, Axel, et al. "Enhanced solid tumor recognition and T cell stemness with SynNotch CAR circuits." bioRxiv (2021): 2021-01.
[11] Shin, Hye-Su, et al. "Alppl2 is a potential diagnostic biomarker for pancreatic cancer-derived extracellular vesicles." Molecular Therapy-Methods & Clinical Development 15 (2019): 204-210.
[12] Dua, Pooja, et al. "Alkaline phosphatase ALPPL-2 is a novel pancreatic carcinoma-associated protein." Cancer research 73.6 (2013): 1934-1945.
[13] Dua, Pooja, Soyoun Kim, and Dong-ki Lee. "Alppl2 aptamer-mediated targeted delivery of 5-fluoro-2′-deoxyuridine to pancreatic cancer." nucleic acid therapeutics 25.4 (2015): 180-187.
[14] Li, Yuyang, Min Liu, and Songbo Xie. "Harnessing phage display for the discovery of peptide-based drugs and monoclonal antibodies." Current Medicinal Chemistry 28.40 (2021): 8267-8274.
[15] Liu, Shuang, et al. "High expression of ALPPL2 is associated with poor prognosis in gastric cancer." Human Pathology 86 (2019): 49-56.
[16] Lei, Sibei, et al. "ALPPL2‐binding peptide facilitates targeted mRNA delivery for efficient hepatocellular carcinoma gene therapy." Advanced Functional Materials 32.43 (2022): 2204342.
[17] Zhou, Shuchang, et al. "Present Status and Advances in Chimeric Antigen Receptor T Cell Therapy for Glioblastoma." Frontiers in Bioscience-Landmark 28.9 (2023): 206.
[18] Chen, Laurence C., Andrew J. Hou, and Yvonne Y. Chen. "Getting better mileage with logically primed CARs." Med 2.7 (2021): 785-787.
[19] Halder, Kuntal, et al. "Abstract A041: Extracellular vesicle based ALPPL2 and THBS2 as biomarkers for monitoring disease burden in patients with pancreatic cancer." Cancer Research 82.22_Supplement (2022): A041-A041.
[20] Lakhani, Nehal J., et al. "Phase 1 study of SGN-ALPV, a novel, investigational vedotin antibody–drug conjugate directed to ALPP/ALPPL2 in advanced solid tumors (SGNALPV-001, trial in progress)." (2022): TPS3159-TPS3159.











