VSIG4:B7家族共刺激分子,补体系统或肿瘤药开发创新靶点!
日期:2022-12-22 13:30:15
2022年11月28日,Cancer Letters杂志报道了一篇题为“The biology of VSIG4: Implications for the treatment of immune-mediated inflammatory diseases and cancer”文献综述 [1],该文章主要总结了VSIG4在巨噬细胞吞噬作用和免疫稳态方面的近期新发现,并讨论了其在感染、炎症和癌症中的潜在诊断和治疗用途。文章指出,VSIG4是一种特异性表达于巨噬细胞的B7家族相关蛋白,可结合细胞表面的受体分子有效地抑制T细胞的活化,也可作为补体受体并清除补体C3包被的病原体。目前,越来越多的数据证实,VSIG4的异常表达与多种肿瘤发展相关,如肺癌、胶质瘤和多发性骨髓瘤等等。
来自美国Verseau Therapeutics公司开发的VSIG4特异性抗体,其研究揭示靶向VSIG4能够诱导抑制性巨噬细胞向M1型极化。且无论是VSIG4抗体单用还是联合PD1抗体均能在临床前的小鼠肿瘤模型中看到抑瘤效果。目前,作为新近鉴定的对T细胞活化具有重要调控作用的B7家族共刺激分子,VSIG4已成为补体系统或肿瘤药开发创新靶点!
1. 什么是共信号分子B7家族?
B7家族是最早被证实在T细胞活化中起关键作用的共信号分子,B7家族现在至少包括10个成员,即B7-1/CD80、B7-2/CD86、B7-DC、B7-H1/PD-L1、B7-H2、B7-H3、B7-H4、B7-H5、B7-H6和B7-H7/HHLA2。1970年BRETSCHER和COHN提出了T细胞活化双信号模型:第一信号(抗原刺激信号)由TCR识别APC提呈的pMHC产生,使T细胞初步活化;第二信号(共刺激信号)由APC与T细胞表面的共刺激分子相互作用产生,使T细胞完全活化。两个信号协同作用才能诱导T细胞完全活化 [1-3]。
目前已知的共信号分子分为3个家族:B7家族(免疫球蛋白家族)、TNF家族(肿瘤坏死因子家族)和整合素家族。B7家族是最重要的共信号分子之一,在肿瘤细胞中广泛表达,且与肿瘤进展关联密切,它积极或消极地调节T细胞功能,对维持免疫调节和自身耐受至关重要。无论是单独治疗还是与其他疗法结合,B7家族被看作是“免疫治疗最有希望的靶点”(图1) [2]。
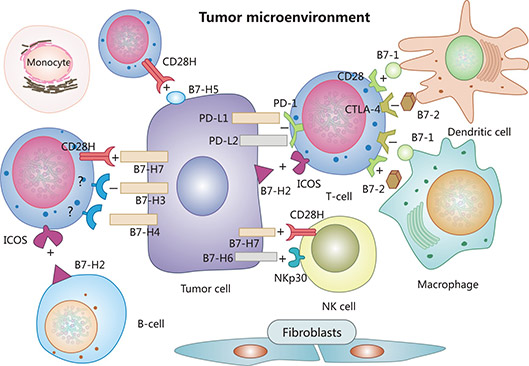
图1. B7家族蛋白和癌症 [6]
2. 什么是VSIG4?
VSIG4(V-set and immunoglobulin domain containing 4)是最新鉴定的B7家族共刺激分子,又称补体受体Ig超家族分子(CRIg),或免疫球蛋白超家族蛋白39(Z39Ig)。人和鼠VSIG4基因均定位于X染色体的Xq12,属于I型跨膜蛋白。人的VSIG4胞外区含有IgV和IgC2两种结构域,存在由25个氨基酸组成的跨膜区及细胞质尾(图2) [1, 4]。VSIG4作为新型B7家族相关蛋白,目前发现主要表达于组织静息巨噬细胞,其在维持免疫耐受、抗炎、宿主防御等免疫调控方面发挥着重要的作用,是固有免疫系统的关键组成部分。
研究发现,VSIG4和多种炎症性疾病存在关联性如神经系统疾病、I型糖尿病、肾脏疾病 [5-7]。此外,大量研究已证实VSIG4在肝癌、肺癌、卵巢癌、乳腺癌、胶质母细胞瘤和多发性骨髓瘤中过表达,可作为免疫检查点分子,或肿瘤独立预后因素 [8-9]。目前,已有多款靶向VSIG4在研临床药物,主要用于实体瘤治疗。因此,VSIG4将成为治疗炎症性疾病或多种肿瘤的新型靶标!
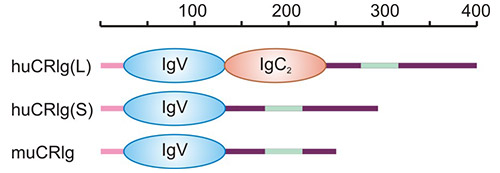
图2. 人或鼠VSIG4结构 [1]
3. VSIG4相关的作用机制
3.1 VSIG4作为T细胞抑制分子的作用
VSIG4可作为一种新的T细胞抑制分子,对于T细胞活化有着抑制作用。然而,VSIG4抑制T细胞的具体机制尚不明晰,现有的研究提示,1)VSIG4可能结合T细胞表面的尚未知的受体,导致T细胞活化抑制(图3);2)VSIG4和T细胞表面的CR1或CR3与它们的共配体C3b和iC3b结合,启动T细胞的抑制信号;3)VSIG4通过下调G1期的周期蛋白依赖性激酶,如CDK2、CDK4或CDK6,诱导G0/G1期阻滞,抑制T细胞的增殖 [10-12]。
比如,在VSIG4基因敲除的小鼠(VSIG4-/-)中,研究发现小鼠肾间质炎细胞浸润及小管损伤重程度均高于VSIG4正常表达(VSIG4+/+)组。同时,在VSIG4-/-组中,TGF-β1,IL-2、IFN-γ、IL-10、TNF-α的表达水平显著增高 [13]。在实验性自身免疫性葡萄膜炎(EAU)模型中,VSIG4-Ig融合,可导致T细胞所分泌的炎症细胞因子的减少,如IFN-γ,TNF-α,IL-6,IL-17 [13]。最新的研究认为,VSIG4的抑制作用不仅仅下调活化的T细胞应答,而是能够阻止T细胞在正常组织中的活化 [12]。
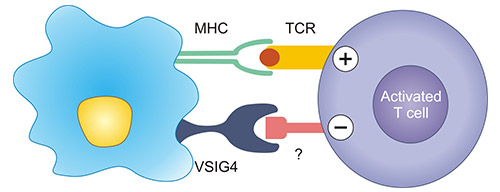
图3. VSIG4作为T细胞抑制分子的作用 [12]
3.2 VSIG4作为补体受体介导的吞噬作用
补体系统作为体内重要的效应系统和效应放大系统,通过作用于病原体表面,破坏病原体的细胞膜,调理病原体表面分子,而促巨噬细胞对病原体的吞噬作用。C3是补体调理素作用的核心,在不同蛋白酶的作用下,可降解生成为C3a和C3b片段。这些补体片段在病原体表面与补体受体结合,并诱导吞噬作用。VSIG4可和补体C3的降解片段C3b和iC3b等结合,是继CR1/CD35,CR2/CD21,CR3/CD18,CR4之后的第五个补体C3片段受体(图4) [12-15]。
研究证实,表达在巨噬细胞表面的VSIG4,能有效的清除C3调理的病原体,从而减少宿主的感染和死亡率。另有研究发现,VSIG4信号不仅能促进李斯特菌(Listeria Monocytogenes,LM)的捕获,还能够激活氯离子通道(Chloride Intracellular Channel 3, CLIC3),活化吞噬体从而促进胞内李斯特菌的清除 [16]。因此,VSIG4或可作为补体治疗剂,且不影响宿主对病原体的防御。
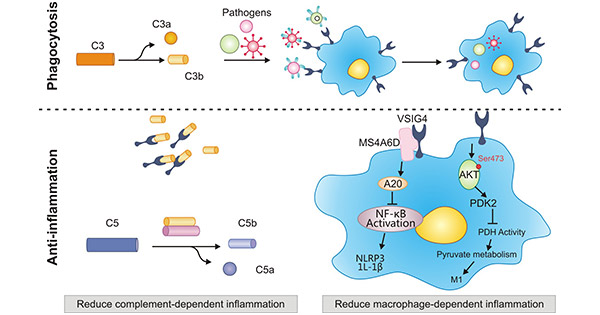
图4. VSIG4作为补体受体介导吞噬作用 [12]
3.3 VSIG4作为补体旁路途径的抑制剂作用
补体活化的过程主要包括经典途径、凝集素MBL途径和旁路途径三种途径的协作行动。补体旁路是补体系统活化的主要途径,因C3bBb二聚物和C3bC3bBb多聚体形成旁路途径的转化酶,可放大补体系统的激活。补体的活化可释放大量的补体片段,如C3a和C5a,它们是中性粒细胞和炎症巨噬细胞的趋化因子和激活剂 [12, 14]。
虽然补体活化有利于清除病原体,但是补体系统的过度活化也可能参与自身免疫疾病的发病。研究提示,VSIG4能够抑制旁路途径中C3转化酶及C5转化酶的活性,却不抑制经典途径中转化酶的活性 [12, 14]。因此,VSIG4可选择性的抑制旁路途径的激活,而不影响经典途径和MBL途径,这一发现可为针对补体活化旁路途经的靶向治疗提供可能。
4. VSIG4在肿瘤等疾病中的作用
VSIG4最初被认为是与人类智力障碍相关的基因,随后研究发现VSIG4可作为一种新型补体受体,同免疫黏附过程相互作用,成为清除病原体的关键受体。更为重要的是,大量研究已证实,在恶性肿瘤中,如肺癌、乳腺癌、卵巢癌等,VSIG4高表达,被认为是一种致癌基因。
4.1 VSIG4与肺癌
研究发现,通过构建Lewis肺癌细胞株诱导的小鼠肿瘤模型中,VSIG4缺陷的小鼠,其肿瘤生长明显小于野生型(VSIG4+/+)。针对肺癌组织样本,采用免疫组化的方法检测VSIG4表达,研究显示,VSIG4+细胞大量浸润。双重荧光染色显示,VSIG4存在于CD68+巨噬细胞中,但在CD3+T细胞、CD31+内皮细胞和CK-18+上皮细胞中不存在 [17]。
此外,当VSIG4转染人肾上皮细胞,VSIG4可结合T细胞上的未知受体,抑制CD4+和CD8+T细胞的增殖,以及细胞因子的产生,如IL-2和IFN-γ [17]。现有研究表明,VSIG4+肿瘤相关巨噬细胞可诱导肺癌的发展,提示VSIG4+肿瘤相关巨噬细胞参与到肿瘤的病理过程。因此,VSIG4的特异性靶向治疗可能是一种新的、有效的治疗癌症的方法。
4.2 VSIG4与卵巢癌
通过分析卵巢癌患者血液及组织中VSIG4的表达水平,研究人员发现,与良性肿瘤相比,VSIG4在卵巢癌组织中过表达,抑制了招募的T淋巴细胞的激活。此外,血浆中VSIG4的水平高于卵巢癌组织。研究人员认为,卵巢癌中可溶性VSIG4的增加,可导致C3b沉积增加,从而促进卵巢癌新生血管的形成,促进卵巢癌的进展。癌组织中VSIG4和血浆中VSIG4还与无疾病生存(DFS)相关 [6, 18]。因此,VSIG4可能是预测卵巢癌预后的潜在生物标志物,也可是卵巢癌免疫治疗的一个潜在靶点。
4.3 VSIG4与乳腺癌
有关生信分析提示,VSIG4与乳腺癌患者预后及M2型巨噬细胞浸润丰度显著相关,其受上游miR-29a-3p调控。研究通过TIMER和TISIDB分析肿瘤免疫特征,结果表明,M2型巨噬细胞与VSIG4具有较强的相关性。预后分析表明,VSIG4表达水平越高,M2型巨噬细胞浸润丰度越高,患者预后越差。
VSIG4相关的信号通路富集分析表明,VSIG4与细胞胞吞、细胞因子的生成和释放、Toll样受体及细胞黏附等通路显著相关。通过miRmap、miRanda、PITA预测工具,发现miR-29a-3p可调控VSIG4的表达,且对乳腺癌患者预后有显著影响 [19-20]。因此,VSIG4或可作为乳腺癌的潜在预后标志物。
4.4 VSIG4与胶质瘤
采用免疫组化组织芯片技术检测VSIG4在恶性胶质瘤和正常大脑中的表达,结果发现,与正常脑组织相比,高级别胶质瘤患者中的VSIG4表达量显著升高。进一步的研究提示,VSIG4的过表达能够诱导胶质母细胞瘤细胞发生上皮-间充质转化(EMT),并显著促进其侵袭和迁移,而且还促进了细胞中胶质瘤干细胞表型的形成。另有研究还发现,VSIG4可能通过T淋巴细胞功能缺失引起胶质瘤细胞免疫逃逸 [21-22]。
4.5 VSIG4与多发性骨髓瘤
通过对多例骨髓外活检标本分析,VSIG4高表达的总生存期(OS)显著低于VSIG4低表达组。通过VSIG4表达水平,对MM高危多发性骨髓瘤患者进行分层,提示VSIG4表达是OS预后不良的独立预测因子,也可能是MM抗癌免疫治疗候选靶点 [23]。
另有研究发现,蛋白激酶Cα(PKCα)可控制VSIG4的表达。此外,PKC信号通路与多发性骨髓瘤细胞的增殖有关。因此,PKC信号通路可能是多发性骨髓瘤(Multiple Myeloma,MM)中VSIG4过表达的原因,但其具体的机制需要进一研究 [24]。综上所述,通过VSIG4表达不仅可帮助患者进行预测预后及分层,还可作为多发性骨髓瘤的新靶标。
4.6 VSIG4与其它疾病
VSIG4的表达不仅在病原体的清除和肿瘤发展中发挥关键作用,而且与炎症性疾病也有着密切的联系,如多发性硬化症MS、炎症性肠炎、肾脏疾病、肝炎以及关节炎等 [25-26]。例如,在国际公认研究MS的EAE动物模型中,研究团队在EAE模型中加入自制VSIG4单克隆抗体激动性抗体VG11后,诱导了JAK2/STAT3/A20信号通路的激活,降低了NLRP3和IL-1β的表达 [27]。
而已有研究表明,抑制核因子NF-κB、NOD样受体蛋白3(NLRP3)和IL-1β表达,对小鼠多发性硬化症起到显著的治疗效果 [28-29]。因此,VSIG4可能够作为MS疾病治疗的新型靶点。EB病毒是一种与慢性肾脏疾病相关的疱疹肿瘤病毒,有研究表明VSIG4的表达能够通过LMP1/NF-κB信号通路在转录水平上调,推测VSIG4是慢性肾病和EB病毒感染LMP1阳性患者的潜在靶点 [30-31]。
5. VSIG4的临床应用前景
目前,陆续有国内外药企正开展以VSIG4为靶点的药物临床试验,用于实体瘤疾病治疗,包括沈阳三生制药、美国Verseau Therapeutics和Sensei Biotherapeutics Inc、韩国Kanaph Therapeutics Inc (表1)。当前研究主要聚焦在VSIG4在癌症发展方面所扮演的角色,Verseau Therapeutics官网披露的临床前数据显示,抗VSIG-4抗体(VTX-1218)可促进巨噬细胞的促炎极化,激活T细胞并吸引其他免疫细胞协同产生强大的抗肿瘤效应。
国内方面,三生制药早已获得VTX-1218的临床前抗体开发授权。此外,多项针对VSIG4的靶向药研究,正处在药物发现阶段,用于眼科、免疫调节、内分泌与代谢、胃肠道系统等疾病。VSIG4作为一种新型B7家族共刺激分子和C3补体受体,成为免疫治疗的新型靶点,将对肿瘤等疾病的药物开发带来新策略!
| 药品名称 | 靶点 | 适应症 | 全球最高研发阶段 | 研发企业 | 创新类型 |
|---|---|---|---|---|---|
| VTX-1218 | VSIg4 | 癌症;实体瘤 | 临床前 | 沈阳三生制药有限责任公司;Verseau Therapeutics Inc | 创新药 |
| SNS-VSIG4 | VSIg4 | 实体瘤 | 药物发现 | Sensei Biotherapeutics Inc | 创新药 |
| SNS-102 | VSIG4 | 癌症 | 药物发现 | / | 创新药 |
| C1.02 | Complement Complex;FLT1;KDR | 年龄相关性黄斑变性 | 药物发现 | / | 创新药 |
| undisclosed drug | VSIG4 | 自身免疫性疾病 | 药物发现 | Zhuhai-Fudan Innovation Institute | 创新药 |
| YBL-003 | VSIg4 | 癌症 | 临床前 | Y-Biologics Inc | 创新药 |
| undisclosed drug | VSIG4 | 1型糖尿病 | 药物发现 | / | 创新药 |
| undisclosed drug | VSIG4 | 癌症 | 药物发现 | / | 创新药 |
| undisclosed drug | VSIG4 | 癌症 | 药物发现 | / | 创新药 |
| SA-2290 | VSIG4 | 癌症 | 药物发现 | Y-Biologics Inc | 创新药 |
| A2.3 | VSIG4 | 大肠癌 | 药物发现 | / | 创新药 |
| VSIG-4 | VSIG4 | 肝胆疾病 | 药物发现 | / | 创新药 |
表1:VSIG4临床研究进展
为鼎力协助各药企针对VSIG4在炎症及肿瘤等疾病治疗领域上的研发,CUSABIO推出VSIG4活性蛋白产品(Code: CSB-MP896869HU,助力您在VSIG4机制方面的研究或其潜在临床价值的探索。
Recombinant Human V-set and immunoglobulin domain-containing protein 4(VSIG4),partial (Active)
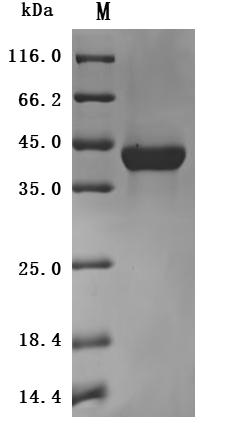
The purity was greater than 95% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
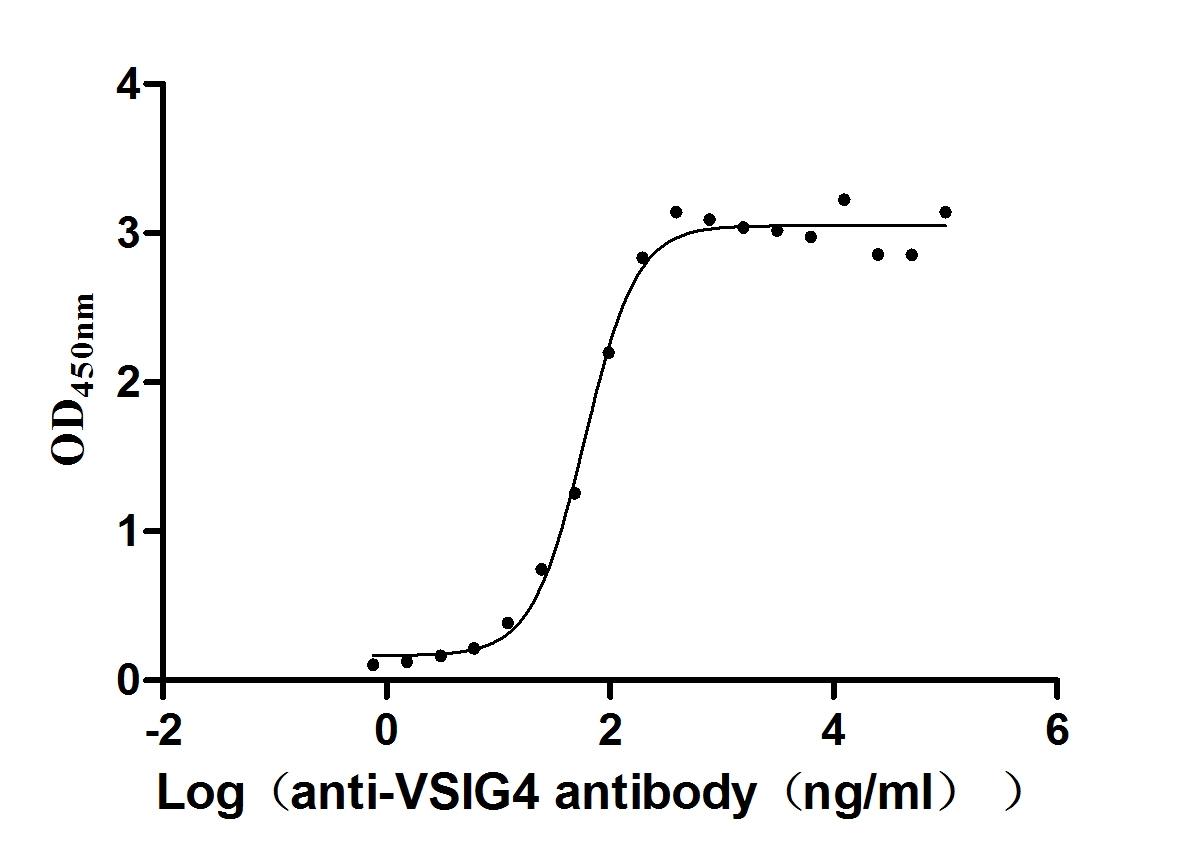
Immobilized Human VSIG4 at 2 μg/ml can bind Anti-VSIG4 recombinant antibody (CSB-RA896869MA1HU), the EC50 is 51.14-68.73 ng/mL.
参考文献:
[1] Liu B, Cheng L, Gao H, et al. The biology of VSIG4: Implications for the treatment of immune-mediated inflammatory diseases and cancer[J]. Cancer Letters, 2022: 215996.
[2] Ye Q, Liu J, Xie K. B7 Family proteins in cancer progression: Immunological and non-immunological functions[J]. Journal of Cancer Treatment and Diagnosis, 2019, 3(4).
[3] Amir Taghavi B, Alizadeh N, Saeedi H, et al. Targeted Therapy of B7 Family Checkpoints as an Innovative Approach to Overcome Cancer Therapy Resistance: A Review from Chemotherapy to Immunotherapy[J]. Molecules, 2022, 27(11): 3545.
[4] Al-Yassin G A, Bretscher P A. Does T cell activation require a quorum of lymphocytes?[J]. The Journal of Immunology, 2018, 201(10): 2855-2861.
[5] Han S Y, Ghee J Y, Cha J J, et al. Upregulation of VSIG4 in Type 2 Diabetic Kidney Disease[J]. Life, 2022, 12(7): 1031.
[6] Byun J M, Jeong D H, Choi I H, et al. The significance of VSIG4 expression in ovarian cancer[J]. International Journal of Gynecologic Cancer, 2017, 27(5).
[7] Hall B M, Gleiberman A S, Strom E, et al. Immune checkpoint protein VSIG4 as a biomarker of aging in murine adipose tissue[J]. Aging Cell, 2020, 19(10): e13219.
[8] Kim S W, Roh J, Lee H S, et al. Expression of the immune checkpoint molecule V-set immunoglobulin domain-containing 4 is associated with poor prognosis in patients with advanced gastric cancer[J]. Gastric Cancer, 2021, 24(2): 327-340.
[9] Sazinsky S, Nguyen A, Zafari M, et al. Abstract P105: Targeting VSIG4, a novel macrophage checkpoint, repolarizes suppressive macrophages which induces an inflammatory response in primary cell in vitro assays and fresh human tumor cultures[J]. Molecular Cancer Therapeutics, 2021, 20(12_Supplement): P105-P105.
[10] Zhou X, Khan S, Huang D, et al. V-Set and immunoglobulin domain containing (VSIG) proteins as emerging immune checkpoint targets for cancer immunotherapy[J]. Frontiers in Immunology, 2022, 13.
[11] Vogt, Lorenz, et al. "VSIG4, a B7 family–related protein, is a negative regulator of T cell activation." The Journal of clinical investigation 116.10 (2006): 2817-2826.
[12] Li, Yan, et al. "Costimulatory molecule VSIG4 exclusively expressed on macrophages alleviates renal tubulointerstitial injury in VSIG4 KO mice." journal of nephrology 27.1 (2014): 29-36.
[13] Chen, Mei, et al. "Inhibition of the alternative pathway of complement activation reduces inflammation in experimental autoimmune uveoretinitis." European journal of immunology 40.10 (2010): 2870-2881.
[14] Kim, Kwang H., et al. "Extracellular stimulation of VSIG4/complement receptor Ig suppresses intracellular bacterial infection by inducing autophagy." autophagy 12.9 (2016): 1647-1659.
[15] Li, Jialin, et al. "VSIG4 inhibits proinflammatory macrophage activation by reprogramming mitochondrial pyruvate metabolism." nature communications 8.1 (2017): 1-14.
[16] Kim, Kwang H., et al. "CRIg signals induce anti-intracellular bacterial phagosome activity in a chloride intracellular channel 3-dependent manner. "European journal of immunology 43.3 (2013): 667-678.
[17] Liao, Yunmei, et al. "VSIG4 expression on macrophages facilitates lung cancer development." laboratory investigation 94.7 (2014): 706-715.
[18] Tan, Qianxia, et al. "Integrated analysis of tumor-associated macrophage infiltration and prognosis in ovarian cancer." Aging (Albany NY) 13.19 (2021): 23210.
[19] Cao, Jian, et al. "Abstract# 2227: Cancer-related invasive gene (CRIG): A key component of breast cancer metastasis." Cancer Research 69.9_Supplement (2009): 2227-2227.
[20] Song WJ, et al. "VSIG4 expression in breast cancer and its correlation with immune infiltration and prognosis." Oncology Control Research 48.5 (2021): 489-496.
[21] Xu, Tao, et al. "VSIG4 is highly expressed and correlated with poor prognosis of high-grade glioma patients." american journal of translational research 7.6 (2015): 1172.
[22] Zhang, Xin-Hua, et al. "Let-7g-5p inhibits epithelial-mesenchymal transition consistent with reduction of glioma stem cell phenotypes by targeting VSIG4 in glioblastoma." Oncology Reports 36.5 (2016): 2967-2975.
[23] Roh, Jin, et al. "The immune checkpoint molecule V-set Ig domain-containing 4 is an independent prognostic factor for multiple myeloma." Oncotarget 8.35 (2017): 58122.
[24] Ma, Yuefang, et al. "Protein kinase Cα regulates the expression of complement receptor Ig in human monocyte-derived macrophages." The Journal of Immunology 194.6 (2015): 2855-2861.
[25] Zhang, Dongzhu, et al. "VSIG4 alleviates intracerebral hemorrhage induced brain injury by suppressing TLR4-regulated inflammatory response." Brain Research Bulletin 176 (2021): 67-75.
[26] Liu, Bei, et al. "The biology of VSIG4: Implications for the treatment of immune-mediated inflammatory diseases and cancer." Cancer Letters (2022): 215996.
[27] Huang, Xiaoyong, et al. "VSIG4 mediates transcriptional inhibition of Nlrp3 and Il-1 β in macrophages." science advances 5.1 (2019): eaau7426.
[28] Lee, A., et al. "Fucoxanthin from microalgae Phaeodactylum tricornutum inhibits pro-inflammatory cytokines by regulating both NF-κB and NLRP3 inflammasome activation." Scientific reports 11.1 (2021): 1-12.
[29] Shao, Shuai, et al. "Therapeutic potential of the target on NLRP3 inflammasome in multiple sclerosis." Pharmacology & Therapeutics 227 (2021): 107880.
[30] Zeng, Mei, et al. "The anti-apoptotic role of EBV-LMP1 in lymphoma cells." Cancer Management and Research 12 (2020): 8801.
[31] Kim, Seung-Mi, et al. "Epstein-Barr virus-encoded latent membrane protein 1 induces epithelial to mesenchymal transition by inducing V-set Ig domain containing 4 (VSIG4) expression via NF-kB in renal tubular epithelial HK-2 cells." biochemical and biophysical research communications 492.3 (2017): 316-322.
上一篇: 单克隆抗体药物综述











