ALPi——肠粘膜屏障保镖
日期:2022-09-19 15:40:00
碱性磷酸酶:
碱性磷酸酶(Alkaline phosphatase,AKP/ALP/AP)是一种单脂磷酸水解酶 ,广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织中,经肝脏向胆外排出,参与人体的能量代谢。碱性磷酸 酶属于同源二聚体,共有四种同功酶,其包含主要分布于肝脏、骨骼和肾脏组织中的非特异性同工酶,以及分 布在特定组织中的组织特异性磷酸酶,包括分布于肠粘膜的肠碱性磷酸酶(Intestin alalkaline Phosphatase, ALPi)、分布于胎盘的胎盘碱性磷酸酶(Placental alkaline phosphatase,PLAP)和分布在人 类生殖系统内的生殖细胞碱性磷酸酶(Germcell alkaline phosphatase,GCAP)[1]。
1、什么是ALPi?
肠碱性磷酸酶(Intestinal alkaline phosphatase, ALPi) 位于肠粘膜的刷状边缘,能够水解单磷酸脂,是一种由肠上皮细胞表达的内源性蛋白质,不仅在粘膜 和肠腔内保持活性,而且分泌到血清后也能保持活性,对维持肠道内环境平衡起到重要作用。由荷兰生物制药 公司AM-Pharma赞助的Peters和Lukas进行的临床研究已证实当人和动物从肠道吸收内毒素时,ALPi对内毒素进 行充分灭活,使其失去大部分活性。因此ALPi可以用于针对内毒素相关败血症肾损伤和结肠炎中炎症的新方法 [2,3]。
2、ALPi与肠黏膜屏障作用机制
研究显示,各种紧密连接蛋白的低表达可损害肠粘膜屏障功能,进而影响肠 粘膜通透性。肠道细菌、内毒素、炎性介质等会通过受损的肠粘膜屏障进入内环境,导致更多炎性介质的释放 ,激活全身炎症反应综合征的进程,循环损害肠粘膜屏障功能,最终导致多脏器功能衰竭的发生。而ALPi可以 诱导闭锁小带蛋白1(Zonulaoccludens-1, ZO-1)、闭锁小带蛋白2(Zonulaoccludens-2, ZO-2)、闭锁蛋白(Occludin),水 闸蛋白(Claudin)表达水平的升高,增强肠粘膜屏障功能。
2.1 ALPi维护肠黏膜机械屏障
肠道机械屏障作为肠黏膜屏障重要的一部分,其肠上皮细胞间紧密连接蛋白 发挥着重要的作用,而ALPi在维持细胞间紧密连接发挥作用。
Rentea等研究发现,坏死性小肠结肠炎大鼠幼崽肠道对大分子物质的通透 性增加约15倍,给予低剂量外源性牛ALPi后,其肠道通透性得到明显改善 [4]。Hamarneh等首先通 过研究ALPi基因敲除小鼠和野生型小鼠,结果发现基因敲除小鼠紧密连接蛋白表达量较野生型小鼠低,证实肠道 屏障受损与ALPi表达缺失相关 [5]。说明ALPi在肠黏膜机械屏障维护发挥着重要作用。但是目前的 数据仅依据于实验结果,对ALPi,和黏膜屏障以及蛋白间的信号通路影响机制尚不明确,仍需进一步研究。
2.2 ALPi支持肠黏膜免疫屏障
肠道免疫屏障由获得免疫和固有免疫两部分构成, 免疫球蛋白A (immuno globulinA, IgA)和抗菌肽及黏蛋白分别构成获得免疫和固有免疫的重要效应分子和活性成分。人体肠道中存在 大量的革兰阴性细菌, 脂多糖(lipo poly saccharide, LPS)作为革兰阴性细菌细胞壁重要组成部分,是引发肠 道炎症反应的重要因素。Bates等和Bentala等的研究发现ALPi可通过激活肠上皮细胞Toll样受体(Toll-likereceptors, TLR4)基因表达,识别革兰氏 阴性细菌外膜中的LPS并诱导宿主进行免疫应答和损伤修复,巨噬细胞募集(级联诱导嗜中性粒细胞)激活诱导核 因子-κB(nuclear factor kappa-B, NF-κB)和TLR3基因, 并通过MyD88依赖途径抑制炎症性细胞因 子白细胞介素(interleukin, IL-1)、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、IL-6和IL-12 的表达, 从而抵抗肠道感染。TLR4的大量激活可能进一步抑制了TNF-α的表达, 抑制LPS诱导的炎症反应 ,从而降低LPS的毒性 [6,7]。Hwang等研究发现也表明,ALPi通过TLR4/NF-κB介导途径维 护肠黏膜屏障功能的正常 [8]。上述研究结果表明,ALPi可通过催化LPS去磷酸化,间接地介导肠 道炎性反应的下调,从而参与肠黏膜免疫屏障功能的维护和调节(如图1)。
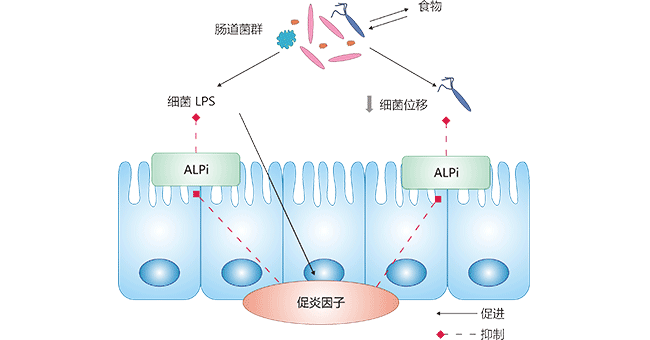
图1. 刷状缘ALPi对肠道菌群和LPS诱导的炎症的释放的作用机制
图片源自:DOI:10.11569/wcjd.v27.i23.1441
2.3 ALPi调节肠黏膜化学屏障
作为肠黏膜屏障中重要的一部分,化学屏障受损也会增加肠道炎症的易感性 。ALPi主要在十二指肠中表达,可以调节肠道内碳酸盐的分泌情况,借此改变十二指肠表面的PH值,使影响体 内炎症的微生物组环境得到改善。Mizumori等研究发现, 当黏膜表面pH值>8,ALPi表达量及酶的活性最高, 当黏膜表面pH较低时, ALPi所具有的ATP酶活性降低。提示ALPi作为肠道pH调节的碱性传感器,在调节肠黏膜化 学屏障、在改善肠内酸碱环境维持肠道稳态, 维持肠黏膜屏障功能的关键作用。
2.4 ALPi增强肠黏膜生物屏障
肠粘膜生物屏障的完整对维持肠道内生物菌落有着重要的意义,已有研究表 明猪肠道细菌定植前后,肠道ALPi表达水平并无明显变化,而在小鼠和大鼠肠道细菌定植后,ALPi的表达水平 降低 [9]。
而给小鼠口服大肠杆菌,构建腹膜炎生物模型,然后用ALPi干预后检测细菌 移植的情况,结果证明ALPi可以抑制小鼠的腹膜炎恶化和细菌移植情况。, 检测细胞外调节蛋白激酶 (ERK) 磷 酸化水平和ERK-特异性蛋白-1 (SP-1) -血管内皮生长因子 ( VEGF) 和ERK-尾型同源异型核基因2 (Cdx-2) -紧 密连接蛋白2(Claudin-2)等信号通路蛋白的表达水平,发现ALPi抑制Claudin-2和VEGF表达,降低黏膜通透性抑 制菌群位移来增强肠粘膜生物屏障。
3、ALPi对MLCK/pMLC信号通路的影响
MLCK/pMLC信号通路是炎症相关的信号通路,可以被肿瘤坏死因子-α( TNF-α)激活,导致紧密连接结构和组成的分子重组,引起闭锁蛋白(Occludin)内吞。为了研究ALPi对 TNF-α诱导的Caco-2细胞的屏障功能损害的抑制作用机制,刘翀等人研究了ALPi对炎症相关MLCK/pMLC信 号通路的影响。Caco-2细胞中的MLCK和pMLC蛋白的表达,在TNF-α作用下明显升高(p<0.01)。而加 入ALPi后,与TNF-α组比较,IAP+TNF-α组显著抑制了MLCK(p<0.01)和pMLC(p<0.05)蛋 白的表达水平(图2)。以上结果表明,ALPi抑制了TNF-α诱导的MLCK/pMLC信号通路的激活,抑制了炎症 反应的发生。
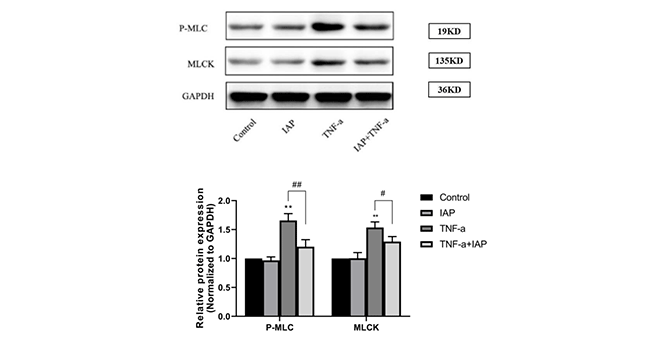
图2. IAP对MLCK/pMLC信号通路的影响
**,与对照组相比,p<0.01;#,与TNF-α组相比,p<0.05;##,与TNF-α组相比,
p<0.01
图片源自:https://cdmd.cnki.com.cn/Article/CDMD-10159- 1022424869.htm
此外,由于L-PHE是ALPi特异性的抑制剂,经实验证明ALPi能够通MLCK/pMLC信号通路,调节紧密连接蛋 白ZO-1、Occludin和Claudin-1紧密连接蛋的表达,从而降低TNF-α对Caco-2细胞屏障功能的损害。
4、ALPi与疾病的关系
4.1 肠碱性磷酸酶与肠粘膜屏障相关疾病
炎症性肠病(Inflammatory bowel disease,IBD)是累及肠道的一类特发性 肠道炎症性疾病。肠源性细菌抗原引起的黏膜免疫应答参与炎症性肠病的发病机制,Toll样受体配体--尤其是 脂多糖(LPS)对该病的维持起着重要作用,已有研究表明肠碱性磷酸酶能够解毒LPS。对IBD小鼠经口喂食外源性 的ALPi,可以在肠上皮细胞和巨噬细胞中诱导自噬,降低肠粘膜通透性,从而起到明显的治疗作用 [10] 。
4.2 肠碱性磷酸酶与坏死性小肠结肠炎
目前,ALPi在治疗炎症性肠病等方面应用前景十分广阔。从牛小肠提取的碱 性磷酸酶(Bovines Intestinal Alkaline Phopaatase,bALPi)是最常用的商品化ALPi。坏死性小肠结肠炎( Necrotizingenterocolitis,NEC)病因复杂,Rentea等人研究发现补充ALPi可以降低NEC损伤的严重程度 [11]。
4.3 肠碱性磷酸酶与急性肾损伤
动物实验表明,肾器官缺血损伤后,肾脏中的磷酸酶活性降低 [12] 。因ALPi对LPS有抑制作用,可以改善急性肾损伤(AKI)。对脓毒症诱导的急性肾损伤(AKI)患者或败 血病患者在AKI发病后48小时内静脉输注碱性磷酸酶,能显著改善肾功能,如血浆肌酐值下降和肌酐清除率升高 ,相关的接受ALPi治疗的患者可以减少透析的持续时间.
4.4 肠碱性磷酸酶与代谢类疾病
Madhu等人发现,与野生型小鼠相比,ALPi基因敲除小鼠肠道内需氧菌和厌氧 菌的数量有所减少。当基因敲除小鼠口服ALPi后,其肠道菌群基本正常化 [13]。KaliannanK等人 通过实验研究得到ALPi还与代谢性疾病有关的结论 [14]。Bhan等通过敲除小鼠ALPi基因,发现缺 乏ALPi的动物会患上2型糖尿病和高脂血症 [15],提示ALPi可能与糖尿病、高血脂等代谢性疾病相 关。美国弗吉尼亚联邦大学的研究人员研究发现IAP的过表达可以通过维持肠道黏蛋白层的完整性来改善肠屏障 功能,进而限制肠源性LPS的易位,并减弱肠道对脂质的吸收,由此减弱高脂肪和高胆固醇食物引起的动脉粥样 硬化的发展。证明ALPi的表达增加可以对肠道屏障功能和代谢性疾病的发展起到直接的保护作用
5. CUSABIO公司ALPi相关产品
High Purity Validated by Western Blot
Excellent Bio-activity
Unit Definition: One unit is defined as the amount of enzyme required to cleave 1 nmol p-nitro-phenylphosphate(pNPP), in 1 minute at 37°C, pH10.0. The specific activity is > 10370.37 U/mg.
High Purity Validated by Western Blot
Excellent Bio-activity
Unit Definition: One unit is defined as the amount of enzyme required to cleave 1 nmol p-nitro-phenylphosphate (pNPP), in 1 minute at 37°C, pH10.0. The specific activity is > 8836.463 U/mg.
Recombinant Rat Intestinal-type alkaline phosphatase 1(ALPi)
Recombinant Rat Intestinal-type alkaline phosphatase 1(ALPi) (Active)
Recombinant Human Intestinal-type alkaline phosphatase (ALPi)
Recombinant Human Intestinal-type alkaline phosphatase(ALPi),partial
参考文献:
[1] Tang W, Huang J, Huang X, et al. Effect of alkaline phosphatase on sepsis- associated acute kidney injury patients: A systematic review and meta-analysis[J]. Medicine. 2020, 99(4): 87-8.
[2] Peters E, Mehta R L, Murray P T, et al. Study protocol for a multicenter randomised controlled trial: Safety, Tolerability, efficacy and quality of life of a human recombinant alkaline Phosphatase in patients with sepsis-associated Acute Kidney Injury (STOP- AKI)[J]. BMJ Open, 2016,6(9): e012371.
[3] Lukas M, Drastich P,Konecny M, et al. Exogenous alkaline phosphatase for the treatment of patients with moderate to severe ulcerative colitis[J]. Inflammatory Bowel Diseases ,2010, 16(7): 1180-1186.
[4] Rentea RM, Liedel JL, Welak SR, Cassidy LD, Mayer AN, Pritchard KA Jr, Oldham KT, Gourlay DM. Intestinal alkaline phosphatase administration in newborns is protective of gut barrier function in a neonatal necrotizing enterocolitis rat model[J]. . J Pediatr Surg 2012; 47: 1135-1142.
[5] Hamarneh SR, Mohamed MM, Economopoulos KP, Morrison SA, Phupitakphol T, Tantillo TJ, Gul SS, Gharedaghi MH, Tao Q, Kaliannan K, Narisawa S, Millán JL, van der Wilden GM, Fagenholz PJ, Malo MS, Hodin RA. A novel approach to maintain gut mucosal integrity using an oral enzyme supplement[J]. . Ann Surg 2014; 260: 706-14; discussion 714-5 [PMID: 25203888 DOI: 10.1097 / SLA. 0000000000000916]
[6] Rietschel ET,Seydel U,Zahringer U,et al. Bacterial endotoxin: molecular relationships between structure and activity[J]. Infectious disease clinics of North America, 1991, 5( 4): 753-779.
[7] Bentala H, Verweij WR, Huizinga VVA,et al. Removal of phos- phate from lipid a as a strategy to detoxify lipopolysaccharide[J]. Shock, 2002, 18( 6): 561-566.
[8] Cario E. Bacterial interactions with cells of the intestinal mucosa[J]. toll-like receptors and NOD2. Gut, 2005, 54( 8): 1182-1193.
[9] Lalles JP. Intestinal alkaline phosphatase: novel functions and protective effects [J]. Nutrition Reviews, 2014, 72( 2): 82-94.
[10] Singh SB, Carroll-Portillo A, Coffman C, et al. Intestinal Alkaline Phosphatase Exerts Anti-Inflammatory Effects Against Lipopolysaccharide by Inducing Autophagy [J].Scientific Reports. 2020,10(1):310-7
[11] Rentea R, Rentea M, Biesterveld B, et al. Factors Known to Influence the Development of Necrotizing Enterocolitis to Modify Expression and Activity of Intestinal Alkaline Phosphatase in a Newborn Neonatal Rat Model[J].European Journal of Pediatric Surgery. 2019, 29 (3): 290-7.
[12] Bhatt GC, Gogia P, Bitzan M, et al. Theophylline and aminophylline for prevention of acute kidney injury in neonates and children: A systematic review[J]. Arch Dis Child. 2019, 104(7): 670-9.
[13] Malo MS,Moaven O,Muhammad N, et al. Intestinal alkaline phosphatase promotes gut bacterial growth by reducing the concentration of luminal nucleotide triphosphates [J]. Ajp Gastrointestinal & Liver Physiology,2014,306(10):G826.
[14] Kaliannan K,Robertson RC,Murphy K,et al. Estrogen-mediated gut microbiome alterations influence sexual dimorphism in metabolic syndrome in mice[J]. Microbiome,2018, 6(1) :205.
[15] Bhan A,Alam SN,Raychowdhury A,et al. Intestinal alkaline phosphatase prevents metabolic syndrome in mice[J]. Proc Natl Acad Sci USA, 2013, 110(17): 7003-7008.











