ZG16B:一种新发现的癌基因,向胰腺癌发起挑战!
日期:2022-09-05 10:30:32
ZG16B是近来研究人员采取DNA芯片及核酸点阵分析发现的一种新型癌基因。ZG16B最早发现其在胰腺癌中高表达,因而被命名为胰腺癌相关上调因子(Pancreatic adenocarcinoma upregulated factor,PAUF)。由于胰腺癌通常不具有免疫原性,因而免疫治疗药物在胰腺癌患者中未取得很大的进展。其次,胰腺癌早期侵袭转移和耐药是影响其临床治疗效果的主要原因。因此,探索胰腺癌的新兴靶点和药物,对其治疗意义重大。目前,大量研究揭示,ZG16B在卵巢癌、乳腺癌、结肠癌、宫颈癌中异常表达,尤其是胰腺癌,使得ZG16B成为具有潜力的肿瘤诊断的生物标记物,甚至是治疗靶点。目前,已有多款ZG16B抗体药物处于临床阶段,主要用于胰腺癌和卵巢癌治疗,这将对患者的治疗选择提供重要帮助!那么,ZG16B的调节机制是怎样的?它在胰腺癌治疗中的进展如何?今天我们一起来了解下。
1、什么ZG16B?
酶原颗粒蛋白16B(Zymogen granule protein 16 homolog B,ZG16B)是新近发现的癌基因,属于ZG16A的旁系同源物 [1]。有研究揭示,ZG16B是含有一个p-棱镜结构的哺乳动物凝集素,这种结构具有调控细胞黏附、转移、凋亡、血管生成以及细胞与细胞间相互作用来识别病原体的能力(图1) [2,23]。ZG16B位于人类染色体16p13.3基因位点,为全长721 bp cDNA的序列,并含有196个氨基酸的开放读码框区,它的核酸结构与人类唾液蛋白类似 [3]。ZG16B最早发现在胰腺癌中高表达并起重要致癌作用,进而被鉴定为胰腺癌上调因子(PAUF,pancreaticadenocarcinoma upregulated factor)。在胰腺癌中,ZG16B通过激活CXCR4、β-catenin、TPL2/MEK/ERK、FAK/Scr等信号通路,促进胰腺癌血管生成,调控胰腺癌细胞的迁移 [1-2]。
近年研究证实,ZG16B不仅在胰腺癌细胞中高表达,其表达也见于乳腺癌、胃癌、结肠癌、卵巢癌,对肿瘤细胞的增殖、粘附、迁移、侵袭起着重要作用 [1-4]。ZG16B作为新发现的人内皮细胞的激活剂,具有和血管内皮生长因子(VEGF)相似的作用,能够在体内外促进血管生成,增加血管的通透性 [3]。然而,ZG16B作为胰腺癌的特殊因子,研究发现ZG16B通过TLR4信号通路促进DCs活化成熟,介导免疫系统激活;同时,它还可以激活MDSCs,促进肿瘤发展,对免疫治疗具有双重作用 [5-7]。
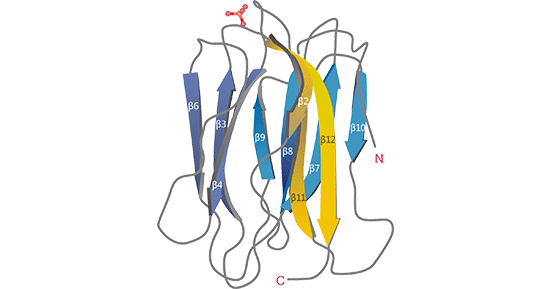
图1. ZG16B的晶体结构示意图 [23]
2、ZG16B相关的调节机制
目前,关于ZG16B在胰腺癌的研究中,其促进癌细胞发生及发展的具体机制可能与下列途径有关:
ZG16B激活CXCR4信号通路。在很多类型的恶性肿瘤中CXCR4在器官特异性的转移过程中起到重要作用。当ZG16B过表达,诱导激活调节激酶(ERK)、JNK、蛋白激酶信号(AKT)等途径,最终使大多数下游的转录因子活性增高而增加CXCR4的转录。而ZG16B失表达后CXCR4信号通路被抑制(图2) [8]。
ZG16B活化β-catenin信号通路。β-catenin是细胞增殖、分化以及致瘤性相关的典型Wnt信号途径中的关键作用分子。ZG16B表达诱导β-catenin的ser-33/37/Thr-41以及ser-675的磷酸化来激活Akt/GSK-3β信号通路,然后β-catenin被转运到细胞核内,与转录因子的T细胞因子/淋巴结增强因子(TCF/LEF)家族形成一个复合体。这种复合体能够激活β-catenin反应基因的表达来加快胰腺癌细胞的增殖 [9]。
ZG16B可激活TLR2介导的TPL2/MEK/ERK信号通路。TOLL样受体TLRs在免疫系统中发挥极其关键的作用。ZG16B是TLR2和TLR4的配体,可以激活TLR2介导的TPL2/MEK/ERK信号途径,并通过引起胰腺癌细胞核转录因子AP-1的表达增加,产生促癌细胞因子;当ZG16B-CXCR4-TLR2下游感应器蛋白激酶A(PKA)被激活时,可以抑制TLR2诱导的NF-κB的激活,从而减少免疫细胞的分化,增殖和活化。因此,ZG16B能够促进胰腺癌细胞的生长,以及逃避免疫系统的监视 [10]。
ZG16B激活FAK信号。FAK是一种没有受体的酪氨酸酶,它与多种细胞功能相关。ZG16B能够激活FAK-Src途径来控制胰腺癌细胞的黏附性,不论是特定的ZG16B抗体还是FAK信号途径的抑制剂,都可有效地阻断ZG16B介导的黏附性的增加。ZG16B还可以调节FAK通路而使胰腺癌细胞凋亡受抑制 [11]。
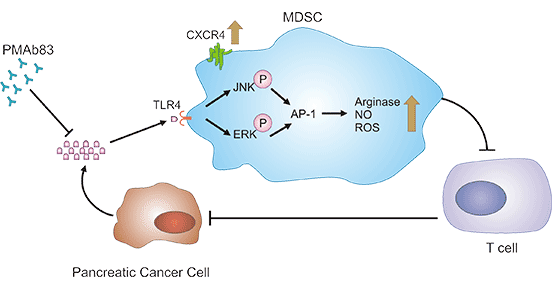
图1. ZG16B相关的信号通路 [8]
3、ZG16B在肿瘤治疗中的作用
3.1 ZG16B与胰腺癌
胰腺癌是消化道常见恶性肿瘤之一,其唯一的治疗选择仅限于手术切除联合辅助化疗。然而,当确诊时往往已处于晚期或转移阶段,手术将无法进行,只有10%至15%的患者适合手术切除。辅助化疗作为治疗胰腺癌的基本治疗方案,在胰腺癌的综合治疗中扮演了重要的角色。但化疗对胰腺癌的总体效果却始终不理想。吉西他滨(Gemcitabine)是目前FDA批准的唯一可以用于治疗胰腺癌的化疗药物,目前只有不到25%的胰腺癌患者对吉西他滨化疗敏感。有数据显示,吉西他滨仅提高患者2周的生存时间。
新近研究表明,通过尾静脉向具有胰腺癌移植瘤的裸鼠体内注射ZG16B抑制剂或者敲除胰腺癌细胞ZG16B基因,能够明显降低移植瘤的增殖、转移及进展过程 [12]。事实上,首个胰腺癌上调因子单抗Ulenistamab(PBP1510),已处于临床2期阶段,用于胰腺癌治疗。针对ZG16B的靶向药物,有望为ZG16B/PAUF阳性的胰腺癌患者提供显著益处。
3.2 ZG16B与卵巢癌
卵巢癌是最致命的生殖系统恶性肿瘤,因为大多数患者被诊断时为晚期,其中不到三分之一的患者在首次诊断后可以存活超过5年。针对肿瘤相关抗原PD-1和PD-L1、VEGF和PARP抑制剂在某些癌症免疫治疗中取得了巨大成功,但在部分癌症环境中受限,如卵巢癌和胰腺癌。手术和化学疗法仍然是目前卵巢癌的重要治疗手段,实现早期诊断、提高疗效、降低化疗的耐药性在卵巢癌治疗中具有重要的临床意义。
在卵巢癌OVCAR-5细胞系中,高表达的ZG16B促进了肿瘤的迁移、侵袭和转移能力,诱导Src、ERK、AKT相关信号通路激活。敲除ZG16B基因,癌细胞的迁移和侵袭能力显著降低。在人卵巢癌模型中,一种新设计的人源化抗ZG16B抗体明显减缓了卵巢肿瘤的生长。此外,多西紫杉醇(Docetaxel)和抗ZG16B的联合用药,在所有治疗组中达到了最均匀的抗肿瘤效果。这一结果表明抗ZG16B治疗可作为细胞毒类抗肿药物的敏化剂 [4]。
3.3 ZG16B与乳腺癌
乳腺癌是女性最常被诊断出的癌症。根据雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,临床上将乳腺癌分为4种分子亚型:luminal A型(ER/PR, HER2-)、luminal B型(ER/PR, HER2)、HER2过表达型(ER-/PR-/HER2)和basal-like型(ER-/PR-/HER2-)。在以往的研究中,已经开发出多种与乳腺癌早期诊断和预后相关的常规生物标志物,如uPA,Rs/DJ-1和PAI-1。最近,uPAR、KiSS1、CD24等也被认为与乳腺癌的发展密切相关。通过STRING分析和Oncomine共表达分析,发现ZG16B与许多乳腺癌诊断、转移和预后的生物标志物具有相关性,包括S100PBP、FOXA1、PRR4、ANKEF1、EPCAM、SPDEF、KRT8、KRT19、KIAA1324、CXCR4、AGR2、SCNN1A、SPINT1、TFAP2A、AP1M2、CLDN4和ERBB3。
其中,SPINT1是Kunitz型丝氨酸蛋白酶抑制剂之一,又名HAI-1,可通过调节HGFA、matriptase和hepsin抑制肝细胞生长因子功能,从而抑制乳腺癌的迁移、增殖和侵袭;TFAP2A,又称AP-2-α,是一种调节乳腺分化和增殖的转录因子,其通过调节多种miRNA抑制细胞周期,促进细胞凋亡,抑制乳腺癌的侵袭;高表达的FOXA1通过缓解上皮间质转化过程,抑制细胞迁移,侵袭和转移,与乳腺癌的良好预后相关。这些与ZG16B共表达的基因,它们的相互作用表明,ZG16B或可作为乳腺癌的潜在生物标志物 [1]。
3.4 ZG16B与其它肿瘤
有报道指出,ZG16B可作为结直肠癌、前列腺癌、口腔鳞状细胞癌的早期诊断和预后的生物标志物,其高表达可增强细胞的迁移和侵袭,导致预后不良 [1,14-16]。ZG16B也被证实在宫颈癌HeLa细胞中上调 [17-18]。另有研究提示,ZG16B与动脉粥样硬化和急性冠状动脉综合征的预后相关 [19-20]。ZG16B还被证明在反射性泪液中丰富,可能作为眼表保护的关键因子,维持泪膜稳定性 [21-22]。当前的大量研究,主要集中在ZG16B作为一种新型癌症因子,在肿瘤治疗中的重要作用。
4、ZG16B的临床应用前景
目前,来自新加坡的药企公司Prestige BioPharma,旗下已有4款针对ZG16B靶点的药物处于临床试验,分别是Ulenistamab(又名PBP1510)、IDC 002、IDC 001、IDC 004,主要用于胰腺癌、胰腺腺泡癌、卵巢癌、卵巢上皮癌。其中,Ulenistamab是首个胰腺癌上调因子单抗,2021年Ulenistamab在法国获批开展I/IIa期临床试验,治疗胰腺癌,目前已处于临床2期,率先进入临床新阶段。其它3款均为双特异性抗体,处于临床前(表1)。
众所周知,胰腺癌的治疗颇具挑战,因为其肿瘤周围有着密集的纤维化组织,这些组织就如同“堡垒”,阻碍了化疗药物的递送。近年来,随着分子靶向免疫治疗的进展,胰腺癌的治疗也从疗效不佳的单纯化疗和放疗进阶到更精准和更有效的靶向免疫治疗,各种新药物、新疗法向“癌中之王”发起挑战,获得了众多的突破。ZG16B作为新发的胰腺癌治疗靶点,有望为胰腺癌免疫治疗提供重要的方向。
| 药物 | 靶点 | 作用机制 | 在研适应症 | 研发状态 | 在研机构 | 药物类型 |
|---|---|---|---|---|---|---|
| Ulenistamab | ZG16B | PAUF | 胰腺癌; 卵巢癌 |
临床2期 | Prestige BioPharma Ltd.(普雷斯蒂奇生物制药私人有限公司) | 单克隆抗体 |
| IDC 002 | ZG16B | T 淋巴细胞刺激剂; ZG16B抑制剂; 抗体依赖的细胞毒作用 |
卵巢上皮癌; 胰腺腺泡癌 |
药物发现 | Prestige BioPharma Ltd.(普雷斯蒂奇生物制药私人有限公司) | 双特异性抗体 |
| IDC 001 | ZG16B; CTHRC1 |
ZG16B抑制剂; CTHRC1调节剂 |
卵巢上皮癌; 胰腺癌 |
药物发现 | Prestige BioPharma Ltd.(普雷斯蒂奇生物制药私人有限公司) | 双特异性抗体 |
| IDC 004 | VEGFA ZG16B |
VEGFA抑制剂; ZG16B抑制剂; 血管生成抑制剂 |
卵巢上皮癌; 胰腺癌 |
药物发现 | Prestige BioPharma Ltd.(普雷斯蒂奇生物制药私人有限公司) | 双特异性抗体 |
表1:ZG16B临床研究进展
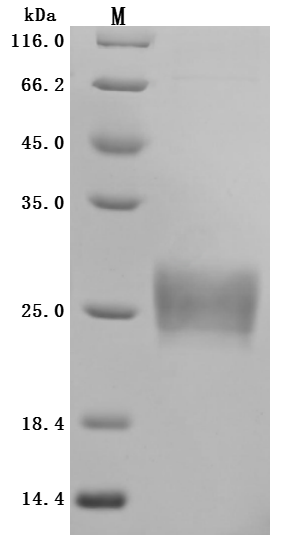
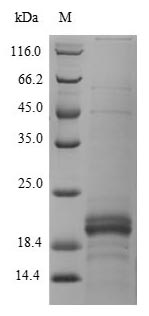
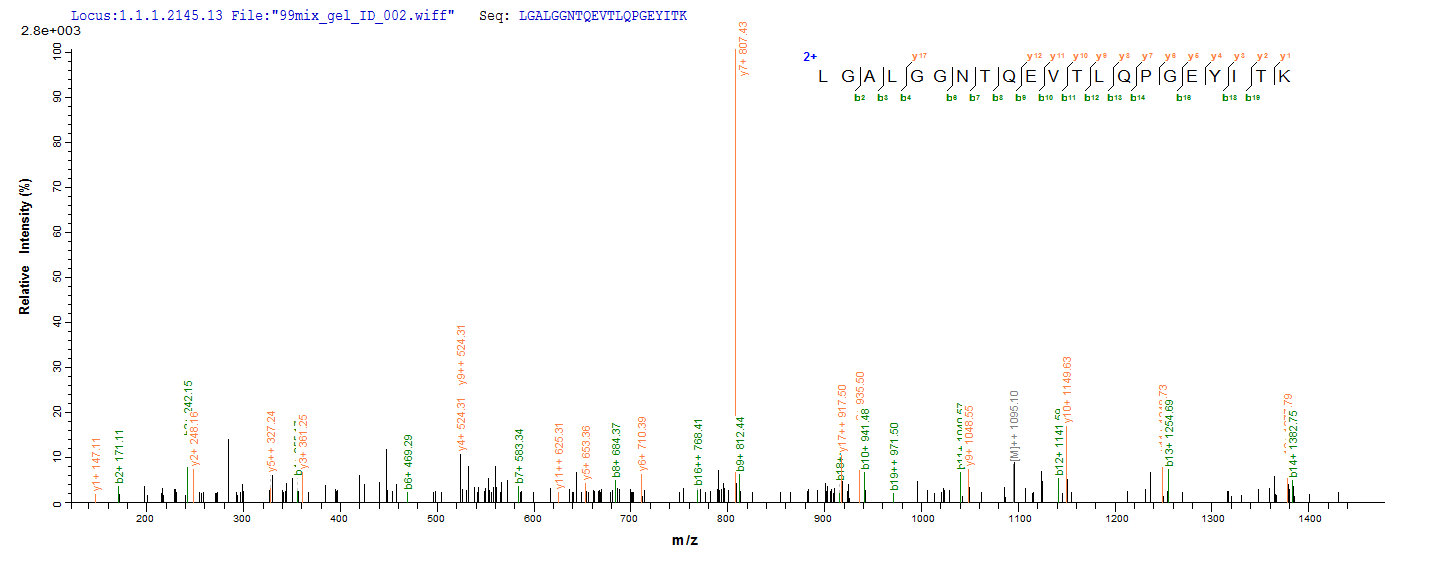
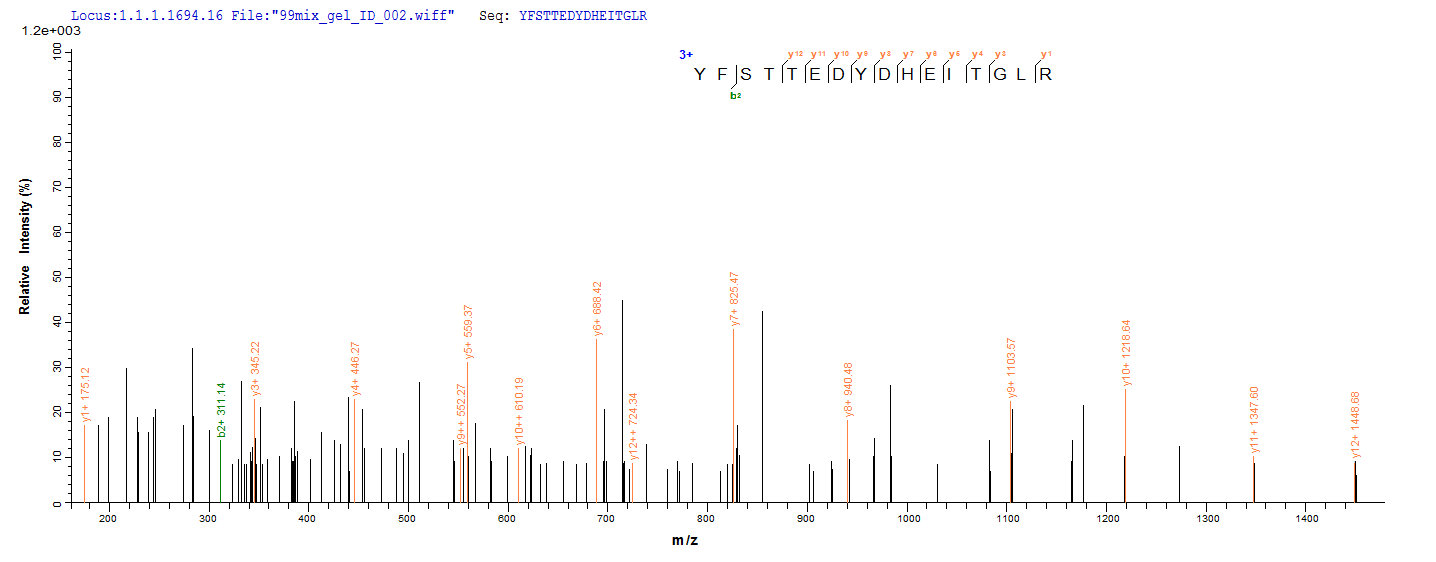
为鼎力协助各药企针对ZG16B在胰腺癌等疾病在临床中的研究,CUSABIO推出ZG16B蛋白产品(CSB-MP836195HU;CSB-YP836195HU;CSB-EP836195HU)助力您在ZG16B机制方面的研究或其潜在临床价值的探索。
● High Purity Validated by Western Blot
● Excellent Bioactivity Validated by Functional ELISA & Protein Sequence Validated by LC-MS/MS Analysis
参考文献:
[1] Lu, Haotian, et al. "Identification of ZG16B as a prognostic biomarker in breast cancer." Open Medicine 16.1 (2020): 1-13.
[2] Kanagawa, Mayumi, et al. "Crystal structures of human secretory proteins ZG16p and ZG16b reveal a Jacalin-related β-prism fold." Biochemical and biophysical research communications 404.1 (2011): 201-205.
[3] Kim, Sun A., et al. "Pancreatic adenocarcinoma up-regulated factor (PAUF), a novel up-regulated secretory protein in pancreatic ductal adenocarcinoma. "Cancer science 100.5 (2009): 828-836.
[4] Kim, Yeon Jeong, et al. "PAUF as a Target for Treatment of High PAUF-Expressing Ovarian Cancer." Frontiers in Pharmacology 13 (2022).
[5] Patidar, Ashok, et al. "DAMP-TLR-cytokine axis dictates the fate of tumor." Cytokine 104 (2018): 114-123.
[6] Song, Jinhoi, et al. "Pancreatic adenocarcinoma up-regulated factor (PAUF) enhances the accumulation and functional activity of myeloid-derived suppressor cells (MDSCs) in pancreatic cancer." Oncotarget 7.32 (2016): 51840.
[7] Li, Jing, et al. "The role of toll-like receptor 4 in tumor microenvironment." oncotarget 8.39 (2017): 66656.
[8] Lee, Y., et al. "PAUF functions in the metastasis of human pancreatic cancer cells and upregulates CXCR4 expression." Oncogene 29.1 (2010): 56-67.
[9] Escudero-Paniagua, Beatriz, et al. "PAUF/ZG16B promotes colorectal cancer progression through alterations of the mitotic functions and the Wnt/β- catenin pathway." Carcinogenesis 41.2 (2020): 203-213.
[10] Yanai, Hideyuki, Sho Hangai, and Tadatsugu Taniguchi. "Damage-associated molecular patterns and Toll-like receptors in the tumor immune microenvironment." International Immunology 33.12 (2021): 841-846.
[11] Dong, Liangchao, Weiwei Li, and Xiaoli Zhang. "Knockdown of pancreatic adenocarcinoma upregulated factor (PAUF) suppresses proliferation, migration, invasion, and cancer stem cell properties in lung cancer cells." Tropical Journal of Pharmaceutical Research 20.3 (2021): 459-465.
[12] Mandakhalikar, Kedar Diwakar, et al. "First-in-class monoclonal antibody (mAb) PBP1510 targeting pancreatic adenocarcinoma upregulated factor ( PAUF) for pancreatic cancer (PC) treatment: Preclinical perspectives." (2022): e16274-e16274.
[13] Kang, Byung Woog, et al. "Genetic variations in miRNA binding site of TPST1 and ZG16B associated with prognosis for patients with colorectal cancer." ( 2013): 3553-3553.
[14] Jin, Hong-Jian, et al. "Identification and validation of regulatory SNPs that modulate transcription factor chromatin binding and gene expression in prostate cancer." Oncotarget 7.34 (2016): 54616.
[15] Chen, Wei, et al. "Identification of core biomarkers associated with pathogenesis and prognostic outcomes of laryngeal squamous-cell cancer using bioinformatics analysis." European Archives of Oto-Rhino-Laryngology 277.5 (2020): 1397-1408.
[16] Barderas, Rodrigo, et al. "In-depth characterization of the secretome of colorectal cancer metastatic cells identifies key proteins in cell adhesion, migration, and invasion." Molecular & Cellular Proteomics 12.6 (2013): 1602-1620.
[17] Kim, Jihye, et al. "Genomic network-based analysis reveals pancreatic adenocarcinoma up-regulating factor-related prognostic markers in cervical carcinoma." Frontiers in oncology 8 (2018): 465.
[18] Sasahira, Tomonori, et al. "Pancreatic adenocarcinoma up-regulated factor has oncogenic functions in oral squamous cell carcinoma." Histopathology 70.4 (2017): 539-548.
[19] Martin-Lorenzo, Marta, et al. "KLK1 and ZG16B proteins and arginine-proline metabolism identified as novel targets to monitor atherosclerosis, acute coronary syndrome and recovery." Metabolomics 11.5 (2015): 1056-1067.
[20] Rollefstad, S., et al. "Rosuvastatin induced carotid plaque regression in patients with inflammatory joint diseases." atherosclerosis 235.2 (2014): e93.
[21] Costa-da-Silva, Ana Caroline, et al. "Salivary ZG16B Expression Loss Marks Onset of Oral Chronic Graft-Versus-Host Disease and Exocrine Gland Dysfunction." Available at SSRN 3906182.
[22] Ma, Jessica Yuen Wuen, et al. "Critical role of mass spectrometry proteomics in tear biomarker discovery for multifactorial ocular diseases." International Journal of Molecular Medicine 47.5 (2021): 1-15.
[23] Kanagawa, Mayumi, et al. "Crystal structures of human secretory proteins ZG16p and ZG16b reveal a Jacalin-related β-prism fold." Biochemical and biophysical research communications 404.1 (2011): 201-205.