靶向蛋白降解技术“PROTAC”:“革命性”的靶向策略,重定义小分子药物!
日期:2022-08-22 15:19:33
近年来,细胞疗法、免疫疗法和基因编辑技术等发展迅速。在新药研发方面,传统小分子药物的研究受到前所未有的挑战。不可成药的蛋白靶标,无活性的突变位点,以及耐药是现有小分子靶向药物难以解决的难题。因此,科学家一直致力于探索小分子新药物开发和治疗手段,突破高难度靶点。
目前,一项“革命性”的靶向策略横空出世—PROTAC靶向蛋白降解技术。不管靶蛋白的功能如何,应用PROTAC技术可将其降解,这就为降解不可成药的蛋白提供了可能。令人惊叹的是,PROTAC较ADC、双特异性抗体起步要晚的多,但近年迎来爆发。2019年3月,PROTAC才首次进入临床试验。但目前,超过200款在研蛋白降解疗法处于临床阶段,主要为PROTAC分子,距今仅3年。因此,PROTAC为小分子药物研发注入了新的活力,正以一个全新的视角让肿瘤药物研发重焕生机!
1、PROTAC背景介绍
蛋白降解靶向嵌合体(Proteolysis targeting chimeras,PROTAC)是一种新型靶向蛋白降解技术。2001年,Craig Crews和Raymond Deshaies教授提出PROTAC概念,并报道了首个PROTAC分子—PROTAC-1,可靶向降解甲硫氨酰氨肽酶-2(METAP2),开创了这一革命性的技术 [1]。2008年,Crews团队采用Nutlin招募MDM2来启动降解级联,用于靶向雄激素受体(AR,Androgen receptor)。这一小分子能够将雄激素受体AR招募到MDM2附近,使其泛素化,并随之被蛋白酶体复合体降解 [2]。这一能够靶向蛋白进行降解的嵌合分子,被命名为PROTAC(Proteolysis Targeting Chimera)(图1) [3]。
随着PROTAC技术的不断发展及完善,PROTAC如今已获得众多肿瘤药物研发者的关注。传统的癌症药物靶点绝大部分是具有适合的结合位点和明确的活性位点的蛋白质。而PROTAC技术在降解癌细胞过程中,将靶蛋白诱导到蛋白降解系统即可使癌细胞失活,不一定要和靶蛋白的活性位点结合才能发挥作用,这使得其在理论上可以对绝大部分蛋白发生作用。与此同时,它还能克服传统小分子的耐药性问题。如今,越来越多的公司开始参与PROTAC研发,PROTAC技术已从学术界转移到制药界,其丰富的未来管线,俨然成为目前新药研发领域最火热的技术之一,受到科研院所、药企和投资机构的青睐。
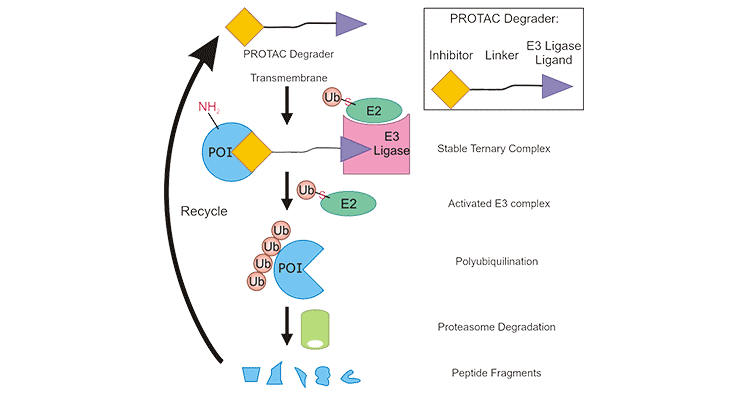
图1. PROTAC新型靶向蛋白降解技术 [3]
2、PROTAC技术原理
2.1 “泛素-蛋白酶体系统”(UPS)
泛素-蛋白酶体系统(Ubiquitin Proteasome System,UPS),即泛素介导的蛋白降解系统,它是PROTAC降解蛋白所采取的途径 [4]。泛素-蛋白酶体系统UPS是细胞调节蛋白质水平的主要途径,参与细胞内80%以上蛋白质的降解,用于降解细胞内受损或不再需要的蛋白质,降解的异常往往会导致肿瘤等疾病的发生 [5, 6]。就也是说,泛素分子在一系列酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,对靶蛋白进行特异性修饰,形成靶蛋白多聚泛素链,该泛素链指导底物在蛋白酶体处降解。目前,这些酶主要包括E1活化酶、E2结合酶、E3泛素连接酶。
具体而言,“泛素-蛋白酶体系统”降解蛋白的途径包括四个阶段 (图2):①泛素活化,泛素甘氨酸端的羧基连接到泛素活化酶E1的巯基,ATP被E1泛素激活酶消耗,产生活化的泛素-腺苷酸;②泛素激活酶E1,将活化后的泛素通过交酯化过程交给泛素结合酶E2;③泛素连接酶E3,为泛素-蛋白酶体系统选择性降解机制的关键因素,识别被降解的蛋白。它将结合E2的泛素连接到靶蛋白质上并释放E2,形成特定的泛素化的蛋白质;④泛素化的蛋白质被蛋白酶体识别并结合,最终在蛋白酶的催化下蛋白质分解为短肽或氨基酸 [7]。
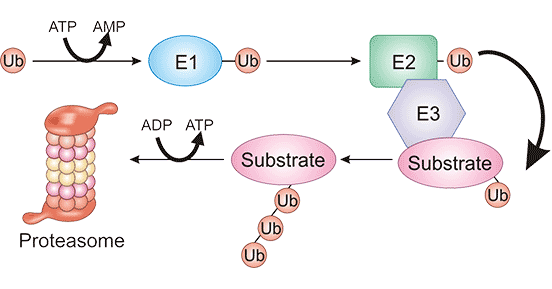
图2. “泛素-蛋白酶体系统”降解蛋白的途径 [7]
2.2 PROTAC分子结构特点
现有的PROTAC由3部分组成:一端为靶蛋白结合配体,另一端为E3泛素连接酶配体,中间则为连接链(linker)(图3) [7]。PROTAC是一种双功能分子,可以同时与靶蛋白及E3结合,使本来不能与E3结合的靶蛋白泛素化进而被蛋白酶体识别并降解。与传统的针对蛋白激酶活性位点的小分子不同,PROTAC的靶蛋白可以是没有明显活性位点的蛋白质,这能够显著增加靶蛋白的数量,也使研究者能利用现有的E3连接酶处理新发现的靶蛋白,增加PROTAC在设计上的选择。此外,PROTAC分子本身的灵活性更使得其应用前景十分广泛。
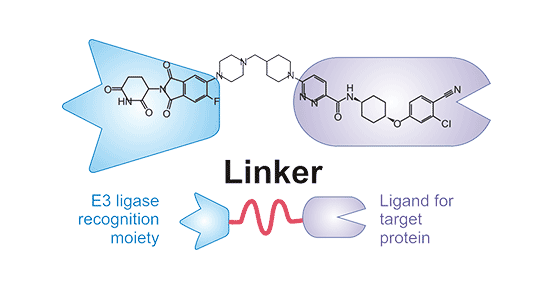
图2. PROTAC分子结构 [7]
2.3 “靶蛋白-PROTAC-E3泛素连接酶”三元复合体
在PROTAC诱导靶蛋白降解的过程中,“靶蛋白-PROTAC-E3泛素连接酶”三元复合物的形成作为其核心,是PROTAC对靶蛋白进行多泛素化修饰中必经的步骤。PROTAC只有与靶蛋白和E3连接酶同时结合,形成三元复合物时才能起作用(图4) [8]。
目前,已鉴定出600多种人类基因组编码的E3连接酶,多个应用于PROTAC分子设计的E3泛素连接酶被发现,包括CRBN、VHL、凋亡蛋白抑制蛋白(IAPs)、MDM2和DCAF16等等。但临床的PROTAC管线披露的E3降解酶大多数是CRBN。另有研究提示,骨骼肌中表达的KLHL41,神经系统中表达的RNF182、TRIM9,以及肿瘤中表达的CDC20、CIAO1、WD82或可用于后续的PROTAC分子设计,这将进一步丰富PROTAC的性能 [9-10]。
靶蛋白包括核受体(ERRα、FKBP12、TACC3)、神经退行性相关蛋白(Huntingtin、Tau、α-synuclein)、胞外代谢酶(MetAP-2、DHODH)、表观遗传相关蛋白(PCAF/GCN5)等30余种蛋白及其突变体 [9-12, 26]。
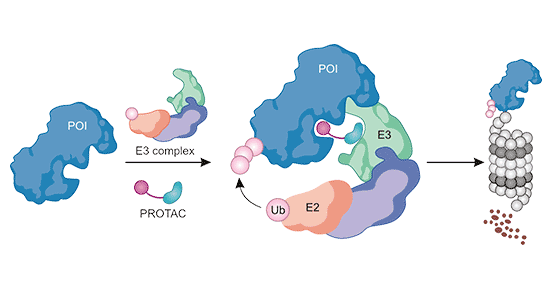
图4. “靶蛋白-PROTAC-E3泛素连接酶”三元复合体形成途径 [8]
3、PROTAC在肿瘤治疗中的应用
蛋白降解靶向嵌合体PROTAC通过利用泛素蛋白酶体途径实现对靶蛋白降解,颠覆了传统小分子抑制剂的理念。PROTAC能在微小剂量时发挥高效的作用,降低耐药性;PROTAC能够循环作用,且能作用“不可成药”蛋白,具有高效的靶向性,这是以往的抗肿瘤药物少有的优点。目前,PROTAC技术在临床研究中已经成功实现了针对前列腺癌、乳腺癌、非小细胞肺癌等疾病相关靶点(如AR、ER、EGFR、KRAS、ABL)的成功降解 [13-27]。
3.1 PROTAC在前列腺癌中的应用
前列腺癌是一种在男性中很常见的癌症,该病的诊断与雄激素受体(AR)有着密切关系。AR拮抗剂,如苯扎鲁胺(Enzalutamide)已用于前列腺癌患者的治疗,疗效显著,但常出现耐药性。针对AR的PROTAC已多次被证明优于苯扎鲁胺,特别是在雄激素水平升高,以及AR突变将拮抗剂转化为激动剂的耐药环境中 [13]。目前,多款AR的PROTAC针对耐药的去势前列腺癌,处于临床试验阶段。
3.2 PROTAC在乳腺癌中的应用
在乳腺癌患者中,约70%表现为雌激素受体(ER,Estrogen receptor)阳性乳腺癌,因此ER是乳腺癌药物研究中一个重要靶点。但是大部分的初发乳腺癌会在用药之后获得对雌激素抗体类药物(如氟维司群)的耐药性。相比之下,采用ER的PROTAC能诱导有效的降解,并且可以改善其药理特性 [14]。
除了ER外,还有一些与乳腺癌相关的靶点,如CDK4/6、HER2、PARP1、TACC3、BET家族蛋白(BRD2、BRD3、BRD4和BRDT)等等,研究人员利用PROTAC技术设计合成了相应的PROTAC分子,它们在细胞水平对靶蛋白均有降解作用,部分化合物在动物体内也有较好的活性 [15-17]。这些研究表明,PROTAC靶向蛋白降解有望为治疗乳腺癌提供新的策略。
3.3 PROTAC在非小细胞肺癌中的应用
EGFR作为一种受体酪氨酸激酶(RTK),与细胞凋亡、增殖、代谢和存活的调控密切相关。尽管EGFR靶向肺癌小分子药物已广泛应用于医学领域,但是许多患者用药后出现获得性耐药,影响了后续的治疗效果。目前,国内外许多研究团队也正在利用PROTAC技术开展靶向降解EGFR的研究 [18]。值得关注的是,国内已有3家进入临床研究阶段,来自上海科技大学(SIAIS164018)、同济医科大学(DP-C-4)、中国药科大学(PROTAC EGFR degrader 2)。
KRAS作为治疗NSCLC的新靶点,在细胞的生存和周期进程等方面发挥重要作用,是NSCLC中最常发生突变的基因之一。KRAS一度被认为是“不可成药”靶点,2020年,Crews团队报道了首个可降解KRAS G12C的PROTAC分子,是PROTAC技术靶向不可成药蛋白领域一项重要突破。此外,约4%的NSCLC伴有ALK融合基因,当前有研究团队正在利用PROTAC技术开发靶向ALK的降解剂,有望为ALK耐药突变的患者寻找一份新的屏障 [19, 20]。
3.4 PROTAC在依赖性慢性粒细胞白血病中的应用
BCR-ABL激酶抑制剂的出现,改变了慢性粒细胞白血病(CML)患者的生活,但是,在大多数患者中激酶抑制并不能彻底根治。已有报道,开发诱导BCR-ABL降解的PROTAC,表现出明显的选择性并显著抑制BCR-ABL+白血病细胞的生长,从而抑制BCR-ABL介导的信号通路 [21]。目前,更多基于PROTAC的新型CML抗癌剂已处于临床阶段。
3.5 PROTAC在其它疾病中的应用
除了靶向降解肿瘤疾病的关键蛋白,另一种具有挑战性的目标蛋白是易于聚集的蛋白。α-突触核蛋白(SNCA)和tau蛋白与神经退行性疾病的发病机制和相关功能障碍密切相关,通过PROTAC直接募集到E3连接酶来降解这些蛋白质,是治疗该类疾病以及蛋白质聚集性疾病的一种可行方法。事实上,PROTAC的几项研究已经开始通过诱导tau降解来治疗阿莫斯海默症 [22-24]。
4、PROTAC分子的药物前景
PROTAC技术作为一种新兴的蛋白降解技术,具有靶向不可成药靶点、克服耐药性等小分子抑制剂不可比拟的潜在优势,正处于快速发展时期。随着研究人员对UPS体系、PROTAC和蛋白质靶标配体的了解,以及更多E3连接酶配体的发现,这将进一步加速PROTAC的成功开发。PROTAC技术现已知可以降解80多个靶点的100多种蛋白,在治疗肿瘤、病毒感染以及神经退行性疾病等领域均有深入的研究。越来越多的国际大药企纷纷布局PROTACs临床研究,包括罗氏(Roche)、渤健(Biogen)、葛兰素史克(GSK)、赛诺菲(Sanofi)等等。相信不久就会有靶向降解肿瘤靶点蛋白的PROTAC分子药物获批,为肿瘤等多种疾病提供一种革命性的新治疗手段(表1)。
| 药物 | 靶点 | 作用机制 | 药物类型 | 在研适应症 | 在研机构 | 最高研发状态 |
|---|---|---|---|---|---|---|
| Bavdegalutamide | AR | AR降解增强剂 | PROTACs | 前列腺癌 | Arvinas, Inc. | 临床2期 |
| ARV-471 | ESR1 | ERα拮抗剂 | PROTACs | 乳腺癌 | Pfizer Inc. ;Arvinas, Inc. ;Pfizer Investment Co., Ltd. | 临床2期 |
| CFT 8634 | BRD9 | BRD9抑制剂 | PROTACs | 实体瘤;滑膜肉瘤 | C4 Therapeutics, Inc. | 临床1/2期 |
| KT-474 | IRAK1 | IRAK1拮抗剂 | PROTACs | 特应性皮炎;类风湿关节炎;化脓性汗腺炎;多发性硬化症 | Kymera Therapeutics, Inc. ;Sanofi | 临床1期 |
| NX-2127 | BTK | IKZF3 | BTK抑制剂 ;IKZF3抑制剂 | PROTACs | B细胞慢性淋巴细胞白血病;弥漫性大B细胞淋巴瘤;滤泡性淋巴瘤;套细胞淋巴瘤;边缘区B细胞淋巴瘤;非霍奇金淋巴瘤;巨球蛋白血症 | Nurix Therapeutics, Inc. | 临床1期 |
| KT-413 | IRAK4 | IRAK4抑制剂 | PROTACs | B细胞淋巴瘤;弥漫性大B细胞淋巴瘤;淋巴瘤 | Kymera Therapeutics, Inc. | 临床1期 |
| DT-2216 | Bcl/X | Bcl/X抑制剂 | PROTACs | 血液肿瘤;实体瘤 | Dialectic Therapeutics, Inc. | 临床1期 |
| HSK-29116 | BTK | BTK抑制剂 | PROTACs | B细胞淋巴瘤 | 海思科医药集团股份有限公司 ;四川海思科制药有限公司 | 临床1期 |
| NX 5948 | BTK | BTK抑制剂 | PROTACs ;小分子化药 | B细胞慢性淋巴细胞白血病;弥漫性大B细胞淋巴瘤;滤泡性淋巴瘤;套细胞淋巴瘤;边缘区B细胞淋巴瘤;原发性中枢神经系统淋巴瘤;巨球蛋白血症;移植物抗宿主病;类风湿关节炎 | Nurix Therapeutics, Inc. | 临床1期 |
| LNK-01002 | Ras | Ras抑制剂 | PROTACs | 急性髓性白血病;原发性骨髓纤维化;血液肿瘤 | 凌科药业(杭州)有限公司 | 临床1期 |
| BGB 16673 | BTK | 蛋白降解 ;BTK抑制剂 | PROTACs | 非霍奇金淋巴瘤;B细胞慢性淋巴细胞白血病;B细胞淋巴瘤 | 百济神州(苏州)生物科技有限公司 ;百济神州有限公司 | 临床1期 |
| GT-20029 | AR | AR降解增强剂 | PROTACs | 寻常痤疮;脱发 | 苏州开拓药业股份有限公司 | 临床1期 |
| FHD 609 | BET | BET抑制剂 | PROTACs | 滑膜肉瘤 | Foghorn Therapeutics, Inc. | 临床1期 |
| AC 0682 | ESR1 | ERα拮抗剂 | PROTACs | ER阳性乳腺癌;乳腺癌 | 冰洲石生物科技(上海)有限公司 | 临床1期 |
| HP 518 | AR | AR拮抗剂 | PROTACs | 前列腺癌 | 海创药业股份有限公司 | 临床1期 |
| AC 0176 | AR | AR降解增强剂 | PROTACs | 去势抵抗性前列腺癌;前列腺癌 | 冰洲石生物科技(上海)有限公司 | 临床1期 |
| ARV-766 | AR | AR降解增强剂 | PROTACs | 前列腺癌;前列腺疾病 | Arvinas, Inc. | 临床1期 |
| KT-333 | STAT3 | STAT3抑制剂 | PROTACs | 血液肿瘤;实体瘤 | Kymera Therapeutics, Inc. | 临床1期 |
| CG 001419 | NTRK | 蛋白降解 ;NTRK抑制剂 | PROTACs | 实体瘤;肿瘤 | Cullgen, Inc. ;上海睿跃生物科技有限公司 | 临床1期 |
| CBP-8088 | / | / | PROTACs | 肿瘤 | Coherent Biopharma Suzhou Co. Ltd. | 临床申请 |
| NW-8-153 | / | 蛋白降解 | PROTACs | 肿瘤 | 广州麓鹏制药有限公司 | 临床前 |
| HPB-001 | / | 蛋白降解 | PROTACs | 肿瘤 | 杭州多域生物技术有限公司 | 临床前 |
| Homo-PROTAC pVHL30 degrader 1(University of Dundee) | / | 蛋白降解 | PROTACs | / | University Of Dundee | 临床前 |
| E3 ubiquitin ligase based protein degradation(GSK/Kymera) | / | 蛋白降解 | PROTACs | 自身免疫性疾病;肿瘤 | Kymera Therapeutics, Inc. ;GSK Plc | 临床前 |
| ASN-1764 | / | 蛋白降解 | 分子胶 ;PROTACs | 卵巢癌;三阴性乳腺癌 | 亚虹医药科技股份有限公司 | 临床前 |
| CBP-8028 | / | / | PROTACs | / | Coherent Biopharma Suzhou Co. Ltd. | 临床前 |
| MTX-23 | / | 蛋白降解 | PROTACs | 去势抵抗性前列腺癌 | Montelino Therapeutics, LLC | 临床前 |
| CT-03 | / | / | PROTACs | 血液肿瘤;实体瘤 | Captor Therapeutics SA | 临床前 |
| NW-7-251 | / | 蛋白降解 | PROTACs | 血液肿瘤 | 广州麓鹏制药有限公司 | 临床前 |
| Alhena Project | / | / | PROTACs | 肿瘤 | - | 临床前 |
| Oncology program(Arvinas) | / | / | PROTACs | 实体瘤 | Arvinas, Inc. | 临床前 |
| ASN-1780 | / | 蛋白降解 | PROTACs ;分子胶 | 去势抵抗性前列腺癌 | 亚虹医药科技股份有限公司 | 临床前 |
| HPB-002 | / | 蛋白降解 | PROTACs | 自身免疫性疾病 | 杭州多域生物技术有限公司 | 临床前 |
| CBP-8008 | / | / | PROTACs | / | Coherent Biopharma Suzhou Co. Ltd. | 临床前 |
| CBP-8018 | / | / | PROTACs | / | Coherent Biopharma Suzhou Co. Ltd. | 临床前 |
| GW3965-PEG5-VH032 | / | 蛋白降解 | PROTACs | 炎症 | National Institutes of Health | 临床前 |
| PG21 | GSK3B | GSK3B抑制剂 | PROTACs | 神经系统变性病 | 中国药科大学 | 临床前 |
| MYCN Degarders (Nurix Therapeutics) | MYCN | 蛋白降解 | PROTACs | 神经母细胞瘤 | Nurix Therapeutics, Inc. | 临床前 |
| SGK3-PROTAC1 | SGK3 | 蛋白降解 ;SGK3抑制剂 | PROTACs | 肿瘤 | University Of Dundee | 临床前 |
| CP5V | CDC20 | 蛋白降解 ;CDC20抑制剂 | PROTACs | 肿瘤 | Northwestern University | 临床前 |
| SMARCA2 inhibitors(Arvinas/Genentech) | SMARCA2 | SMARCA2 抑制剂 | PROTACs | 非小细胞肺癌 | Arvinas, Inc. ;Genentech, Inc. | 临床前 |
| PROTAC CRABP-II Degrader-1(Mercachem BV) | CRABP2 | 蛋白降解 ;CRABP2抑制剂 | PROTACs | 肿瘤 | Mercachem BV | 临床前 |
| MD13 | MIF | 蛋白降解 ;MIF抑制剂 | PROTACs | 肺癌 | University of Groningen | 临床前 |
| dTRIM24(Dana-Farber Cancer Institute) | TRIM24 | 蛋白降解 | PROTACs | 肿瘤 | Harvard Medical School ;Dana-Farber Cancer Institute, Inc. | 临床前 |
| BI-3663 | PTK2 | FAK1抑制剂 | PROTACs | 肿瘤 | Boehringer Ingelheim GmbH | 临床前 |
| SJFδ | MAPK13 | 蛋白降解 ;MAPK13抑制剂 | PROTACs | 肿瘤 | Yale University ;Arvinas, Inc. | 临床前 |
| ORM 5029 | GSPT1 | GSPT1抑制剂 | PROTACs | 乳腺癌 | Orum Therapeutics, Inc. | 临床前 |
| VZ185 | BRD7 | BRD9 | BRD7抑制剂 ;BRD9抑制剂 | PROTACs | 肿瘤 | University Of Dundee | 临床前 |
| SIAIS164018 | EGFR | ALK | EGFR拮抗剂 ;ALK抑制剂 | PROTACs | 非小细胞肺癌 | 上海科技大学 | 临床前 |
| VZ-185 | BRD7 | BRD9 | BRD7抑制剂 ;BRD9抑制剂 | PROTACs | 肿瘤 | Boehringer Ingelheim International GmbH | 临床前 |
来自PharmSnap部分数据
5、PROTAC研究涉及的热门靶向蛋白和E3泛素连接酶
基于PROTAC技术的药物研究,在过去几年中呈指数级增长并日益成熟。利用PROTAC降解靶蛋白治疗恶性肿瘤等疾病的前景无疑是乐观的。j9九游会登录入口首页生物汇总PROTAC研究涉及的E3泛素连接酶和热门靶点蛋白,涵盖:肿瘤特异性靶点,生长抑制因子,细胞死亡,血管生成,细胞的增殖、侵袭和转移等靶点,助力您针对特定靶点的PROTAC分子方面的研究或其潜在临床价值的探索!
● 靶点蛋白产品
● E3泛素连接酶相关产品
参考文献:
[1] Sakamoto, Kathleen M., et al. "Protacs: chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation." Proceedings of the National Academy of Sciences 98.15 (2001): 8554-8559.
[2] Schneekloth, Ashley R., et al. "Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics." Bioorganic & amp; medicinal chemistry letters 18.22 (2008): 5904-5908.
[3] Han, Xin, Wenyi Wei, and Yi Sun. "PROTAC degraders with ligands recruiting MDM2 E3 ubiquitin ligase: an updated perspective." Acta Materia Medica (2022).
[4] Cecchini, Carlotta, et al. "Exploring the ubiquitin-proteasome system (UPS) through PROTAC technology." Chimia 74.4 (2020): 274-274.
[5] Li, Xinyi, et al. "Therapeutic targeting of RNA-binding protein by RNA-PROTAC." Molecular Therapy 29.6 (2021): 1940-1942.
[6] Bondeson, Daniel P., et al. "Lessons in PROTAC design from selective degradation with a promiscuous warhead." cell chemical biology 25.1 (2018): 78-87.
[7] Pagan, Julia, et al. "Role of the ubiquitin proteasome system in the heart." Circulation research 112.7 (2013): 1046-1058.
[8] Nalawansha, Dhanusha A., and Craig M. Crews. "PROTACs: an emerging therapeutic modality in precision medicine. "Cell chemical biology 27.8 (2020): 998 -1014.
[9] Gao, Hongying, Xiuyun Sun, and Yu Rao. "PROTAC technology: opportunities and challenges." acs medicinal chemistry letters 11.3 (2020): 237-240.
[10] Paiva, Stacey-Lynn, and Craig M. Crews. "Targeted protein degradation: elements of PROTAC design. "Current opinion in chemical biology 50 (2019): 111- 119.
[11] Kargbo, Robert B. "PROTAC degradation of IRAK4 for the treatment of cancer." ACS Medicinal Chemistry Letters 10.10 (2019): 1370-1371.
[12] Wang, Chao, et al. "PROTACs technology for targeting non-oncoproteins: Advances and perspectives." Bioorganic Chemistry 114 (2021): 105109.
[13] Petrylak, Daniel Peter, et al. "First-in-human phase I study of ARV-110, an androgen receptor (AR) PROTAC degrader in patients (pts) with metastatic castrate-resistant prostate cancer (mCRPC) following enzalutamide (ENZ) and/or abiraterone (ABI)." (2020): 3500-3500.
[14] Hu, Jiantao, et al. "Discovery of ERD-308 as a highly potent proteolysis targeting chimera (PROTAC) degrader of estrogen receptor (ER)." Journal of medicinal chemistry 62.3 (2019): 1420-1442.
[15] Noblejas-López, María del Mar, et al. "Antitumoral Activity of a CDK9 PROTAC Compound in HER2-Positive Breast Cancer." International Journal of Molecular Sciences 23.10 (2022): 5476.
[16] Yang, Tingting, et al. "A BRD4 PROTAC nanodrug for glioma therapy via the intervention of tumor cells proliferation, apoptosis and M2 macrophages polarization." Acta Pharmaceutica Sinica B (2022).
[17] Wang, Yang, et al. "Degradation of proteins by PROTACs and other strategies." Acta Pharmaceutica Sinica B 10.2 (2020): 207-238.
[18] Zhang, Hao, et al. "Discovery of potent epidermal growth factor receptor (EGFR) degraders by proteolysis targeting chimera (PROTAC)." European Journal of Medicinal Chemistry 189 (2020): 112061.
[19] Zhang, Z., et al. "28P Discovery of potent PROTAC degraders of KRASG12C based on a reversible non-covalent KRAS binder." Annals of Oncology 33 (2022): S14.
[20] Yan, Guoyi, et al. "Discovery of a PROTAC targeting ALK with in vivo activity." European Journal of Medicinal Chemistry 212 (2021): 113150.
[21] Pan, You-lu, et al. "The progress of small-molecules and degraders against BCR-ABL for the treatment of CML." European Journal of Medicinal Chemistry (2022): 114442.
[22] Kargbo, Robert B. "Treatment of Alzheimer's by PROTAC-Tau protein degradation." ACS Medicinal Chemistry Letters 10.5 (2019): 699-700.
[23] Wang, Weijin, et al. "A novel small-molecule PROTAC selectively promotes tau clearance to improve cognitive functions in Alzheimer-like models." Theranostics 11.11 (2021): 5279.
[24] Pradeepkiran, Jangampalli Adi, and P. Hemachandra Reddy. "Phosphorylated tau targeted small-molecule PROTACs for the treatment of Alzheimer's disease and tauopathies." Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease 1867.8 (2021): 166162.
[25] Zhou, Xin, et al. "PROTAC: A promising technology for cancer treatment." European journal of medicinal chemistry 203 (2020): 112539.
[26] Békés, Miklós, David R. Langley, and Craig M. Crews. "PROTAC targeted protein degraders: the past is prologue." Nature Reviews Drug Discovery 21.3 (2022): 181-200.
[27] Zou, Yutian, Danhui Ma, and Yinyin Wang. "The PROTAC technology in drug development." Cell biochemistry and function 37.1 (2019): 21-30.











