白细胞介素4受体(IL-4R/IL-4Ra):细胞因子多功能靶点,哮喘、鼻炎、病毒、肿瘤等研究中呈多样潜力!
日期:2024-03-29 08:58:03
2024年1月26日消息,上海健康元分别与江苏荃信生物、山东博安生物达成产品授权合作,获得抗TSLP单抗、抗IL-4Ra单抗两款产品的相关权益,以开发它们用于治疗致哮喘、慢性阻塞性肺疾病(COPD)等呼吸系统疾病。特别值得关注的是,细胞因子IL-4R/IL-4Rα作为一款多功能靶点,其研究应用范围不断扩展,包括多种过敏性、自身免疫等疾病。目前,国内外已有超10多个IL-4R/IL-4Rα药物处于晚期临床开发阶段。除了此外,IL-4R/IL-4Rα还在病毒和肿瘤方面发挥着关键作用,显示出其作为多功能靶点的多样潜力,其在不同疾病中的作用机制和临床潜力值得进一步深入研究和开发。今天让我们一起来了解下!
1. 什么是白细胞介素-4受体?
1.1 IL-4R/IL-4Rα的结构
白细胞介素-4受体(IL-4R,又叫CD124;IL4Rα)是一种I型跨膜蛋白,属于白细胞介素家族成员之一。IL4Rα链cDNA全长3.6 kb,含有一个编码825个氨基酸的开放阅读框架,根据推测其中包括信号序列(25个氨基酸),细胞外区(207个结合域氨基酸),跨膜区(24个氨基酸),细胞内区(569个氨基酸)。人IL4R存在三种类型:Type I由高特异性亲和力a链(IL-4Ra)和IL-2Rγ链构成;Type II由IL-4Ra链和IL-13Ra链构成;Type III由IL-4Ra链、IL-13Ra链和IL-2Rγ链构成。IL-4Ra链对IL-4具有很高的亲和力,已经被克隆并证明具有对IL-4的生物学反应能力。IL-4Ra链胞外结构域包含有WSXWS模块,是受体结合细胞因子所必需的最佳构象。在结合配体后,与IL-4R偶联的酪氨酸激酶被激活,从而产生信号传导(图1) [1-5]。
1.2 IL-4R/IL-4Rα表达和功能
IL-4Rα是三类IL-4R复合物共有的关键亚单位,亦通常简称为IL-4R。I类IL4R复合物主要表达于T淋巴细胞、NK细胞、嗜碱性粒细胞和肥大细胞,II类复合物则表达于非淋巴细胞来源的肿瘤细胞,而III类复合物则主要表达于B细胞和单核细胞。IL4R结合白细胞介素4和白细胞介素3等配体后,可发挥多种免疫调节效应,例如调节B细胞中IgE抗体的产生、促进Th2细胞的分化以及导致巨噬细胞替代性激活等。最近的研究发现,抑制或敲除IL-4R/IL-4Rα表达与鼻病毒(RV)入侵相关。此外,许多研究表明,IL-4R/IL-4Rα和IL4的基因多态性与多种自身免疫疾病密切相关,包括哮喘、鼻炎、关节炎等等 [1-3, 6-7]。
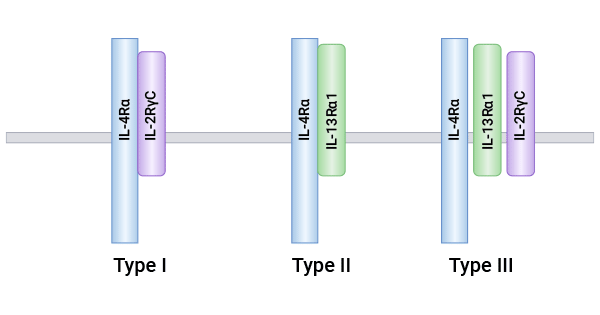
图1. 三类IL-4R复合物结构组成 [3]
2. IL-4R/IL-4Rα的配体有哪些?
IL-4R/IL-4Rα主要通过与IL-4和IL13等配基结合发挥重要的生物学作用。IL-4由活化II型辅助性T细胞、嗜碱性粒细胞和肥大细胞产生,它可通过抑制单核-巨噬细胞的激活以及Th1细胞因子如IL-1、TNF-α和干扰素γ(IFN-γ)来抑制炎症反应。然而,IL-4在不同的免疫机制中,也发挥促炎作用。因此,IL-4被认为是一种多功能细胞因子。IL-13是Th2细胞产生的细胞因子。IL-4和IL-13的氨基酸序列有大约25%的同源性。IL-13能够促进B细胞的分化,提高其活性,并且可以抑制外周血单核-巨噬细胞产生和IL-1β、IL-8、TNF-a、IL-6等细胞因子的表达。IL-4和IL-13的生物活性极为相似,它们共享一个关键的信号转导受体组分,并在基因定位和蛋白质构成上有一定的相似性 [8-10]。
3. IL-4R/IL-4Rα相关的机制
IL-4受体是一种细胞表面的二聚体复合物,由α和γ亚单位组成。其中,IL-4Rα是对IL-4非常敏感的特异性受体。γ链为Type I和Type III细胞因子所共有,又称为共同γ链(common gamma chain,γc链)。IL13Rα的作用类似于γ链,可以增强IL-4Rα与IL-4之间的结合力。如前所述,IL-4与IL-13是一种生物活性相似的多效细胞因子。因此,IL-4受体主要通过与IL-4和IL-13等分子结合来发挥生物学功能。
例如,当IL-4与受体结合后,IL-4受体与γc链形成二聚体,激活酪氨酸激酶(PTK),导致细胞内底物的磷酸化,从而触发信号的级联传递。这启动了四种主要的信号转导途径:1)与细胞生存相关的磷酸肌醇3激酶(PI-3K)途径;2)与细胞增殖和基因转录的Ras/丝裂原激活的蛋白酶(MAPK)途径;3)胰岛素受体底物1/2(IRS-1/2)途径;4)控制基因转录的Jak-STAT途径。此外,Stat-6对IL-4依赖性的CD23、II型MHCε重链和IL-4α受体的表达起着重要作用,并且对Th2淋巴细胞因子的分泌也至关重要(图2)[3, 11]。
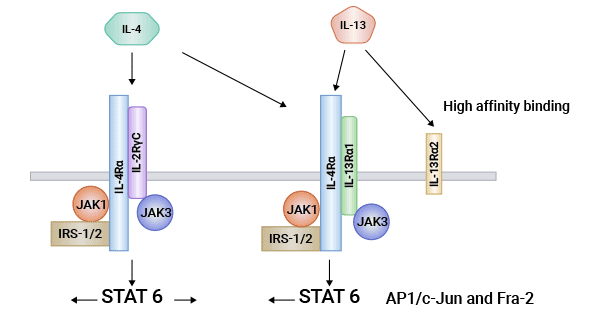
图2. IL-4R/IL-4Rα相关的机制 [3]
4. IL-4R/IL-4Rα相关的疾病研究
许多研究证实IL-4受体基因有多个影响其生物活性的基因多态位点,这些基因多态性与多种疾病相关。目前,对IL-4基因多态性的研究主要集中在lle50Val、Gln55(576)Arg和Ser503(478)Pro等位点。深入研究IL-4R/IL-4Rα基因多态性对各种疾病的影响,可能对研究预防和治疗这些疾病提供帮助。此外,一些研究表明IL-4R/IL-4Rα在病毒和肿瘤中也发挥着重要作用。
4.1 IL-4R/IL-4Rα和哮喘研究
IL-4、IL-4R/IL-4Rα和IL-13在过敏反应和哮喘的发生过程中扮演着关键角色。它们严重影响气道对过敏原的反应性,导致气道结构重建、气道炎症和气道平滑肌增生。IL-4和IL-13通过与IL-4R结合来实现其生物学功能。IL-4R可能通过影响Th1/Th2细胞的平衡来参与哮喘的发病机制。目前,IL-4和IL-4R基因的多态性与哮喘之间的关系备受关注。一些研究报道了IL-4Ra lle50Val与哮喘的相关性,但研究结果并不一致。有研究显示,lle50Val与哮喘有一定关联,但另一些研究却发现IL-4Ra lle50Val与哮喘之间并无明显关联。此外,在一项针对波兰儿童的研究中发现,IL-4R基因rs1805011位点的多态性可能增加过敏发病风险,并与轻度哮喘和变应性皮炎的易感性相关 [12-15]。
4.2 IL-4R/IL-4Rα和变应性鼻炎研究
由于IL-4R/IL-4Ra的编码基因存在错义突变,导致表达的氨基酸结构发生变化,从而增强了IL-4R的信号传导功能并改变了其生物学活性。其中,IL-4Ra链的Q576R位点是首次发现的新突变基因,即1902位核苷酸鸟嘌呤(A)突变为腺嘌吟(G),导致IL-4R上的第576个碱基的谷氨酸(简称Q)被精氨酸(简称R)替代 [16]。研究发现,R576在变态反应性疾病患者中表达明显增加。此外,还发现R576通过改变IL-4R的信号传导而促进了变应性哮喘的发生。另有报道表明,R576与哮喘的严重程度密切相关,认为R576可以作为临床有效标记哮喘严重程度的指标之一 [17-20]。
4.3 IL-4R/IL-4Rα与系统性红斑狼疮研究
通过PCR-RFLP方法研究SLE患者的lle50Val基因型。结果显示,SLE患者IL-4Ra链lle50的频率明显升高。多项研究表明,在SLE发病过程中,IL-2、IL-12、IFN-1的产生减少,而IL-6、IL-10的产生增加,导致Th1和Th2型细胞因子的不平衡。在SLE患者中,Th2反应占主导地位。IL-4和IL-4R介导的信号传导在Th0细胞向Th2细胞转化过程中至关重要。此外,对IL-4R Gln551Arg进行了遗传型分析。结果显示,SLE患者IL-4R链Arg551的频率较对照组明显升高。因此,IL-4R基因多态性导致受体功能增强在SLE的发展中起着重要作用,可能通过诱导Th2亚型的发展,并在其他遗传或环境因素的作用下促进自身抗体的产生 [21-22]。
4.4 IL-4R/IL-4Rα与其它自身免疫疾病研究
IL-4R/IL-4Rα的多态性已被证实还与其它多种自身免疫性疾病相关。研究指出,IL-4Rα Q576R多态性在特应性皮炎患者中促进了Th2细胞的增加,而这种细胞类型通常与过敏反应有关,而特应性皮炎则是一种常见的过敏性疾病 [23];IL-4R基因rs1805013位点多态性可能增加骨关节炎的患病风险 [24]。一项针对高加索人群的研究,研究者探索了IL-13/IL-4/IL-4R系统中18个SNPs与手关节易感性的关系,结果证实了IL-4/IL-13系统在手关节炎发病机制中的重要作用 [25];IL-4Ra基因的I75V位点在肌无力患者中显著增高,特别是在女性患者和AChR抗体阳性患者中。这种变异可能通过影响IL-4R/IL-4Rα信号传导,导致免疫反应失衡,进而影响肌无力的发展 [26]。
4.5 IL-4R/IL-4Rα与病毒研究
宿主细胞的细胞因子受体在信号传导中扮演着关键角色,并且常常成为病毒攻击的首要目标,其中包括BMPR2、CCR5、CCR7、FGFR1、IL17RB、IL1R1、IL4R、PDGFRA、TLR2和TNFRSF11B。最新研究表明,抑制IL4R或敲低IL4R基因可以有效阻止呼吸道合胞病毒(RSV)引起的新生小鼠肺部损伤和鼻病毒(RV)诱导的气道黏液分泌 [27-28]。此外,研究还发现,HIV-1型tat基因通过促进IL4R的转录上调来维持其自身的复制。这些发现揭示了IL-4R/IL-4Rα在多种病毒引发的疾病过程中的重要作用 [29]。
4.6 IL-4R/IL-4Rα与癌症研究
IL-4R/IL-4Rα在癌症发生和发展中可能扮演着重要角色。研究发现,IL4R在肝瘤组织中表达水平较高,并且与肿瘤的分化状态密切相关。进一步的研究揭示,IL4R通过调节JAK1/STAT6和JNK/ERK1/2信号通路的活性,其在调控肝癌细胞的增殖和转移中发挥重要作用 [30];IL-4与IL4R的结合能够诱导人乳腺癌细胞进行程序性死亡,这表明IL-4/IL4R信号通路在乳腺癌的治疗中可能具有潜在作用 [31];IL-4/IL4R信号通路也显示出能够抑制急性淋巴细胞白血病(B-CLL)癌细胞的增殖,并阻止它们进入G1期 [32]。这些发现暗示了IL-4R在癌症研究中可能具有重要的作用,但其详细机制仍需进一步的研究和验证。
5. IL-4R/IL-4Rα的临床药物研究前景
目前,有多达40种针对IL-4R/IL-4Rα的药物正在积极研发中,其中IL-4R/IL-4Rα单抗呈现出极具前景的临床应用。全球首款IL-4R单抗度普利尤单抗(Dupilumab)由赛诺菲(Sanofi)和再生元(Regeneron)公司联合开发,于2017年3月首次获得FDA批准,用于治疗中重度特应性皮炎、中重度哮喘和慢性鼻炎。截至2023年,Dupilumab的销售额已达77亿欧元,赛诺菲预计其销售额将持续猛增,成为免疫治疗领域的重要产品。总体而言,针对IL-4R/IL-4Rα的药物具有广泛的潜力,除了在特应性皮炎、哮喘等自身免疫疾病的药物开发领域,其独特的疗效和不断拓展的适应症将为患者提供更多治疗选择和希望。
为鼎力协助各药企针对IL-4R/IL-4Rα在哮喘、鼻炎、关节炎、病毒、肿瘤等在临床中的研究,j9九游会登录入口首页CUSABIO推出IL-4R/IL-4Rα(CSB-MP011661HU2-B)活性蛋白产品,助力您在对IL-4R/IL-4Rα机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页CUSABIO蛋白IL-4R/IL-4Rα
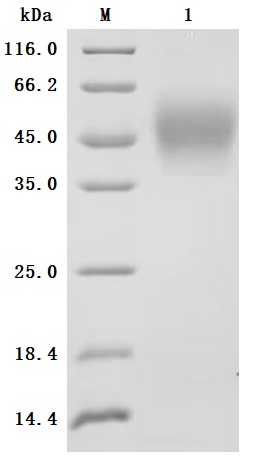
Purity was greater than 95% as determined by SDS-PAGE.
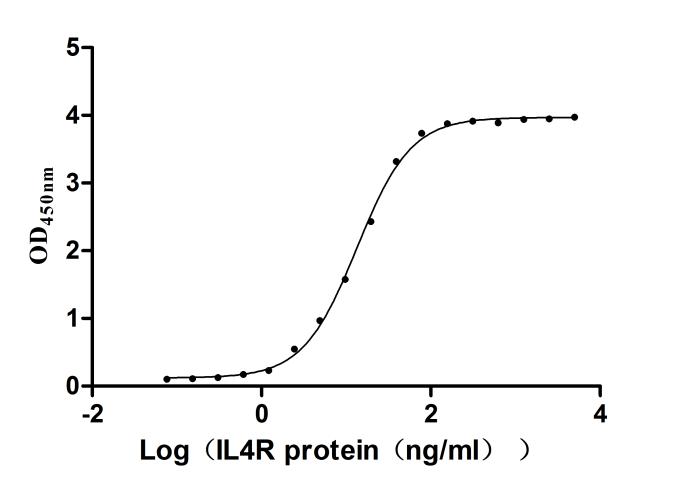
Immobilized Human IL4(CSB-MP011659HU) at 2μg/mL can bind biotinylated Human IL4R. The EC50 is 12.68-14.23 ng/mL.
参考文献:
[1] Goutet, Michèle, et al. "Identification of contact and respiratory sensitizers according to IL-4 receptor α expression and IL-2 production." Toxicology and applied pharmacology 260.2 (2012): 95-104.
[2] Blaeser, Frank, et al. "Targeted inactivation of the IL-4 receptor α chain I4R motif promotes allergic airway inflammation." The Journal of experimental medicine 198.8 (2003): 1189-1200.
[3] Suzuki, Akiko, et al. "Targeting of IL-4 and IL-13 receptors for cancer therapy." Cytokine 75.1 (2015): 79-88.
[4] Andrews, Allison-Lynn, et al. "IL-4 receptor α is an important modulator of IL-4 and IL-13 receptor binding: implications for the development of therapeutic targets." The Journal of Immunology 176.12 (2006): 7456-7461.
[5] Oiso, N., K. Fukai, and M. Ishii. "Interleukin 4 receptor α chain polymorphism Gln551Arg is associated with adult atopic dermatitis in Japan." British Journal of Dermatology 142.5 (2000): 1003-1006.
[6] Bao, Katherine, and R. Lee Reinhardt. "The differential expression of IL-4 and IL-13 and its impact on type-2 immunity." Cytokine 75.1 (2015): 25-37.
[7] Mommert, Susanne, et al. "Expression of histamine receptors H2R and H4R are predominantly regulated via the IL‐4/IL‐13 receptor type II on human M2 macrophages." Allergy 76.9 (2021): 2886-2890.
[8] Iwaszko, Milena, Sylwia Biały, and Katarzyna Bogunia-Kubik. "Significance of interleukin (IL)-4 and IL-13 in inflammatory arthritis." Cells 10.11 (2021): 3000.
[9] Etter, Hansueli, et al. "IL-4 and IL-13 downregulate rolling adhesion of leukocytes to IL-1 or TNF-α-activated endothelial cells by limiting the interval of E-selectin expression." Cytokine 10.6 (1998): 395-403.
[10] Brooks, B. M., A. L. Thomas, and J. W. Coleman. "Benzylpenicillin differentially conjugates to IFN-γ, TNF-α, IL-1 β, IL-4 and IL-13 but selectively reduces IFN-γ activity." Clinical & Experimental Immunology 131.2 (2003): 268-274.
[11] Jiang, Hong, Miera B. Harris, and Paul Rothman. "IL-4/IL-13 signaling beyond Jak/Stat." Journal of Allergy and Clinical Immunology 105.6 (2000): 1063-1070.
[12] Chatila, Talal A. "Interleukin-4 receptor signaling pathways in asthma pathogenesis." Trends in molecular medicine 10.10 (2004): 493-499.
[13] Humbert, M., et al. "L'interleukine 4 et ses récepteurs dans l'asthme: données actuelles." Revue française d'allergologie et d'immunologie clinique 41.1 (2001): 50-54.
[14] Cui, Tianpen, et al. "Polymorphisms in the IL-4 and IL-4R [α] genes and allergic asthma." (2003): 888-892.
[15] Wenzel, Sally E., et al. "IL4Rα mutations are associated with asthma exacerbations and mast cell/IgE expression." American journal of respiratory and critical care medicine 175.6 (2007): 570-576.
[16] 20.Qiao, H‐L., J. Yang, and Y‐W. Zhang. "Relationships between specific serum IgE, cytokines and polymorphisms in the IL‐4, IL‐4Rα in patients with penicillins allergy." Allergy 60.8 (2005): 1053-1059.
[17] Wang, Helen Y., et al. "Cutting edge: Effects of an allergy-associated mutation in the human IL-4Rα (Q576R) on human IL-4-induced signal transduction." The Journal of Immunology 162.8 (1999): 4385-4389.
[18] Huang, Chen-Zheng, et al. "Polymorphisms and haplotype analysis of IL-4Rα Q576R and I75V in patients with penicillin allergy." European journal of clinical pharmacology 65 (2009): 895-902.
[19] Tianpen, Cui, et al. "Polymorphisms of IL-4, IL-4Rα, and AICDA genes in adult allergic asthma." Journal of Huazhong University of Science and Technology [Medical Sciences] 23 (2003): 134-137.
[20] Huang, Z. Y., et al. "Association of the IL-4R Q576R polymorphism and asthma in the Chinese Han population: a meta-analysis." Genet Mol Res 14.1 (2015): 2900-11.
[21] Shiroiwa, Wakana, et al. "IL-4Rα polymorphism in regulation of IL-4 synthesis by T cells: implication in susceptibility to a subset of murine lupus." International immunology 19.2 (2007): 175-183.
[22] Munshi, Anjana, et al. "Pharmacogenomics of Allergy and Asthma." Omics for Personalized Medicine (2013): 529-557.
[23] Scibiorek, Martyna, et al. "IL-4Rα signalling in B cells and T cells play differential roles in acute and chronic atopic dermatitis." Scientific Reports 13.1 (2023): 144.
[24] Hammadi, Zainab Abdulrahman, Maan Hasan Salih, and Firas Faris Rija. "Evaluation of Serum Level and Interleukin-4 Receptor (rs1805010) Gene Polymorphism in a Sample of Osteoporosis Women." Tikrit Journal of Pharmaceutical Sciences 17.2 (2023): 39-48.
[25] Vargiolu, M., et al. "Interleukin-4/interleukin-4 receptor gene polymorphisms in hand osteoarthritis." Osteoarthritis and Cartilage 18.6 (2010): 810-816.
[26] Zsuzsanna, Pál, et al. "Interleukin-4 receptor alpha polymorphisms in autoimmune myasthenia gravis in a Caucasian population." (2012).
[27] Bastid, Jérémy, and Nathalie Bonnefoy. "The emerging role of the IL-17B/IL-17RB pathway in cancer." Frontiers in immunology 11 (2020): 533902.
[28] Marr, Nico, et al. "Assessment of genetic associations between common single nucleotide polymorphisms in RIG-I-like receptor and IL-4 signaling genes and severe respiratory syncytial virus infection in children: a candidate gene case-control study." PLoS One 9.6 (2014): e100269.
[29] Real, Fernando, et al. "S100A8-mediated metabolic adaptation controls HIV-1 persistence in macrophages in vivo." Nature communications 13.1 (2022): 5956.
[30] Kim, Sung Dae, et al. "The malignancy of liver cancer cells is increased by IL-4/ERK/AKT signaling axis activity triggered by irradiated endothelial cells." Journal of Radiation Research 61.3 (2020): 376-387.
[31] Parveen, Sadiya, et al. "IL-4 receptor targeting as an effective immunotherapy against triple-negative breast cancer." bioRxiv (2020): 2020-08.
[32] Allegra, Alessandro, et al. "Clinico-biological implications of modified levels of cytokines in chronic lymphocytic leukemia: A possible therapeutic role." Cancers 12.2 (2020): 524.











