CD70(CD27L/TNFSF7):TNF受体超家族成员,红斑狼疮、关节炎、肿瘤临床研究的火热靶点!
日期:2024-03-01 17:20:35
2024年1月27日,《Journal of Autoimmunity》发表的一项研究关注了CD70甲基化在红斑狼疮SLE中的作用。结果显示,SLE患者的CD4+ T细胞CD70基因的DNA平均甲基化水平高,且甲基化水平随着年龄增加而升高,可能与加速衰老有关,这为深入研究SLE的发病机制和潜在干预提供了重要线索 [1]。最近的一篇报道指出,通过免疫信息学技术,研究者设计了一款针对肾细胞癌的CD70蛋白疫苗。该疫苗包含特异性T细胞表位、细胞穿透肽和肿瘤坏死因子-α。计算机模拟显示,该疫苗具备出色的抗原性、安全性、广泛适用性和强大的结合能力,同时对B细胞和T细胞有高效刺激。这表明CD70在肿瘤免疫治疗策略中具有巨大的潜力 [2]。CD70属于肿瘤坏死因子(TNF)受体超家族成员,是广泛报道的T、B细胞免疫共刺激分子。大量研究已证实,CD70在免疫疾病和肿瘤中发挥重要作用,是目前临床研究的热门靶点!今天我们一起来了解下这个相当具有吸引力的靶点!
1. 什么是CD70?
1.1 CD70的结构
CD70(又称Tumour Necrosis Factor Receptor Super Family,TNFSF7、CD27L、CD27LG),属于肿瘤坏死因子受体超家族成员。这个TNF超家族由20多个膜结合蛋白配体和分泌蛋白配体组成,如TNFa、淋巴毒素、CD30L、CD40L、FasL、OX40L、4-1BBL、NF-kB(RANKL)的受体活化剂、增殖诱导配体(APRIL)、B淋巴胞兴奋剂(BLyS)、神经生长因子(NGF)和TNF相关的细胞亡诱导配体(TRAIL)。人CD70基因定位于染色体19p13,由193个氨基酸组成的三聚体,分子量约为50 kDa。结构上,CD70包括胞外结合区、跨膜区、短的胞内序列以及两个N末端糖基化序列。胞外结合区的155个氨基酸序列在折叠部分与TNF配体超家族的其他成员具有显著的同源性。胞外膜区的第一和第三个半胱氨酸,以及第二和第四个半胱氨酸分别形成二硫键,维持CD70特定的空间结构(图1) [3-7]。
1.2 CD70的表达
CD70在人和小鼠的胸腺髓质上皮细胞(medullary thymic epithelialcells,MTECs)和肠道固有层某些非常规的APC亚群上组成性表达。除此之外,CD70仅在激活的T细胞、B细胞以及树突状细胞表面瞬时表达,由于受模式识别受体(pattern recognition receptor,PRRS)、T细胞和B细胞表面抗原受体的控制,CD70的表达被严格调控,且受细胞因子IL-1a、IL-12、TNF-a、前列腺素E2的调控,以及CD28和CD40共刺激的影响。上皮细胞及其他细胞类型在恶性转化时也可表达CD70 [3-5, 8]。
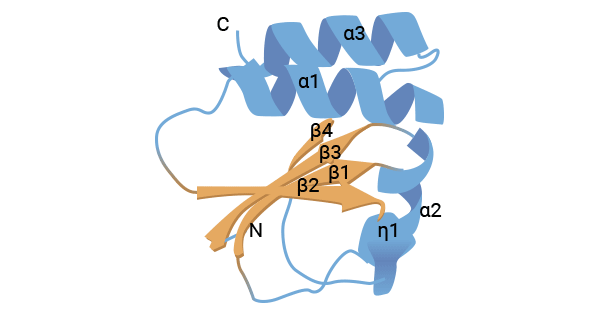
图1. CD70的结构 [7]
2. CD70-CD27配受体的生物学功能
CD70被认为与其唯一的受体CD27相结合。CD27是TNFR家族中的肿瘤坏死因子受体(TNFR)相关因子结合成员。TNFR成员还包括CD30、CD40、CD134(OX40)和CD137(4-1BB)。这些受体,在调控细胞的生长、分化、凋亡或程序性死亡中起着非常重要的作用。CD27-CD70主要为T、B细胞提供有关激活、增殖、存活和记忆性细胞形成共刺激信号 [8-10]。
一些研究表明CD27-CD70共刺激还能使胸腺中发育的Treg细胞免于死亡,增加肿瘤小鼠脾脏和淋巴结中Treg的数量,促进T细胞分化。CD27-CD70信号的缺失可抑制后肢缺血小鼠模型侧支循环的发生。同时,也有研究表明CD27-CD70共刺激信号参与了CD4+T细胞介导的自身免疫病。因此,CD27-CD70相互作用对调节细胞免疫反应至关重要(图2) [11-13]。
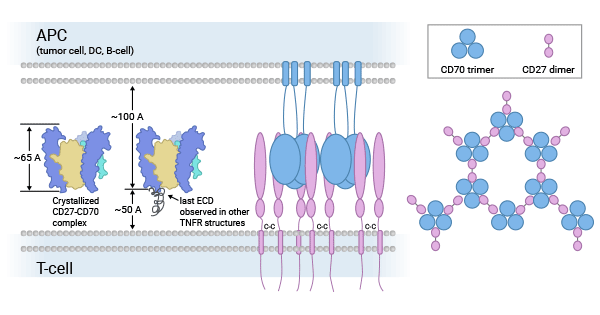
图2. CD70-CD27配受体的生物学功能 [9]
3. CD70相关的信号通路
CD70/CD27L/TNFSF7是CD27的特异性配体,在相互作用时触发了多种生物学响应。CD27通过与TRAFs(如TRAF2和TRAF5)结合,激活NF-kB和c-Jun激酶通路,精准调控细胞的增殖、存活和分化。同时,CD27还能结合调亡介质Siva 1,扩展了其在细胞信号传导中的功能。有研究揭示了CD27通过NIK激活NF-kB通路,参与抗凋亡作用,为免疫调控提供了复杂而精密的调控机制。除了通过CD27传递信号,一些研究显示CD70本身具有信号属性。这些研究报道通过CD70传递的信号活化磷脂肌醇-3(PI3)和MAP激酶途径。CD70信号被证明可调节原发性B细胞的细胞周期,同时触发NK细胞、T细胞受体(TCR)yδ+和一些TCRaβ+T细胞克隆的细胞毒性(图3) [14-15]。
通过多种动物模型研究,科学家们确认了CD70-CD27通路在调节T淋巴细胞功能中的重要作用。这一通路对于病毒特异性CD8+T淋巴细胞的有效存活至关重要,而活化的CD8+T淋巴细胞分泌的CXCL10在CD70-CD27共刺激中还扮演了趋化剂的角色,也表明了这一通路在免疫细胞间的复杂调控作用。同时,研究表明CD27信号对于幼稚CD4+T细胞的作用,包括增强Th1特异性转录因子T-bet,促进其分化为能分泌IFN-γ的Th1细胞。最新的临床试验在黑色素瘤的T细胞过继转移中发现,CD27和CD70在输注CD8+肿瘤浸润淋巴细胞上的表达与抗肿瘤作用密切相关。这一发现不仅揭示了CD70-CD27通路在抗癌免疫治疗中的潜在重要性,也为深入理解免疫调节的分子机制提供了重要线索 [16-18]。
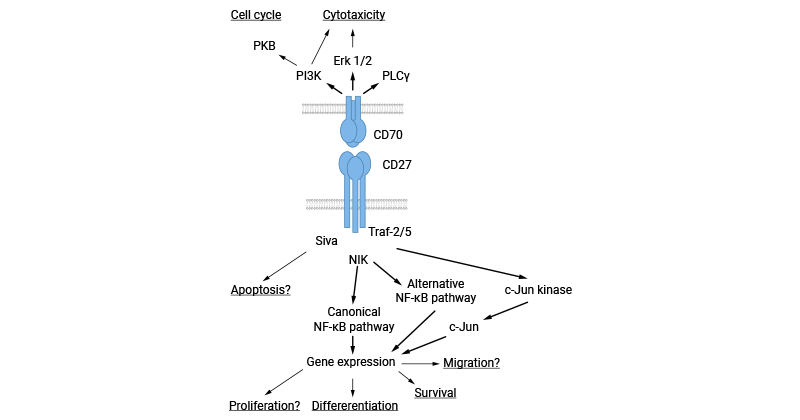
图3. CD70相关的信号通路 [14]
4. CD70和疾病相关的研究
CD70作为一种B细胞共刺激分子,其在B-T细胞接触中,与CD27相互作用促进B细胞分化为浆细胞,从而使免疫球蛋白的生成增多,并且增加活化的自然杀伤细胞的毒性作用。许多证据表明CD70在不同类型的肿瘤中表达(eg.淋巴瘤、实体肿瘤)、自身免疫性疾病(eg.红斑狼疮)中起着重要作用。下面总结一下CD70与肿瘤以及自身免疫性疾病相关的研究。
4.1 CD70和肿瘤研究
4.1.1 CD70和血液肿瘤研究
在血液系统恶性肿瘤中,CD70通常在霍奇金淋巴瘤和源自B细胞或T细胞的淋巴瘤中表达。此外,CD70在其他源自B细胞的恶性肿瘤中也广泛表达,包括弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、B淋巴细胞白血病、多发性骨髓瘤以及Waldenström巨球蛋白血症。一项研究发现,在儿童急性淋巴细胞白血病(ALL)患儿骨髓中,CD27和CD70的表达明显上调。它们在细胞表面存在对白血病细胞的增殖产生显著影响。体外实验中,使用抗人CD70抗体阻断CD27-CD70相互作用后,白血病细胞的增殖显著减少。尽管CD70在血液系统肿瘤细胞中的作用尚不完全清楚,但其在肿瘤细胞上的表达可能反映了正常细胞癌变的过程。因此,针对CD70/CD27信号通导治疗AML可能是一种有前景的治疗研究策略 [19-21]。
4.1.2 CD70和实体肿瘤研究
在实体肿瘤中,CD70普遍表达,且在正常细胞上的限制性表达,使其成为新型抗体治疗实体肿瘤的有望靶点。SGN-75是一种抗体药物偶联剂(ADC),由抗CD70单克隆抗体和细胞毒性药物奥利他丁(Auristatin)组成,具有广泛的临床应用前景。奥利他丁是一种高效的细胞毒药物,通过与α-tublin结合,阻止微管蛋白的聚合。抗CD70抗体ADC的细胞毒活性与其通过内吞酶体途径细胞内化、破坏细胞微管网络以及阻滞G2-M期细胞周期有关。因此,针对CD70的ADC能够选择性地识别、内化肿瘤细胞,并在适当的亚细胞单位释放药物,实现对肿瘤细胞的有针对性杀伤 [22-24]。
4.2 CD70和自身免疫性疾病研究
4.2.1 CD70和红斑狼疮研究
CD70是B细胞共刺激分子,其在系统性红斑狼疮(SLE)患者中表达过度,与异常的B细胞分泌过程有关。抑制CD70的抗体可阻断异常的B细胞分泌过程。研究发现,许多DNA甲基化抑制剂,如Dnmt抑制剂和ERK途径抑制剂,都可增加外周血CD4+T细胞表面CD70的表达。活动性红斑狼疮患者的外周血CD4+T细胞,以ERK信号途径受损、Dnmt表达下降及DNA低甲基化为特征,同样可过表达CD70。在红斑狼疮患者外周血CD4+T细胞中,RFX1可通过招募组蛋白甲基转移酶SUV39H1调节CD70的表达。因此,CD70的抗体可能有望成为SLE治疗的潜在策略 [25-27]。
4.2.2 CD70和类风湿性关节炎
类风湿性关节炎的发病机制包括免疫系统失调,表现为CD4+T细胞和MHC-I型阳性的抗原递呈细胞浸润滑膜关节。B细胞分化为浆细胞,产生免疫球蛋白,形成免疫复合物,激活补体引发炎症。研究发现,类风湿性关节炎患者CD4+T细胞表面表达CD70,并且CD70的过表达可能与CD4+T细胞表面CD70表达的异常调控有关。这种异常调控可能导致CD28表达的丧失,进而引起T细胞活化后细胞表面CD70的持久表达 [28-29]。
4.2.3 CD70与系统性硬皮病
系统性硬皮病是一种多系统自身免疫性疾病,以免疫紊乱、血管异常和器官结缔组织纤维化为特征。系统性硬皮病的病因尚不完全清楚,但遗传易感性、环境因素和免疫系统异常被认为是共同作用的结果。系统性硬皮病相关的自身抗体包括抗着丝点、抗S170、抗拓扑异构酶I和抗U1-RNP等,这些抗体在免疫系统紊乱的中产生。研究显示,在系统性硬皮病患者中,CD4+T细胞表面CD70的过表达与其调控序列低甲基化有关,暗示CD70可能参与了系统性硬皮病的发病机制 [30-31]。
4.2.4 CD70和多发性硬化症研究
发性硬化症是涉及中枢神经系统的免疫相关炎症疾病,主要影响神经组织,特别是女性患者。虽然该病的发病机制尚未完全清楚,但与病毒感染、免疫异常有关。实验性自身免疫性脑脊髓炎被用作多发性硬化症的动物模型,研究指出CD70-CD27相互作用在T细胞和B细胞之间对抗体产生起着关键作用。抗CD70抗体的使用也能通过控制TNF-a的产生来抑制实验性自身免疫性脑脊髓炎。总之,CD70在自身免疫性疾病中具有重要作用,成为依赖抗体治疗的潜在靶点 [32]。
4.2.5 CD70和神经系统自身免疫病研究
对于神经系统自身免疫病,CD70的作用有两面性。一方面,通过阻断CD27-CD70信号通路,可以抑制自身免疫性脑脊髓炎的发展。另一方面,当CD70在特定B淋巴细胞上表达增加时,可能会使小鼠更容易患上自发性和糖蛋白免疫诱导的自身免疫性脑脊髓炎。总的来说,CD70的活化时机和背景似乎在神经免疫疾病的发展中发挥着关键的作用,有时可能促进疾病,有时则可能对疾病产生抑制作用 [33]。
4.3 CD70和其它疾病研究
大规模基因测序研究发现CD70配体CD27基因与银屑病的易感性有关。研究还通过免疫组化方法检测到,在银屑病皮损处的T淋巴细胞上,CD27的表达减少,且血浆中的SCD27水平也下降。尽管这些发现具有一定的指导意义,但CD27-CD70通路在银屑病中的确切作用仍需进一步研究 [35]。
此外,CD70还与炎症性肠病相关。CD70在肠固有层的抗原提呈细胞(APCs)上组成性表达,参与肠道免疫反应和自稳态维持 [36]。最近的研究发现,CD70-T细胞引起更严重的炎症性肠病和移植物抗宿主病,并产生更多炎症因子。IFN-γ诱导T细胞表达CD70,通过调控抑制T细胞增殖,限制炎症性T细胞的反应 [37]。
5. CD70的临床药物研究前景
目前,有53种基于CD70的药物正在研发中,涵盖了多种类型,包括单克隆抗体、CAR-T、ADC、CAR-NK、CAR-NKT、融合蛋白、树突状细胞疫苗以及RNA疫苗。
单克隆抗体通过调节或抑制CD70对肿瘤细胞的生长和转移产生干预效果。ADC通过抗体与连接子和载荷的结合,将毒性物质传递至CD70阳性的肿瘤细胞,同时也瞄准CD30、Tubulin等靶点。CAR-T则通过改造的T细胞识别和消灭CD70阳性的肿瘤细胞,同时对BCMA、CD19等靶点具有作用。
CAR-NK利用改造的NK细胞对CD70阳性的肿瘤细胞进行识别和攻击,同时也对IL15、IL15R、TGFβ、CD19等靶点具有效果。融合蛋白通过蛋白质的结合,调节或抑制CD27、PDL1、CD70、CD47、SIRPα等靶点的信号传导。树突状细胞疫苗通过激活免疫系统,作用于CD70、CD19、CD40L等靶点的肿瘤细胞。RNA疫苗通过转染肿瘤细胞,表达CD70、CD40L和TLR4的融合蛋白,引导免疫应答。
这些CD70相关药物主要应用于肿瘤治疗,尤其是在血液肿瘤领域,如淋巴瘤、白血病和骨髓瘤。同时,它们也展现了在实体瘤治疗(如肾细胞癌、黑色素瘤、胰腺癌)和免疫系统疾病治疗(如风湿性关节炎、狼疮)方面的潜在疗效,涉及的机构包括国际药企(Janssen、CRISPR Therapeutics、Ambrx)和国内创新型药企(普方生物、瓴路药业、宜明昂科),以及高校和医院(浙江大学、复旦大学、MD Anderson Cancer Center)。因此,CD70在肿瘤和免疫系统疾病治疗中呈现广泛前景,在这一领域的不断深入研究和合作中,有望提供更为创新的研究方案。
为鼎力协助各药企针对CD70在血液、实体肿瘤,以及自身免疫性疾病,如红斑狼疮、类风湿性关节炎、系统性硬皮病、多发性硬化症等在临床中的研究,j9九游会登录入口首页CUSABIO推出CD70(CSB-MP004954HU1)活性蛋白产品,助力您在对CD70机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页CUSABIO蛋白CD70
Recombinant Human CD70 antigen (CD70), partial (Active) Code:CSB-MP004954HU1
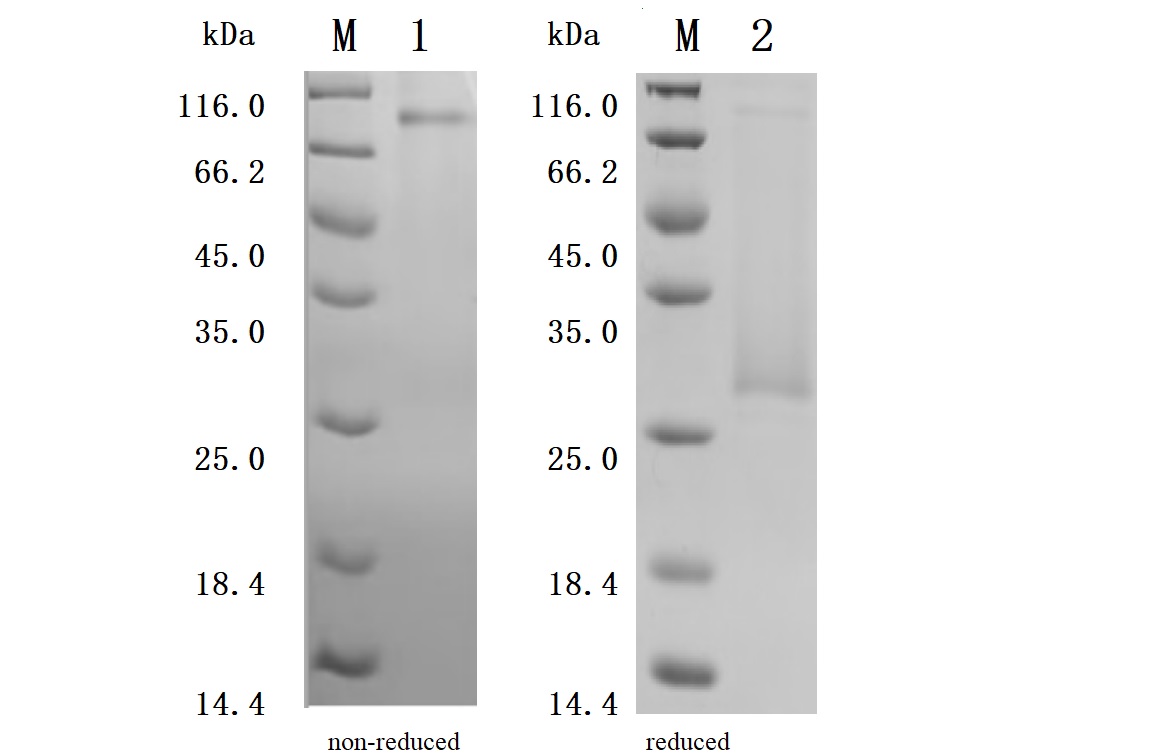
Purity was greater than 92.5% as determined by SDS-PAGE.
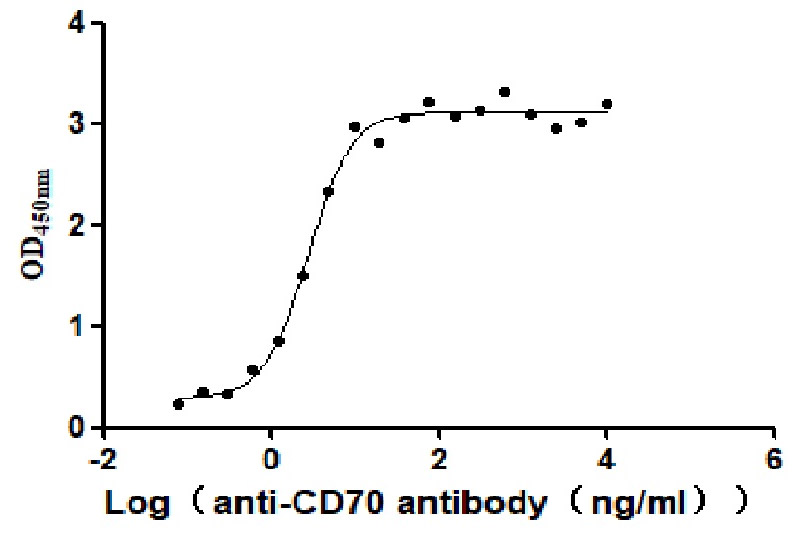
Immobilized Human CD70 at 2 μg/ml can bind Anti-CD70 antibody. The EC50 is 2.414-3.196 ng/mL.
参考文献:
[1] Somers, Emily C., et al. "Associations between CD70 methylation of T cell DNA and age in adults with systemic lupus erythematosus and population controls: The Michigan Lupus Epidemiology & Surveillance (MILES) Program." Journal of Autoimmunity 142 (2024): 103137.
[2] Namdari, Haideh, et al. "Immunoinformatics Approach to Design a Chimeric CD70-Peptide Vaccine against Renal Cell Carcinoma." Journal of Immunology Research 2024 (2024).
[3] Aggarwal, Bharat B., et al. "The role of TNF and its family members in inflammation and cancer: lessons from gene deletion." Current Drug Targets-Inflammation & Allergy 1.4 (2002): 327-341.
[4] Watts, Tania H. "TNF/TNFR family members in costimulation of T cell responses." Annu. Rev. Immunol. 23 (2005): 23-68.
[5] Siegmund, Daniela, and Harald Wajant. "TNF and TNF receptors as therapeutic targets for rheumatic diseases and beyond." Nature Reviews Rheumatology 19.9 (2023): 576-591.
[6] Lubrano di Ricco, Martina, et al. "Tumor necrosis factor receptor family costimulation increases regulatory T‐cell activation and function via NF‐κB." European journal of immunology 50.7 (2020): 972-985.
[7] Dunne, Matthew, et al. "The CD27L and CTP1L endolysins targeting Clostridia contain a built-in trigger and release factor." PLoS pathogens 10.7 (2014): e1004228.
[8] Arroyo Hornero, Rebeca, et al. "CD70 expression determines the therapeutic efficacy of expanded human regulatory T cells." Communications biology 3.1 (2020): 375.
[9] Liu, Weifeng, et al. "Structural delineation and phase-dependent activation of the costimulatory CD27: CD70 complex." Journal of Biological Chemistry 297.4 (2021).
[10] Pandey, Arvind K., et al. "Expression of CD70 modulates nitric oxide and redox status in endothelial cells." Arteriosclerosis, Thrombosis, and Vascular Biology 42.9 (2022): 1169-1185.
[11] Lutfi, Forat, et al. "Targeting the CD27-CD70 pathway to improve outcomes in both checkpoint immunotherapy and allogeneic hematopoietic cell transplantation." Frontiers in Immunology 12 (2021): 715909.
[12] Flieswasser, Tal, et al. "The CD70-CD27 axis in oncology: the new kids on the block." Journal of experimental & clinical cancer research 41.1 (2022): 1-15.
[13] Abolhassani, Hassan. "Specific immune response and cytokine production in CD70 deficiency." Frontiers in Pediatrics 9 (2021): 615724.
[14] Borst, Jannie, Jenny Hendriks, and Yanling Xiao. "CD27 and CD70 in T cell and B cell activation." Current opinion in immunology 17.3 (2005): 275-281.
[15] Denoeud, Julie, and Muriel Moser. "Role of CD27/CD70 pathway of activation in immunity and tolerance." Journal of leukocyte biology 89.2 (2011): 195-203.
[16] Van De Ven, Koen, and Jannie Borst. "Targeting the T-cell co-stimulatory CD27/CD70 pathway in cancer immunotherapy: rationale and potential." Immunotherapy 7.6 (2015): 655-667.
[17] Peperzak, Victor, et al. "CD8+ T cells produce the chemokine CXCL10 in response to CD27/CD70 costimulation to promote generation of the CD8+ effector T cell pool." The Journal of Immunology 191.6 (2013): 3025-3036.
[18] Bowakim-Anta, Natalia, et al. "Chronic CD27-CD70 costimulation promotes type 1-specific polarization of effector Tregs." Frontiers in immunology 14 (2023): 1023064.
[19] Grewal, Iqbal S. "CD70 as a therapeutic target in human malignancies." Expert opinion on therapeutic targets 12.3 (2008): 341-351.
[20] Troeger, A., et al. "Significantly increased CD70 up regulation on TEL-AML positive B cell precursor acute lymphoblastic leukemia cells following CD40 stimulation." Klinische Pädiatrie (2014): 332-337.
[21] Sun, Qian, et al. "P317: ANTI-LEUKEMIA ACTIVITY OF CD70-DIRECTED IMMUNOTHERAPY IN B CELL PRECURSOR ACUTE LYMPHOBLASTIC LEUKEMIA." HemaSphere 7.S3 (2023): e6339407.
[22] Yang, Meijia, et al. "Tandem CAR-T cells targeting CD70 and B7-H3 exhibit potent preclinical activity against multiple solid tumors." Theranostics 10.17 (2020): 7622.
[23] Ryan, M. C., et al. "Targeting pancreatic and ovarian carcinomas using the auristatin-based anti-CD70 antibody–drug conjugate SGN-75." British journal of cancer 103.5 (2010): 676-684.
[24] Barreca, Marilia, et al. "An overview on anti-tubulin agents for the treatment of lymphoma patients." Pharmacology & therapeutics 211 (2020): 107552.
[25] Zhou, Y., et al. "Histone modifications and methyl-CpG-binding domain protein levels at the TNFSF7 (CD70) promoter in SLE CD4+ T cells." Lupus 20.13 (2011): 1365-1371.
[26] Balada, Eva, et al. "Associations between the expression of epigenetically regulated genes and the expression of DNMTs and MBDs in systemic lupus erythematosus." (2012): e45897.
[27] Zhao, Ming, et al. "RFX1 regulates CD70 and CD11a expression in lupus T cells by recruiting the histone methyltransferase SUV39H1." Arthritis research & therapy 12.6 (2010): 1-8.
[28] Nolte, Martijn A., et al. "Timing and tuning of CD27–CD70 interactions: the impact of signal strength in setting the balance between adaptive responses and immunopathology." Immunological reviews 229.1 (2009): 216-231.
[29] O’Neill, Rachel. Essential role of CD27/CD70 pathway in inflammatory T cell response. Diss. faculty of the Graduate School of the University at Buffalo, The State University of New York, 2019.
[30] Jiang, HongYan, et al. "Demethylation of TNFSF7 contributes to CD70 overexpression in CD4+ T cells from patients with systemic sclerosis." Clinical immunology 143.1 (2012): 39-44.
[31] Boutel, Maria Angeliki. Faculty Of Health Sciences. Diss. Aristotle University Of Thessaloniki, 2023.
[32] Dhaeze, Tessa, et al. "CD70 defines a subset of proinflammatory and CNS-pathogenic TH1/TH17 lymphocytes and is overexpressed in multiple sclerosis." Cellular & molecular immunology 16.7 (2019): 652-665.
[33] Lee, Eun Mi, et al. "CD70–CD27 ligation between neural stem cells and CD4+ T cells induces Fas–FasL-mediated T-cell death." Stem cell research & therapy 4.3 (2013): 1-10.
[34] Miller, James, et al. "Soluble CD70: a novel immunotherapeutic agent for experimental glioblastoma." Journal of neurosurgery 113.2 (2010): 280-285.
[35] Boursalian, Tamar E., et al. "Targeting CD70 for human therapeutic use." Therapeutic Targets of the TNF Superfamily (2009): 108-119.
[36] Manocha, Monika, et al. "Blocking CD27-CD70 costimulatory pathway suppresses experimental colitis." The Journal of immunology 183.1 (2009): 270-276.
[37] Leigh, Nicholas D., et al. "Host-derived CD70 suppresses murine graft-versus-host disease by limiting donor T cell expansion and effector function." The Journal of Immunology 199.1 (2017): 336-347.











